香蕉花及其提取物的急性毒性评价
2014-02-25王必尊盛占武胡莹莹
王必尊,盛占武,*,王 会,胡莹莹
(1.中国热带农业科学院海口实验站,海南海口570102;2.海南省香蕉遗传改良重点实验室,海南海口571101;3.海南大学食品学院,海南海口570228)
香蕉花及其提取物的急性毒性评价
王必尊1,2,盛占武1,2,*,王 会3,胡莹莹3
(1.中国热带农业科学院海口实验站,海南海口570102;2.海南省香蕉遗传改良重点实验室,海南海口571101;3.海南大学食品学院,海南海口570228)
通过1次大剂量给药,观察小鼠出现的毒性反应及死亡情况,考察香蕉花及其提取物应用的安全性。依据《中药、天然药物急性毒性研究技术指导原则》进行急性毒性实验,小鼠灌胃给药1次,药后正常饲养,连续观察14d。结果显示:供试品香蕉花及其乙醇提取物在5g/kg剂量下,对KM小鼠灌胃给药急性毒性实验未见明显的毒性反应症状。
香蕉花,乙醇提取物,急性毒性
香蕉花是香蕉成熟采摘后的废弃物,在我国年产约为100多万t,目前在产区大多直接废弃。在我国云南、斯里兰卡、马来群岛、印尼、菲律宾、老挝等国将香蕉花作为蔬菜食用。在印度,香蕉花作为提高女性母乳、减缓痛经和治疗糖尿病的药材食用已有上千年的历史[1]。我国主栽品种巴西和粉蕉的香蕉花富含钙、铁、钾等矿物质和膳食纤维,黄酮含量较高,具有较强的抗氧化活性[2-4]。国外品种Musa x Paradisiaca,Musa sapientum L.和Musa sp.var elakki bale香蕉花的水、氯仿、乙醇提取物具有显著的降血糖、抗氧化、抑制糖尿病小鼠体内AGEs的形成和增加埃利希腹水肿瘤细胞的葡萄糖摄入量的活性[5-11]。前期研究表明,香蕉花营养成分[2]丰富且提取物具有较强的抗氧化和抑制α-糖苷酶活性[12]。本研究拟对两个品种的香蕉花及其乙醇提取物进行急性毒性评价,以期为香蕉花资源的综合利用提供参考。
1 材料与方法
1.1 实验材料
巴西蕉(Musa spp.,Baxijiao)和粉蕉(Musa spp.,Paradisiaca)花蕾 海南省大面积种植;新鲜香蕉花蕾 采摘后,手工剥离花,清洗沥干、40℃干燥、粉碎至200目,黑色聚乙烯塑料袋包装并置于-20℃贮藏;香蕉花乙醇提取物[12]乙醇浓度为60%,料液比为1∶30,提取温度为65℃,提取时间为1h;KM小鼠 体重范围:18.0~22.0g,等级:SPF级,雌雄各半,雌者无孕,由广东省医学实验动物中心提供,实验动物合格证号:No 0066178,实验动物生产许可证号:SCXK(粤)2008-0002;动物饲料 SPF级鼠料,配制符合GB 14924.3-2001标准;羧甲基纤维素钠、苦味酸、品红等试剂 均为国产分析纯。
1.2 实验方法
1.2.1 动物实验预实验 取16只检疫合格的KM种小鼠,雌雄各半,按照“实验中实验动物的标记”标准操作规程将动物分为4组,每组逐一编号。禁食(不禁水)24h后,分别将供试的香蕉花干样及其乙醇提取物配制成125mg/mL的供试品混悬液,1日内给药1次,上午给药。给药途径采用灌胃给药,给药体积为0.4mL/10g,给药最大剂量为5g/kg。给药时观察药物对动物的毒性反应情况、死亡数和死亡时间,从给药当日到给药后48h,依据表1每天观察一次动物的一般症状。实验期间对死亡动物进行大体剖检,检查各主要生命器官(心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、胸腺、膀胱、睾丸、附睾、子宫、卵巢和肠道等)及给药局部是否异常,对异常脏器进一步做病理检查。
1.2.2动物实验正式实验
1.2.2.1动物分组与编号 针对4种供试样品,分别取60只检疫合格的KM种小鼠,按“实验动物分组”标准操作规程分为供试品组、阴性对照组和空白对照组,每组20只,雌雄各半,实验各组分别按中心“实验中实验动物的标志”标准操作规格将动物编号为1~20号,其中1~10为雌性,11~20为雄性。供试品组灌喂香蕉花及其提取物,阴性对照组灌喂羧甲基纤维素钠溶液,空白对照组仅喂食SPF级鼠料。
1.2.2.2剂量设计 供试品组剂量设计:由于在预实验中按“最大给药量”法:给药体积为40mL/kg,给药浓度为125mg/mL,即日给药量为40mL/kg×125mg/mL= 5g/kg时,动物未发生药物毒性,引起动物死亡。因此,正式实验时的给药剂量、浓度和给药体积与预实验一致,故本实验按“最大给药量法”进行。阴性对照组:阴性对照组给予与供试品同等体积的1%(g/mL)羧甲基纤维素钠溶液。对照组:为正常喂食组。给药体积:供试品组和阴性对照组给药容积为40mL/kg(0.4mL/10g)。给药途径:供试品和阴性对照品采用灌胃给药,按“小鼠灌胃给药”标准操作规程执行,全部药量在10s内给完。供试品和阴性对照品给药时间及频率:1日内给药1次,上午给药。小鼠饮食:给药前24h内禁食,不禁水。
1.2.2.3药物配制 供试样品混悬液的配制:称取5g供试样品至于50mL烧杯中,缓慢加入少量配制好的1%(g/mL)羧甲基纤维素钠溶液倒入其中,搅拌均匀,当配制体积为40mL时,供试品混悬液呈粘稠状,经过测试刚好通过小鼠灌胃器,此时浓度为125mg/mL。阴性对照组溶液配制:称取5.0g羧甲基纤维素钠置于干燥烧杯中,加蒸馏水250mL后,加热搅拌成糊状,冷却后移至500mL容量瓶中加水定容,即得500mL浓度为1%(g/mL)羧甲基纤维素钠溶液。
1.2.2.4检测指标 症状观察:给药时查看药物对小鼠的毒性反应情况,登记好小鼠的死亡数量和死亡时间,从给药当日到给药后14d,依据表1每天观察一次小鼠的一般症状,填写“急性毒性实验给药记录表”和“急性毒性实验症状观察记录表”。尸体检查:实验期间对死亡动物进行大体剖检,检查各主要生命器官检查及给药局部是否异常。体重:给药前和给药后1、3、7、14d各称重一次体重。
1.2.2.5大体解剖 所有的动物均应进行大体解剖,包括实验过程中因濒死而处死的动物、死亡的动物以及实验结束时仍存活的动物。

表1 症状观察Table.1 Symptoms observed
1.3 数据处理
用SPSS软件选择“单因素方差分析”法进行统计学处理,计算出均数标准差,并且分析供试品组、阴性对照组与空白对照组之间的体重差异。
2 结果与讨论
2.1 预实验结果
经预实验观察,受试的KM小鼠均未出现死亡也未出现明显的中毒症状,初步结果显示两个品种的香蕉花(巴西蕉和粉蕉)及其提取物的毒性很小,故采用最大给药量法进行正式实验。
2.2 正式实验结果
根据预实验结果,设计以受试物两个品种的香蕉花及其乙醇提取物5g/kg体重的剂量,经口一次灌胃。药后及停药观察期间,各组小鼠进食、饮水均正常,体重呈增长趋势,用SPSS单因素方差分析供试品组与阴性对照组各时段体重的差异,供试品组与空白对照组比较无明显差异(p>0.05),详见表2~表5。各组小鼠外观特征基本正常,毛发色泽正常,有少数动物出现耸毛现象,皮肤颜色粉红正常,耳、眼、口、鼻未见异样分泌物,呼吸道反应正常,未见咳嗽、哮喘及喷嚏现象,四肢活动、步态正常,灌胃后24h内,药物组多数动物排出棕黑色软粪便,24h以后粪便逐渐恢复正常,呈灰褐色,颗粒状成形粪便,无一动物死亡。
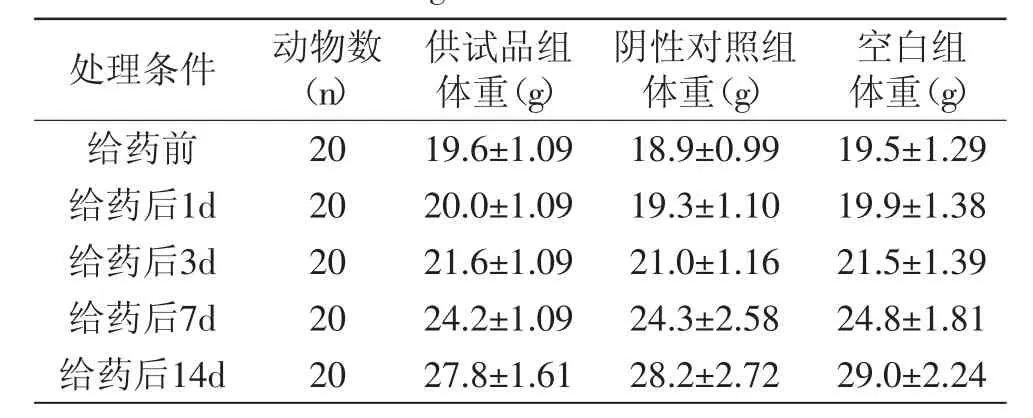
表2 巴西蕉花对KM小鼠体重的影响Table.2 Effect of banana flower(Musa spp.,Baxijiao)on body weight of KM mice
注:用SPSS单因素方差分析检验分析供试品组与阴性对照组各时段体重的差异,p均>0.05;表3~表5同。

表3 粉蕉花对KM小鼠体重的影响Table.3 Effect of banana flower(Musa spp.,Paradisiaca)on body weight of KM mice
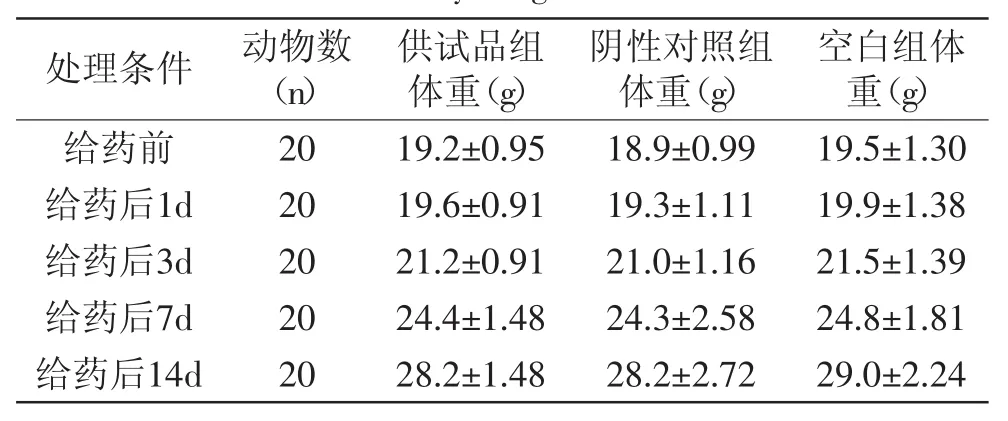
表4 粉蕉提取物对KM小鼠体重的影响Table.4 Effect of banana flower(Musa spp.,Paradisiaca)extract on body weight of KM mice
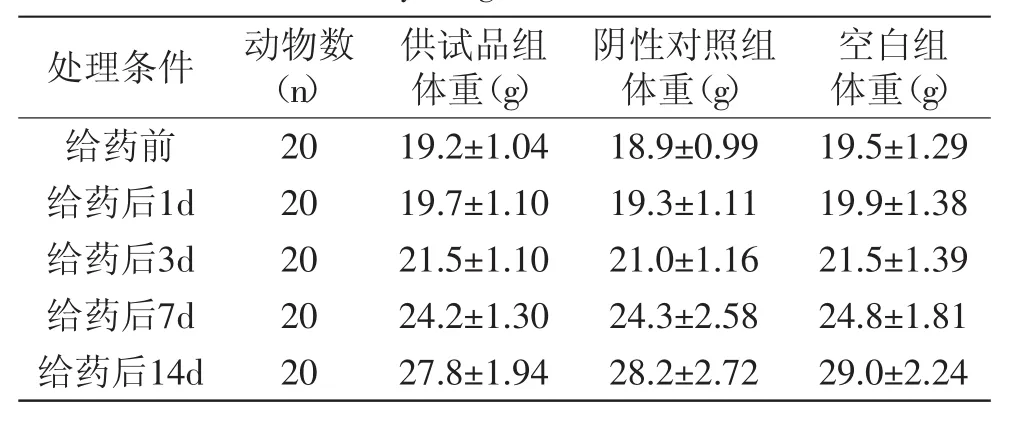
表5 巴西蕉花提取物对KM小鼠体重的影响Table.5 Effect of banana flower(Musa spp.,Baxijiao)extract on body weight of KM mice
2.3 大体解剖
KM小鼠恢复期结束时,供试品组、阴性对照组与空白对照组的小鼠颈椎脱臼处死,对小鼠进行大体剖检,检查给药局部(鼻腔)及各主要生命器官心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、胸腺、膀胱、睾丸、附睾、子宫、卵巢和肠道等未见异常。
3 结论
为观察动物在接受过量供试香蕉花(巴西蕉和粉蕉)及其乙醇提取物后可能产生的急性中毒反应,初步解释其毒性作用,了解可能的毒性靶器官,为香蕉花及其提取物的后续研究提供信息参考,进行了香蕉花及其提取物的急性毒性评价。实验结果表明:供试品组、阴性对照组合空白对照组在给药后均未见异常毒性反应症状,大体剖检各主要组织器官未见异常。与给药前比较,供试品组、阴性对照组合空白对照组小鼠平均体重增长在给药后恢复期期间呈上升趋势。供试的4个样品在5g/kg剂量下,按0.4mL/10g给药,对KM小鼠灌胃给药急性毒性实验未见明显的毒性反应症状。因此,供试品最大剂量大于5g/kg,根据急性毒性(LD50)剂量分级,香蕉花及其提取物属于实际无毒(5001~15000mg/kg)级别。
[1]Grover J K,Yadav S,Vats V.Medicinal plants of India with antidiabetic potential[J].Journal of Ethnopharmacology,2002,81(1):81-100.
[2]盛占武,马蔚红,高锦和,等.巴西蕉花蕾不同部位营养成分分析及评价[J].食品科学,2010(9):263-267.
[3]Sheng Zhanwu,Shan jinxiao,Ma weihong,et al.Antioxidant properties of banana flower of two cultivars in China by DPPH,reducing power,ABTS and inhibition of lipid peroxidation assays [J].African Journal of Biotechnology,2011,10(21):4470-4477.
[4]Sheng zhanwu,Ma weihong,Gao jinhe,et al.Compositional Characteristics and Nutritional Evaluation of Different Tissues of Banana Inflorescence(Musa AAA group cv‘baxijiao’)[J]. African Journal of Biotechnology,2010,9(25):3888-3895.
[5]Bhaskar J J,Mahadevamma S,Nandini C D,et al.Banana(Musa sp.var elakki bale)Flower and Pseudostem:Dietary Fiber and Associated AntioxidantCapacity[J].Journalof Agricultural Food Chemistry,2012,60(1):427-432.
[6]Pari L,Maheswari J U.Hypoglycemic effect of Musasapientum L.in alloxan-induced diabetic rats[J].Journal of Ethnopharmacol,1999,68(1/3):321-325.
[7]Pari L,Maheswari J U.Antihyperglycemic activity of Musa sapientum flowers:effect on lipid peroxidation in alloxan diabetic rats[J].Phytotherapy Research,2000,14(2):136-138.
[8]Dhanabal S P,Sureshkumar M,RamanathanM,et al. Hypoglycemic Effect of Ethanolic Extract of Musa sapientum on Alloxan Induced Diabetes Mellitus in Rats and Its Relation with Antioxidant Potential[J].Journal of Herbal Pharmacotherapy,2005,5(2):7-19.
[9]Mahmood A,Ngah N,Omar M N.Phytochemicals Constituent and Antioxidant Activities in Musa x Paradisiaca Flower[J]. European Journal of Scientific Research,2011,66(2):311-318. [10]Bhaskar J J,Shobha M S,Sambaiah K,et al.Beneficial effects of banana(Musa sp.var.elakki bale) flower and pseudostem on hyperglycemia and advanced glycation endproducts(AGEs)in streptozotocin-induced diabetic rats[J]. Journal of Physiology Biochemistry,2011,67(3):415-425.
[11]Bhaskar J J,Salimath P V,Nandini C D.Stimulation of glucose uptake by Musa sp.(cv.elakki bale) flower and pseudostem extracts in Ehrlich ascites tumor cells[J].Journal of Science Food Agricultural,2011,91(8):1482-1487.
[12]盛占武,唐艳萍,陈昱洁,等.巴西蕉花蕾不同部位提取物的抗氧化活性研究[J].食品科学,2010(17):98-102.
Acute toxicity evaluation of banana flower and its extracts
WANG Bi-zun1,2,SHENG Zhan-wu1,2,*,WANG Hui3,HU Ying-ying3
(1.Haikou Experimental Station,Chinese Academy of Tropical Agricultural Sciences,Haikou 570102,China;2.Hainan Key Laboratory of Banana Genetic Improvement,Chinese Academy of Tropical Agricultural Sciences,Haikou 570101,China;3.College of Food Science,Hainan University,Haikou 570228,China)
Acute toxicity of banana flower(Musa spp.,Baxijiao and Musa spp.,Paradisiaca)and its extracts was evaluated,through once large dose feeding samples and observing the rapid toxicity effect on the KM mice. The test of acute toxicity according to guidance for technology:acute toxicity for traditional Chinese drug and natural drug.Mice were fed by intragastric administration once,after that was fed normal.Then the symptom of mice were observed and recorded in the next 14d.Results showed that there was no evident poisoning symptom or death for mice after test on the mice of different sex,which had eaten these samples with 5g/kg.
Banana flower;ethnoal extract;acute toxicity
TS201.4
A
1002-0306(2014)04-0338-04
2013-06-17 *通讯联系人
王必尊(1962-),男,大学本科,副研究员,研究方向:农业废弃物综合利用。
国家自然科学基金(31201303);海南省自然科学基金(309043)。
