影响辣椒红色素稳定性的因素研究
2014-02-25陈菁,黄明
陈 菁,黄 明
(南京农业大学食品科技学院/教育部肉品加工与质量控制重点实验室,江苏南京210095)
影响辣椒红色素稳定性的因素研究
陈 菁,黄 明*
(南京农业大学食品科技学院/教育部肉品加工与质量控制重点实验室,江苏南京210095)
研究了温度、光照、pH、氧化剂(H2O2和Fe2+)、NaCl离子强度等对辣椒红色素稳定性的影响,比较了茶多酚、2,6-二叔丁基-4-甲基苯酚(BHT)、VE、植酸四种常用抗氧化剂对提高色素稳定性的作用。实验结果表明,辣椒红色素对温度敏感,光照、氧化剂和pH<5的酸性环境都会促进其褪色,而NaCl离子强度对辣椒红色素的稳定性没有影响。四种抗氧化剂中,茶多酚和VE能有效提高色素的稳定性,且最适添加量分别为0.025%和0.01%。
辣椒红色素,稳定性,抗氧化剂
辣椒红色素又名辣椒红,是一种从茄科植物红辣椒中提取、分离、精制而成的食用天然色素,为深红色油溶性液体,色泽鲜艳,属类胡萝卜素类色素。辣椒红色素含有极性较大的红色组分,主要包括辣椒红素(C40H56O3)和辣椒玉红素(C40H56O4),占色素总量的70%~80%,还含有极性较小的黄色组分,主要包括β-胡萝卜素和玉米黄质等。成熟红辣椒中70%~80%的色素以酯的较稳定形式存在[1-3]。作为一种天然着色剂,辣椒红色素不仅颜色鲜艳,着色力强,色价高,而且安全性好,同时具备营养保健功能,现代科学证明其有抗癌、抗辐射等作用[4],已被联合国粮农组织(FAO)以及世界卫生组织(WHO)列为A类色素,在应用中不限制使用量。虽然辣椒红色素的优良性能使其应用广泛,但在运输、储存和使用当中,它会受到各种外界条件的影响而褪色,使得应用性能下降[5]。因此,对辣椒红色素的稳定性进行系统的探讨,对于延缓辣椒红色素褪色、延长其贮存期、使其能更广泛地应用于食品工业意义重大。
1 材料与方法
1.1 材料与仪器
辣椒红色素(食品级) 南京海格利生物工程有限公司;维生素E(DL-α-生育酚,GR>96%) 上海阿拉丁试剂有限公司;2,6-二叔丁基-4-甲基苯酚(BHT)(GR>99%) 上海阿拉丁试剂有限公司;植酸(分析纯) 国药集团化学试剂有限公司;茶多酚(食品级)
南京海格利生物工程有限公司;丙酮(分析纯) 上海久亿化学试剂有限公司;乙醇(分析纯) 南京化学试剂有限公司。
UV-2450紫外可见分光光度计 日本岛津公司;XYI-Ⅲ全数字照度计 杭州新叶光电工程技术有限公司;恒温数显水箱 南京科尔仪器设备有限公司;台灯 飞利浦(中国)公司。
1.2 实验方法
1.2.1 温度对色素稳定性的影响 以丙酮作溶剂,配制体积分数为0.005%的样品溶液,取样品溶液于25mL容量瓶中,分别定容,分别在10、25、40、70、100℃下恒温1h,冷却至室温后重新定容,在波长460nm处测其吸光度[6]。
1.2.2 光照对色素稳定性的影响 取样品溶液置于暗室中,每瓶样品溶液50mL。调节样品溶液与光源的距离,使其分别接受到0、100、200、300、1000lx的光照,每隔12h取样,测其在波长460nm处的吸光度,连续测72h。
1.2.3 pH对色素稳定性的影响 分别取25mL的样品溶液,用0.01mol/L的柠檬酸与柠檬酸钠调节其pH分别到3、4、5、6、7,在波长460nm处测其吸光度,室内暗处放置一周后,再次测定。
1.2.4 氧化剂对色素稳定性的影响 分别配制浓度为100、500、1000μmol/L的H2O2溶液和200、1000、2000μmol/L的FeCl2溶液,各取20mL样品溶液于25mL容量瓶中,同时加入2.5mL不同浓度的H2O2和2.5mL不同浓度的Fe2+溶液,摇匀并倒入比色皿,测定其在波长460nm处的吸光度。在室内暗处放置24h后,再次取样测定。
1.2.5 离子强度对色素稳定性的影响 分别取25mL的样品溶液,用不同浓度的NaCl溶液将色素溶液的离子强度分别调节至0、0.02、0.03、0.04、0.05mol/L,摇匀,在室内暗处放置,每隔1h后取样测定其在波长460nm处的吸光度。
1.2.6 常用抗氧化剂对色素稳定性的影响 将茶多酚、BHT、VE、植酸均溶解在无水乙醇中形成0.2%(质量分数)溶液,然后定量混合至样品溶液中,每份样品溶液中稳定剂的浓度都是0.02%。置于300lx的光照条件下,连续光照9d,每两天测定一次吸光度[7]。
1.2.7 茶多酚、VE的添加量对色素稳定性影响 在25mL的容量瓶中加入样品溶液24.5mL,再分别加入0.5mL不同浓度的茶多酚或VE,使茶多酚的添加量分别为0.01%、0.015%、0.02%、0.025%、0.03%,VE的添加量分别为0.005%、0.006%、0.007%、0.01%、0.015%,摇匀后置于300lx的光照条件下,每两天在波长460nm处测量一次吸光度。
1.3 数据处理
实验结果采用SAS9.2软件统计,进行显著性检验,显著性水平为0.05。
2 结果与分析
2.1 温度对色素稳定性的影响
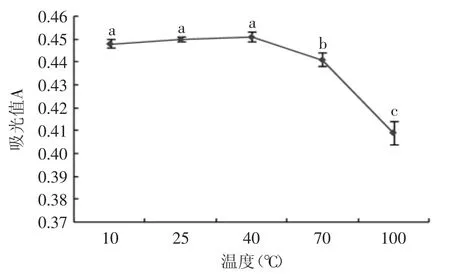
图1 温度对色素稳定性的影响Fig.1 Effect of temperature on the stability of capsicum red pigment
从10℃到40℃,加热对辣椒红色素的吸光度无显著影响(p>0.05)(图1)。但当温度达70℃以上时,色素降解幅度较大,吸光值显著(p<0.05)低于40℃组,并且随着温度的升高,色素降解幅度有增大的趋势。所以,辣椒红色素在适当温度下对热稳定性较好,但若长时间处于高温,会发生褪色现象。有研究表明,此过程中发生的反应主要是聚烯烃环化反应[8],反应中共轭体系两端的π电子形成一个σ-键,其余的π电子进行相应地组合,形成环状不饱和化合物。
2.2 光照对色素稳定性的影响
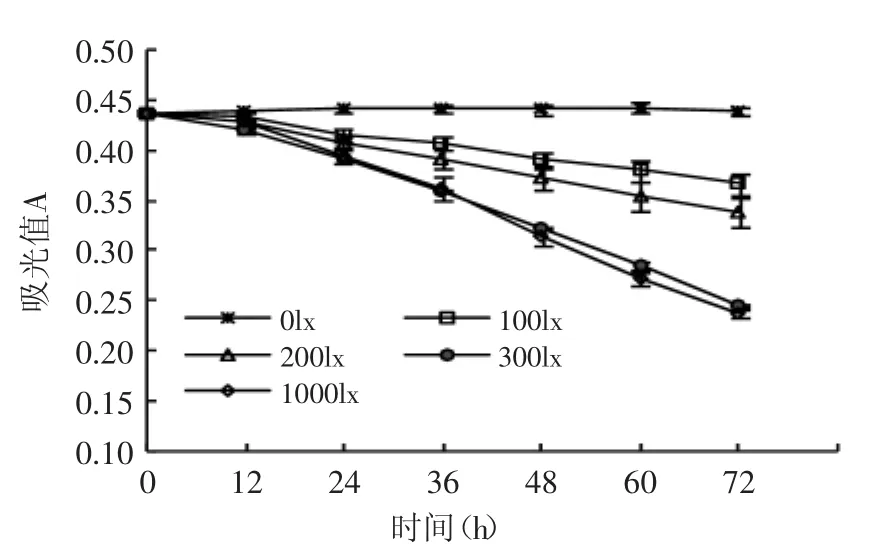
图2 光照对色素稳定性的影响Fig.2 Effect of illumination on the stability of capsicum red pigment
普遍认为,光对类胡萝卜素有两种作用效应,其一是类胡萝卜素会形成顺反双键,使电磁波谱向蓝端漂移2~10nm;其二是加速类胡萝卜素链的氧化,呈色基团降解断裂,光谱向紫外区漂移,同时失去颜色[9]。由图2可见,随着光照时间的延长,色素的吸光度逐渐降低。当光照强度小于300lx时,随着光照强度的升高,吸光度的下降速率加快;1000lx的光照对色素的降解速率的影响与300lx的差异不大,光照72h后,100lx组与200lx组、300lx组与1000lx组的吸光值差异不显著(p>0.05),但200lx组与300lx组差异显著(p<0.05)。说明当光照强度超过一定范围后,色素的降解速率不会继续增加。不同强度的光照对辣椒红色素的降解有程度不一的促进作用,这和前人的结论一致[10-11]。
2.3 pH对色素稳定性的影响
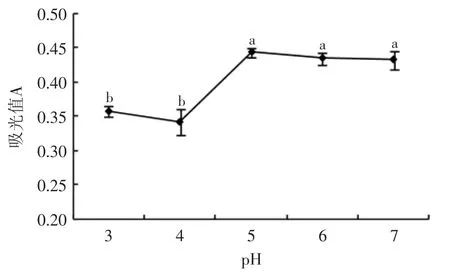
图3pH对色素稳定性的影响Fig.3 Effect of pH on the stability of capsicum red pigment
色素溶液调节pH后即刻测得的吸光度无显著差异(p>0.05),放置一周后的吸光度结果如图3所示。中性及pH=5或6的酸性环境基本不影响辣椒红色素溶液的稳定性,但当pH=3或4时,色素的吸光度显著降低(p<0.05),说明pH<5的酸性环境会使辣椒红色素褪色。前人研究报道了柠檬酸、酒石酸、苹果酸等酸性条件都对类胡萝卜素有一定破坏作用[12],本实验中调pH用到的正是柠檬酸,因此验证了前人的结论。
2.4 氧化剂对色素稳定性的影响
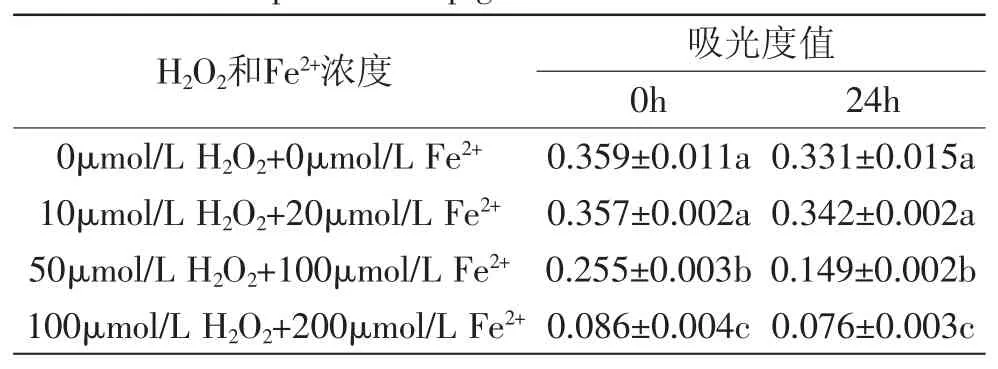
表1 氧化剂对色素稳定性的影响(x±SD,n=3)Table.1 Effect of oxidizing agents on the stability of capsicum red pigmen(tx±SD,n=3)
氧化剂H2O2和Fe2+对辣椒红色素的稳定性影响较大(表1)。随着氧化剂浓度的升高,吸光度下降幅度增大。但当氧化剂加入24h后,吸光度相比0h仍有所下降。10μmol/L H2O2和20μmol/L Fe2+对色素的稳定性无显著影响(p>0.05),但50μmol/L H2O2和100μmol/L Fe2+以上浓度的氧化剂显著(p<0.05)降低了色素溶液的吸光值。前人从实验中得出,辣椒红色素溶液加入不同浓度的H2O2后,色素的稳定性无明显变化[13]。而本实验中,H2O2和Fe2+明显降低了色素的稳定性,可能是因为Fe2+在这里充当了催化剂,催化了氢过氧化物的分解,从而加速了辣椒红色素的氧化过程[14]。
2.5 离子强度对色素稳定性的影响
当离子强度位于0~0.05mol/L之间时,吸光度在3h内变化不大(表2),统计结果表明差异不显著(p>0.05),说明NaCl离子强度对辣椒红色素的稳定性基本没有影响。
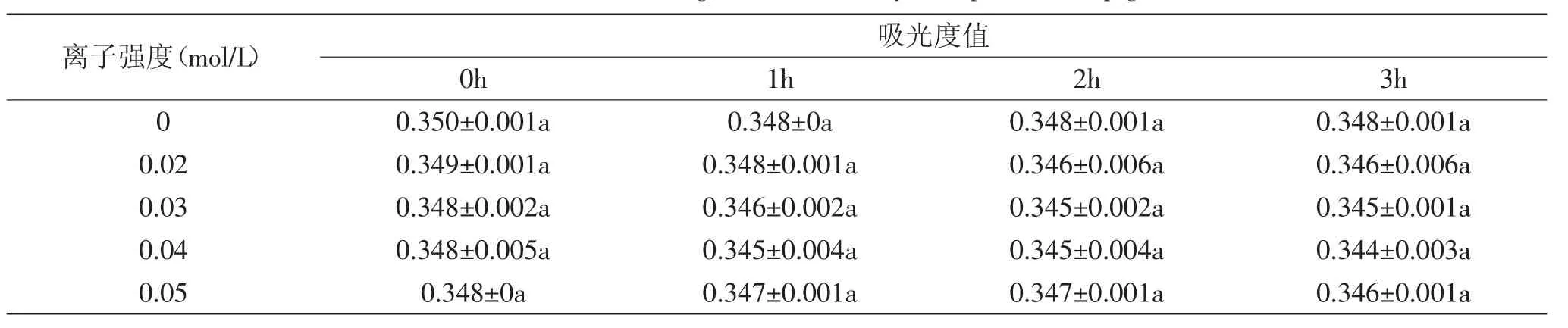
表2 离子强度对色素稳定性的影响Table.2 Effect of ionic strength on the stability of capsicum red pigment
2.6 常用抗氧化剂对色素稳定性的影响
2.6.1 不同抗氧化剂对色素稳定性的影响 茶多酚、BHT、VE和植酸是四种比较常用的抗氧化剂。结果表明,植酸对色素没有保护作用(图4);BHT也没有提高色素的稳定性,可能是因为BHT属于初级抗氧化剂,而初级抗氧化剂是无法抑制光敏氧化反应的[14],因此对本实验中光敏氧化造成的色素褪色没有抑制效果。茶多酚和VE有效地降低了辣椒红色素的降解速度。到第9d时,与对照组相比,茶多酚和VE对色素吸光度降低的抑制都呈现差异显著(p<0.05),这说明添加特定的抗氧化剂有利于提高辣椒红色素的稳定性。同时,这一结果也验证了VE可以增强类胡萝卜素的耐光性这个说法[15]。在同样300lx的情况下,图4中对照组比图2中对照组的降解幅度要小,是因为这次样品体系中加入了乙醇,乙醇可能对辣椒红色素起到了一定稳定作用。

图4 常用抗氧化剂对色素稳定性的影响Fig.4 Effect of common antioxidants on the stability of capsicum red pigment
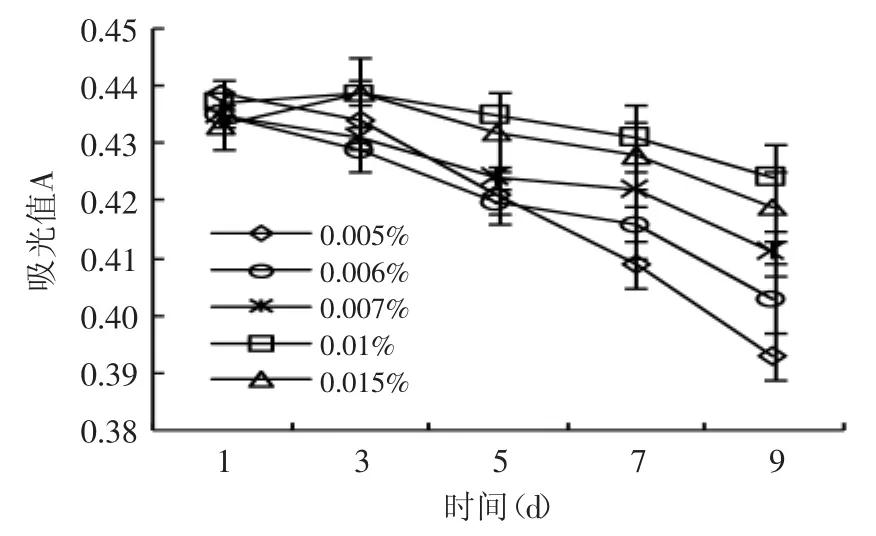
图5 VE添加量对色素稳定性的影响Fig.5 Effect of the addition amount of VEon the stability of capsicum red pigment
2.6.2 VE不同添加量对色素稳定性的影响 当VE(α-生育酚)添加量小于0.01%时,吸光度下降速率随着VE添加量的提高而减小(图5),表明在一定浓度范围内,VE添加量越高,抑制辣椒红色素降解的效果越明显;当添加量达到0.015%时,VE抑制色素降解的效果却略有下降。其原因可能是,当高浓度VE存在时,VE不仅参加抗氧化反应,也参加其他的副反应(如VE与氧气的反应)。当VE的浓度提高,参加抗氧化反应的VE分子相对变少了,可以参加副反应的VE分子增多[16]。可见,0.01%是VE增强辣椒红色素稳定性的最适添加量。这与Huang等[17]的结论相似,0.01%浓度的α-生育酚在玉米油中显示出最大抗氧化活性。VE发挥的抗氧化活性越高,辣椒红色素的氧化程度自然越小,色素越稳定。
2.6.3 茶多酚不同添加量对色素稳定性的影响 在0.01%~0.02%的质量分数范围内,随着茶多酚添加量的提高,辣椒红色素的降解速率呈现减小的趋势(图6)。与0.02%的添加量相比,0.025%的茶多酚添加量明显降低了辣椒红色素的降解速度,9d内色素几乎没有降解。而当添加量提高到0.03%时,抑制色素氧化降解的效果并没有提高,反而有所下降。因此,0.025%是茶多酚作为辣椒红色素稳定剂的最适添加量。茶多酚可与自由基反应生成较为稳定的酚氧自由基,从而能够灭活自由基,发挥抗氧化作用,因此,辣椒红色素的氧化降解得到有效控制。
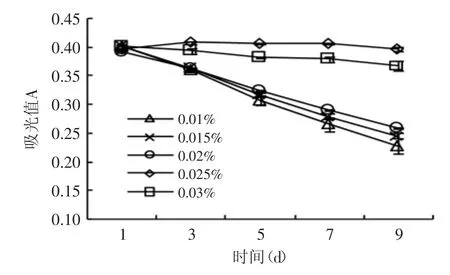
图6 茶多酚添加量对色素稳定性的影响Fig.6 Effect of the addition amount of tea polyphenols on the stability of capsicum red pigment
3 结论
辣椒红色素较长时间处于高温会降解,对光敏感,在中性及pH=5或6的酸性条件下稳定,pH<5的酸性条件下不稳定。耐氧化性差,受氧化剂H2O2+Fe2+混合溶液的影响会发生严重褪色。NaCl离子强度对辣椒红色素无不良影响。常用抗氧化剂中,BHT对辣椒红色素没有效果,植酸反而促进了色素的降解,茶多酚和VE能有效提高色素的稳定性,二者的最适添加量分别为0.025%和0.01%,且茶多酚和VE都属于天然抗氧化剂,符合消费者对健康食品的要求。
[1]王鑫.红辣椒色素的提取、分离及光稳定性研究[D].无锡:江南大学,2005.
[2]简文杰,庞杰.辣椒红色素的分离提取技术[J].中国辣椒,2003(1):29-31.
[3]OSUNA-GARCIA J A,WALL M M,WADDELL C A.Natural antioxidants for preventing color loss in stored paprika[J].Journal of Food Science,1997,62(5):1017-1021.
[4]武占省,江英,赵晓梅.天然辣椒红色素的研究进展[J].中国食品添加剂,2004(6):22-25.
[5]SCHWEIGGERT U,KURZ C,SCHIEBER A,et al.Effects of processing and storage on the stability of free and esterified carotenoids of red peppers(Capsicum annuum L.)and hot chilli peppers(Capsicum frutescens L.)[J].European Food Research and Technology,2007,225(2):261-270.
[6]全国食品添加剂标准化技术委员会.GB 10783-2008食品添加剂辣椒红[S].北京:中国标准出版社,2008.
[7]朱蓓薇,金英实,张彧.提高越桔天然色素稳定性方法的研究[J].食品科学,2003(5):81-84.
[8]CANTRILL R.Paprika extract chemical and technical assessment[R].The 69th JECFA,2008.
[9]皮士卿.类胡萝卜素合成工艺研究[D].杭州:浙江大学,2008.
[10]CARNEVALE J,COLE E R,CRANK G.Photocatalyzed oxidation of paprika pigments[J].Journal of Agricultural and Food Chemistry,1980,28(5):953-956.
[11]李晓霞,蒋林,王德友,等.辣椒红色素在化妆品中的稳定性研究[J].日用化学品科学,2011(11):21-25.
[12]孙明奇,胡建中,潘思轶.柑橘皮类胡萝卜素提取物稳定性研究[J].食品科学,2007,28(10):46-49.
[13]周国海,于华忠,余志勇.朝天椒中辣椒红色素稳定性的研究[J].食品科技,2007(2):170-174.
[14]SHAHIDI F.Bailey’s Industrial Oil and Fat Products[G]. Wiley-Interscience,2005.
[15]许友姣,陆利霞,熊晓辉.提高天然食用色素稳定性技术研究进展[J].食品研究与开发,2008(2):188-192.
[16]Lampi A M,Kataja L,Afaf K E,et al.Antioxidant activities of α-and γ-tocopherols in the oxidation of rapeseed oil triacylglycerols[J].Journal of the American Oil Chemists’Society,1999,76(6):749-755.
[17]Huang S W,Frankel E N,German J B.Antioxidant activity of alpha-and gamma-tocopherols in bulk oils and in oil-inwater emulsions[J].Journal of Agricultural and Food Chemistry,1994,42(10):2108-2114.
Study on factors affecting the stability of capsicum red pigment
CHEN Jing,HUANG Ming*
(College of Food Science and Technology,Nanjing Agricultural University/Key Laboratory of Meat Processing and Quality Control,Ministry of Education,Nanjing 210095,China)
The effects of temperature,illumination,pH,oxidizing agents and ionic strength on the stability of capsicum red pigment were studied.Tea polyphenols,2,6-di-tert-butyl-4-methylphenol(BHT),VEand phytic acid were added to improve the stability of capsicum red pigment.The result showed that the pigment was sensitive to high temperature.Light,oxidants or the acidic environment of pH of less than 5 accelerated the color loss of capsicum red pigment,while ionic strength didn’t affect pigmentary stability.Among these four antioxidants,BHT and phytic acid didn’t show the stabilizing effect in this study.In contrast,both tea polyphenols and VEcould effectively weaken the adverse effect of light on the pigment,and the optimum dosages were respectively 0.025%and 0.01%.
capsicum red pigment;stability;antioxidants
TS202.3
A
1002-0306(2014)04-0287-04
2013-06-08 *通讯联系人
陈菁(1989-),女,在读硕士研究生,研究方向:食品工程。
“十二五”农村领域国家科技计划(2011AA100805-0-2);公益性行业(农业)科研专项(201303083-2);农业科技成果转化资金(2012GB2C100151)。
