小麦苗中超氧化物歧化酶(SOD)提取条件的优化研究
2014-02-25张志清
丛 军,徐 杰,任 飞,张志清
(四川农业大学食品学院,四川雅安625014)
小麦苗中超氧化物歧化酶(SOD)提取条件的优化研究
丛 军,徐 杰,任 飞,张志清*
(四川农业大学食品学院,四川雅安625014)
利用磷酸盐缓冲液提取小麦苗中抗氧化组分超氧化物歧化酶(SOD),对磷酸缓冲液pH、抽提时间、热处理温度、热处理时间四个提取工艺参数进行单因素实验,并采用四因素三水平的响应曲面分析法(RSA)对上述因素的最佳水平范围进行优化,以邻苯三酚自氧化法对超氧化物歧化酶的活性进行测定。结果表明,在磷酸缓冲液pH8.0、抽提时间1h、热处理温度70℃、热处理时间15min的最优工艺条件下酶的活性较高,超氧化物歧化酶的活性可达587.60U/mL,此技术为小麦苗的综合利用提供了新方向。
小麦苗,超氧化物歧化酶(SOD),邻苯三酚自氧化法,响应面法
小麦苗是禾本科植物小麦的嫩茎叶,具有良好的药用价值及丰富的营养。《本草纲目》中写道“麦苗,辛、寒、无毒。主治暴热、目黄。煮汁滤服之,除时疾狂热,退胸隔热,利小肠。作韭食,甚益颜色”[1]。小麦苗生长迅速,茎叶繁茂,柔嫩多汁。新鲜的麦苗富含维生素、矿物质、酶等多种人体所需营养物质[2]。其中麦苗中丰富的SOD、过氧化氢酶可清除氧自由基,分解体内毒素,具有美容,抗衰老的作用。由于小麦苗最佳营养成分时期时效极短,苗高20cm左右就必须收割、利用[3],使得这一宝贵资源尚未被充分开发利用。
目前国内外已对SOD的机理、纯化、应用作了大量的研究,注意力大都集中在以动物血液为来源制取SOD方面上,存在着成本高、含有致热因子等缺陷[8]。有资料表明,SOD在小麦苗中的含量高达0.1%,小麦苗中SOD活性最大可达400U·g-1(鲜重)[3]。超氧化物歧化酶是一种酸性金属酶,广泛存在于动物、植物、微生物体内。SOD能催化超氧阴离子自由基·O2-发生歧化反应,起到提高机体免疫力、延缓衰老并增强对疾病的抵抗力的作用。它不仅在医学、保健等领域有广泛的应用[4-5],而且是制备功能性食品的理想添加剂。
研究表明,缓冲系统的水溶液对酶稳定性好、溶解度大,是提取酶常用的溶剂[6]。超氧化物歧化酶在pH5.3~9.5范围内,其稳定性较好,对pH不甚敏感[7],利用磷酸缓冲溶液处理可以使小麦苗中超氧化物歧化酶很好地溶出,此方法简单易行,对酶活性的影响很小。本研究利用磷酸盐缓冲液法提取小麦苗中的超氧化物歧化酶,再用邻苯三酚自氧化法对超氧化物歧化酶的活性进行测定。在单因素实验的基础上,利用响应面分析方法,并以磷酸缓冲液pH、抽提时间、热处理温度、热处理时间这四个因素,设置不同水平对提取条件进行优化,确定了小麦苗中超氧化物歧化酶的最佳提取条件。本文的创新点在于将最佳营养成分时期的小麦苗作为食品功能性成分提取的原料,这就为小麦苗除在榨汁饮用、提取麦绿素以外开辟了新的利用途径。若能将小麦苗作为提取超氧化物歧化酶这一功能性成分的原料来使用,不但充分利用了小麦苗这一植物资源,而且还能推动小麦的深加工,增加小麦在农业生产中的价值。这对促进小麦资源化利用,推动农业可持续发展,具有深远的意义。
1 材料与方法
1.1 材料与仪器
川麦107 由四川农业大学小麦研究所提供;三羟甲基氨基甲烷(Beijing Solarbio Science&Technology Co.Ltd)、焦性没食子酸、乙二胺四乙酸二钠、浓盐酸、NaH2PO4·2H2O、Na2HPO4·12H2O 成都市科龙化工试剂厂,均为分析纯。
Thermo ST16R型台式高速冷冻离心机 美国Thermo公司;UV-3100PC型紫外可见分光光度计 上海美普达仪器有限公司;Sartorius CP225D型电子天平 德国赛多利斯股份公司;HH-2型数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;BP-20型pH计 Sartorius。
1.2 实验方法
1.2.1 小麦苗预处理 割取生长18d左右、长为20cm左右的小麦苗,洗净、擦干后密封于保鲜袋,放置在冰箱中保存备用。
1.2.2 提取工艺流程 小麦苗→研磨→过滤(双层纱布)→抽提(4℃)→离心(8000r/min,20min)→上清液移入试管→热处理→粗酶液→测定SOD活性。
1.2.3 超氧化物歧化酶活性的测定 参照GB/T5009· 171-2003采用邻苯三酚自氧化法对实验中酶的活性进行测定[9],将25℃时每分钟反应液中SOD抑制邻苯三酚自氧化速率50%时所需的SOD量为一个活力单位。
SOD活性的计算公式如下:
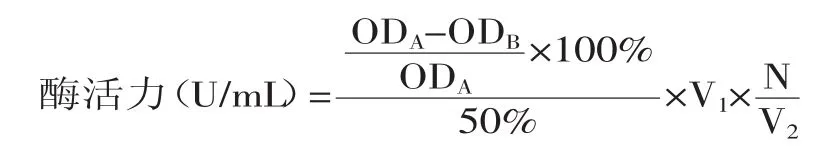
式中:V1—反应液总体积(mL);V2—测定样品体积(mL);N—样品稀释液倍数(本实验的稀释倍数为2);ODA—邻苯三酚的自氧化速率;ODB—样品光密度值变化速率。
1.2.4 磷酸盐缓冲液法提取小麦苗中SOD的主要影响因素单因素实验 称取预处理后的小麦苗2g于研钵中,加入一定量与pH的磷酸缓冲溶液,4℃冰箱中提取一定时间,分别以料液比(m/v)、磷酸缓冲液pH、抽提时间、热处理温度、热处理时间5个工艺参数为考察因素,以SOD活性(U·mL-1)为指标,进行单因素实验,每个处理重复3次。
1.2.5 RSA优化超氧化物歧化酶提取工艺 在单因素实验的基础上,根据Box-Behnken实验设计的自变量,以SOD活性为响应值,利用Design-Expert 7.0软件(Response surface analysis,RSA),选取四个对SOD活性影响较显著的因素,采用4因素3水平的响应面分析方法对小麦苗中SOD的提取工艺进行优化。表1为响应面分析因素与水平。根据Box-Behnken实验设计,参考丁琳、陈莉等的实验设计方法[12-13],综合以上单因素实验所得结果,选取缓冲溶液pH、抽提时间、热处理温度、热处理时间四个对SOD活性影响较显著的因素进行优化。
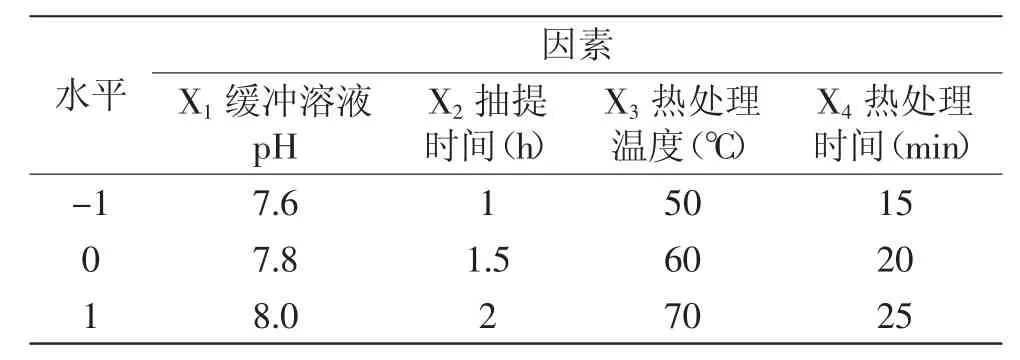
表1 响应面分析因素与水平表Table.1 Analytical factors and levels of RSM
2 结果与分析
2.1 邻苯三酚自氧化速率的确定
按照1.2.3的方法,测得30s与90s时光密度值分别为0.936与1.076,两者之差即为邻苯三酚自氧化速率,本实验测得ODA=0.06。
2.2 磷酸盐缓冲液法提取小麦苗中SOD的主要影响因素分析
2.2.1 料液比对SOD酶活的影响 准确称取2g小麦苗,在磷酸缓冲液pH为8.0、抽提时间1h、热处理温度70℃、热处理时间15min,料液比(1∶1、1∶1.5、1∶2、1∶2.5、1∶3)的条件下,测定SOD酶活,确定最佳料液比。图1为料液比对小麦苗中SOD活性的影响。由图1可知,当料液比低于1∶2时,SOD的活性随料液比的增加而逐渐增大。当料液比为1∶2时,SOD的活性达到最大;而料液比大于1∶2,时SOD的活性逐渐降低。这可能是因为,适当的料液比可以使细胞质和叶绿素的通透性增大,使SOD更好地溶出。但是料液比过高,强离子条件下会使SOD的结构发生改变,稳定性降低,从而影响SOD的活性。因此,综合考虑,选择料液比为1∶2为最佳。
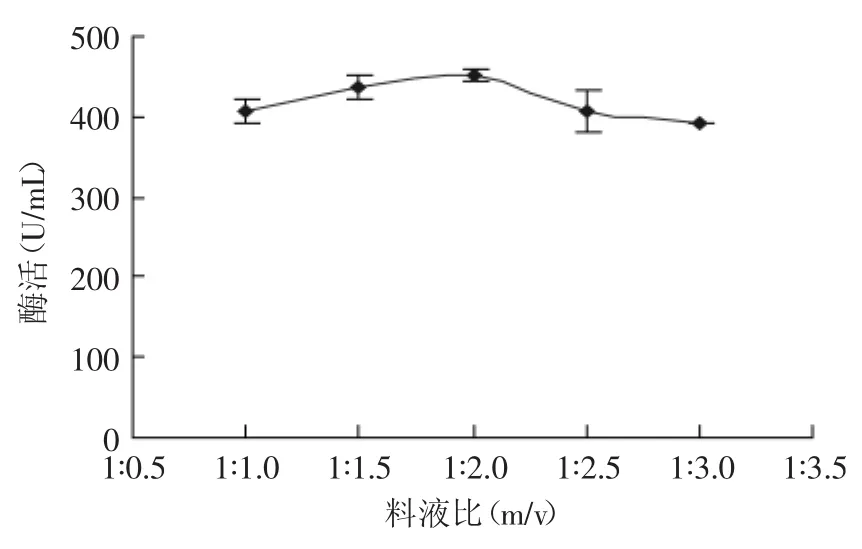
图1 料液比对小麦苗中SOD活性的影响Fig.1 Effect of the ratio of solid to liquid on SOD activity in wheat seedlings
2.2.2 pH对SOD活性的影响 准确称取2g小麦苗,在料液比1∶2、抽提时间1h、热处理温度70℃、热处理时间15min,pH(7.2、7.4、7.6、7.8、8.0)的条件下,测定SOD酶活,确定最佳pH。图2为pH对小麦苗中SOD活性的影响。由图2可知,SOD的活性随pH的增大而逐渐增大,pH=8时达到最大。这是因为SOD在pH5.3~9.5范围内,其稳定性较好。在pH=8时接近了酶的最适pH,因此,选择pH=8为最佳pH。

图2pH对小麦苗中SOD活性的影响Fig.2 Effect of pH on SOD activity in wheat seedlings
2.2.3 抽提时间对SOD活性的影响 准确称取2g小麦苗,在料液比1∶2、热处理温度70℃、热处理时间15min,pH为8.0,抽提时间(0.5、1、1.5、2、2.5h)的条件下,测定SOD酶活,确定最佳抽提时间。图3为抽提时间对小麦苗中SOD活性的影响。由图3可知,抽提时间在1h之内时,SOD的活性随抽提时间的增加而增大。当抽提时间在1h时,SOD的活性达到最大,高于1h后SOD的活性开始明显下降。这说明1h的抽提时间足以使小麦苗中的SOD充分释放出来,虽然SOD是一类含金属辅基的酶蛋白,对热和pH的稳定性较强,但长时间在缓冲溶液中不稳定[11],因此活性开始降低。因此选择抽提时间1h为最佳。

图3 抽提时间对小麦苗中SOD活性的影响Fig.3 Effect of extraction time on SOD activity in wheat seedlings
2.2.4 热处理温度对SOD活性的影响 提取温度对SOD的活性的影响是比较明显的,适当的提高提取温度可以促进SOD从细胞质和叶绿体中游离出来,但是温度过高可能会破坏SOD的结构,使酶失活。本实验准确称取2g小麦苗,在料液比1∶2、热处理时间15min,pH为8.0,抽提时间1h,热处理温度(40、50、60、70、80℃)的条件下,测定SOD酶活,确定最佳热处理温度。图4为热处理温度对小麦苗中SOD活性的影响。由图4可知,当热处理温度小于70℃时,随着温度的升高SOD的活性显著增加,在70℃时达到最大值。这是由于随着温度的升高SOD达到了酶活最适催化温度。但是当温度高于70℃后,SOD的活性有所下降,这可能是一方面由于在高温条件用SOD金属辅基发生分解、断裂,导致SOD对热的稳定性下降;另一方面蛋白质发生变性等化学反应,影响了SOD的活性。
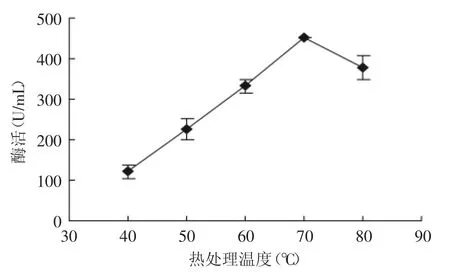
图4 热处理温度对小麦苗中SOD活性的影响Fig.4 Effect of heat treatment temperature on SOD activity in wheat seedlings
2.2.5 热处理时间对SOD活性的影响 准确称取2g小麦苗,在料液比1∶2、pH为8.0,抽提时间1h,热处理温度70℃,热处理时间(10、15、20、25、30min)的条件下,测定SOD酶活,确定最佳热处理时间。图5为热处理时间对小麦苗中SOD活性的影响。由图5可看出,当热处理时间小于15min时,随着时间的增加SOD的活性也逐渐增加,在15min时达到最大值。但是当时间大于15min后,SOD的活性开始下降。这可能是因为长时间在较高温度下SOD结构被破坏,从而影响SOD的活性。因此,综合考虑,选择热处理时间为15min为最佳。
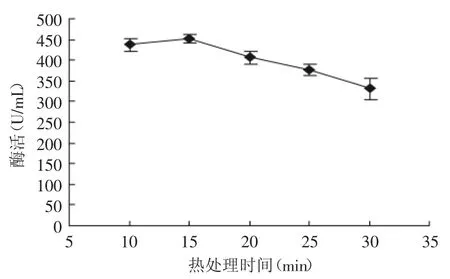
图5 热处理时间对小麦苗中SOD活性的影响Fig.5 Effect of heat treatment timeon SOD activity in wheat seedlings
2.3 响应面分析法优化小麦苗中SOD提取工艺
2.3.1 结果分析 表2为Box-Behnken实验设计及结果,表3为方差分析表。利用Design Expert 7.0软件对表2中的实验数据(响应值)进行多元回归拟合及对模型进行方差分析,分析结果如表3所示。从表3中可以看出,该模型回归显著(p<0.0001),其中X1、X2、 X3、X4、X1X3、X2X3、X2X4对实验结果的影响是极显著的,而X1X2、X1X4、X3X4对实验结果的影响是显著的;失拟项为0.39,值很小,这说明方程在0.05水平下不显著,并且该模型的R2=0.9905,R2Adj=0.9811,说明该回归方程对实际实验拟合情况较好,证明这种实验方法是可靠的。各自变量和响应值之间线性关系显著。在所选取的各因素水平范围内,按照对结果的影响排序为X3>X2>X4>X1,即热处理温度>抽提时间>热处理时间>缓冲溶液pH。
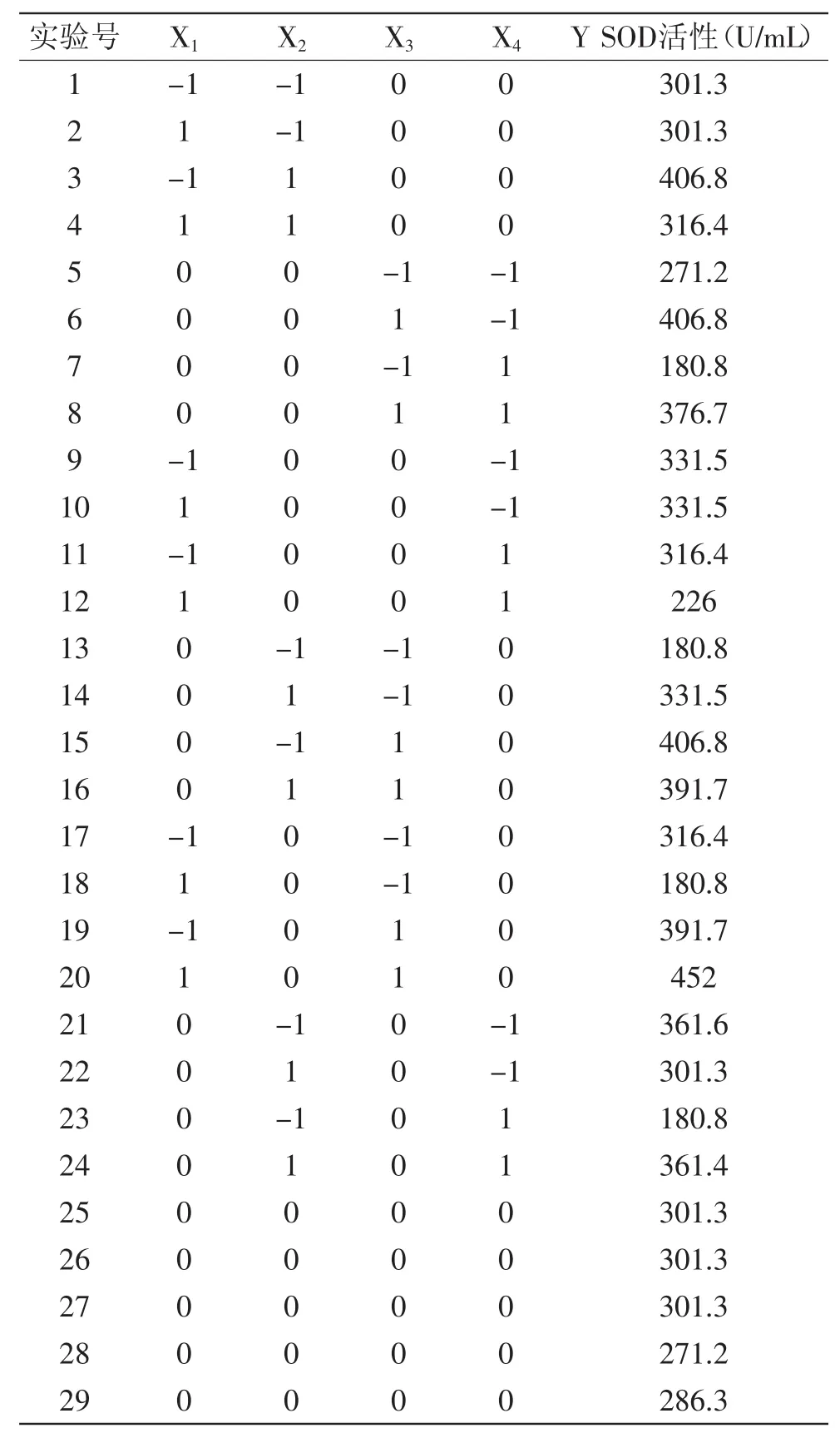
表2 Box-Behnken实验设计及结果Table.2 Box-Behnken design and test results
各因素经二次多项回归拟合后,得到SOD活性对缓冲溶液pH、抽提时间、热处理温度、热处理时间四个因素的二次多项回归方程为:
Y=292.28-21.34X1+31.38X2+80.35X3-30.15X4-22.60X1X2+48.97X1X3-22.60X1X4-41.45X2X3+60.22X2X4+
式中,Y为SOD活性(U/mL);X1为缓冲溶液pH;X2抽提时间(h);X3为热处理温度(℃);X4为热处理时间(min)。

图6 pH与抽提时间对小麦苗中SOD活性的影响Fig.6 Effect of pH and Extraction time on SOD activity in wheat seedlings
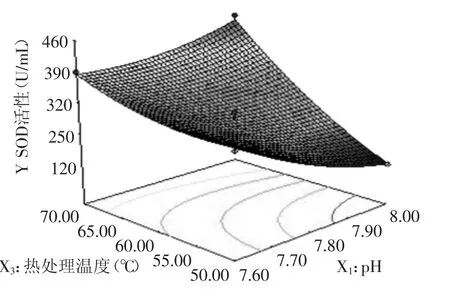
图7 pH与热处理温度对小麦苗中SOD活性的影响Fig.7 Effect of pH and Heat treatment temperature on SOD activity in wheat seedlings

图8 pH与热处理时间对小麦苗中SOD活性的影响Fig.8 Effect of pH and Heat treatment time on SOD activity in wheat seedlings
2.3.2 因素间的交互影响 图6~图11直观的反映了各因素对响应值的影响。等高线的形状可以反映出交互效应的强弱大小,圆形表示两者交互左右不显著,而椭圆形则表示两者交互作用显著。如图6所示,在pH与抽提时间的等高线中,沿抽提时间轴向等高线变化密集,而pH轴向等高线变化相对稀疏,说明抽提时间对响应值峰值的影响比pH大。而如图7所示,在pH与热处理温度的等高线中,沿热处理温度轴向等高线变化密集,而碱pH轴向等高线变化相对稀疏,说明热处理温度对响应值峰值的影响比pH大。又如图8所示,在pH与热处理时间的等高线中,沿热处理时间轴向等高线变化密集,而pH轴向等高线变化相对稀疏,说明热处理时间对响应值峰值的影响比pH大。在图9中,沿热处理温度轴向等高线变化密集,而抽提时间轴向等高线变化相对稀疏,说明热处理温度对响应值峰值的影响比抽提时间大。同样的在图10、图11中,我们可以分别看出抽提时间对响应值峰值的影响大于热处理时间,热处理温度对响应值峰值的影响大于热处理时间。
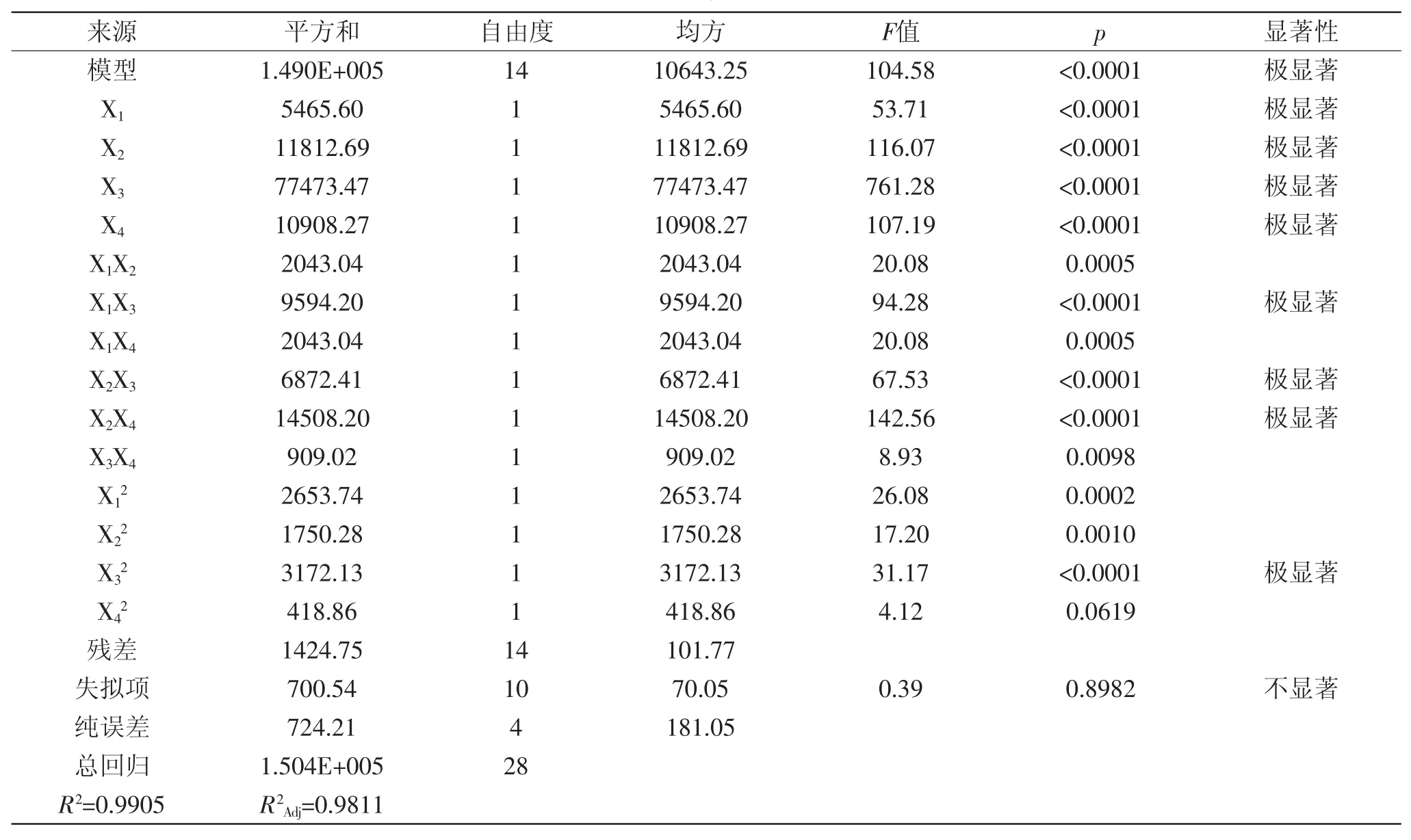
表3 方差分析表Table.3 Analysis of varianc
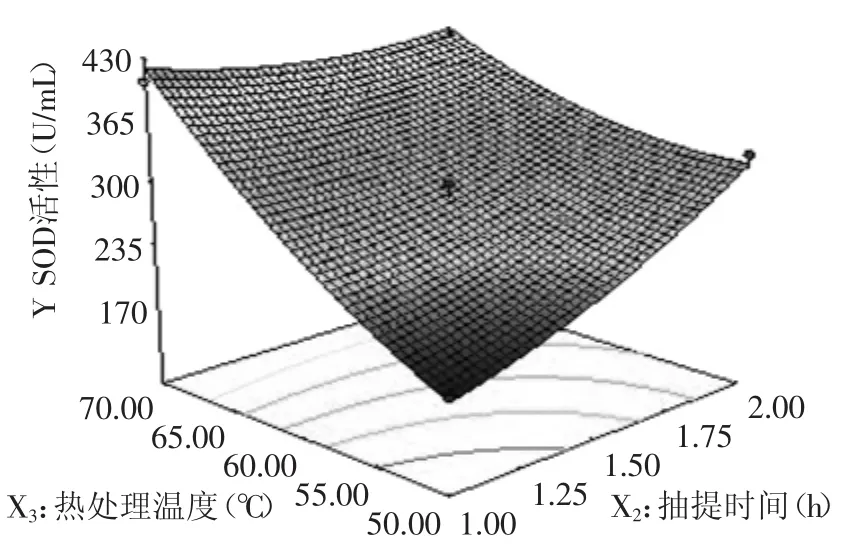
图9 抽提时间与热处理温度对小麦苗中SOD活性的影响Fig.9 Effect of extraction time and heat treatment temperature on SOD activity in wheat seedlings
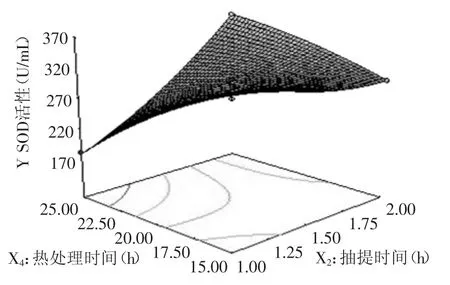
图10 抽提时间与热处理时间对小麦苗中SOD活性的影响Fig.10 Effect of extraction time and heat treatment time on SOD activity in wheat seedlings
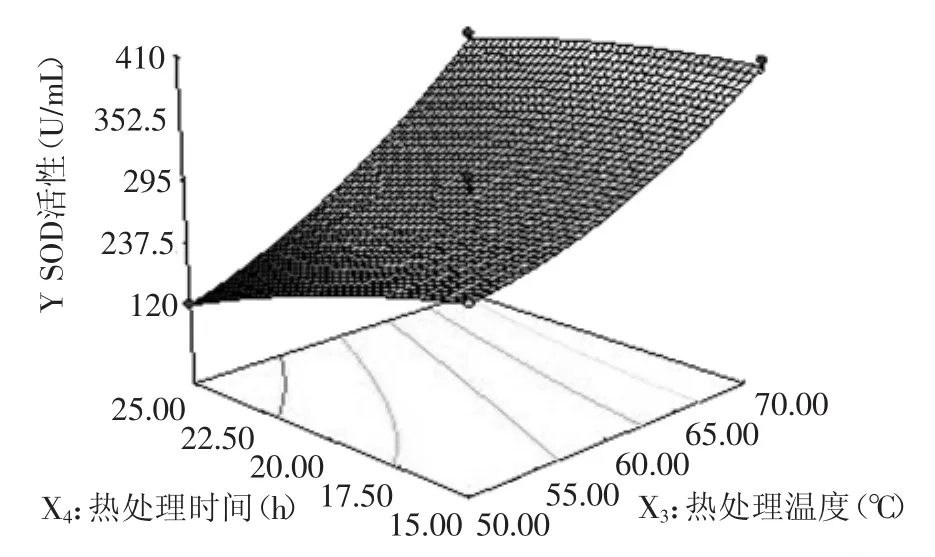
图11 热处理温度与热处理时间对小麦苗中SOD活性的影响Fig.11 Effect of heat treatment temperature and heat treatment time on SOD activity in wheat seedlings
2.3.3 最佳提取工艺的确定 通过Design Expert 7.0软件求解方程,求出模型的极值点为:X1=8.00,X2=1.00,X3=70.00,X4=15.06,Y=580.49。即最佳工艺条件为磷酸缓冲溶液pH为8,抽提时间为1h,热处理温度为70℃,热处理时间为15.06min,SOD的活性为580.49U/mL,根据实际操作情况,将该实验条件稍作改动进行三次平行验证实验,在提取条件为磷酸缓冲溶液pH为8,抽提时间为1h,热处理温度为70℃,热处理时间为15min下得到SOD的活性为587.60U/mL,实验结果与模型预计理论值相差很小,其误差仅为1.2%。这说明,响应面分析法能优化该实验工艺参数,利用响应面优化得到的实验参数真实可靠,具有一定的实用价值。
3 讨论
3.1本实验利用磷酸盐缓冲溶液法提取小麦苗中的超氧化物歧化酶。磷酸盐缓冲溶液是SOD的良好溶剂,适当的料液比可以使SOD很好的溶出。从图2与图4可以看出,小麦苗中SOD在较高的pH与较高的温度下表现出异常的稳定。这可能是因为,一方面SOD的这种特性一般认为与其是金属酶有关,主要发挥作用的是其中的金属辅基。金属辅基的不同其稳定性也有差异[14]。另一方面也与SOD本身结构有关,例如:Cu/Zn-SOD[15]含有大量β-折叠(45%)其亚基由8股逆向平行肽链的β—折叠构成桶状结构,十分稳定。
3.2从植物组织中提取SOD,要考虑多种干扰因素,如植物组织中的酸类、其他酶类、金属离子等。所以SOD活力跟踪测定较之动物组织和血液更复杂。本实验选择邻苯三酚自氧化,该方法所用试剂和仪器比较普通,测试方便,灵敏度高,是目前应用最广泛的一种测试方法,但对温度、pH、邻苯三酚浓度、SOD待测液存放时间等诸因素比较敏感[16],因此测定时要严格控制这些因素。
4 结论
本研究利用磷酸盐缓冲液法提取小麦苗中的超氧化物歧化酶并采用邻苯三酚自氧化法对SOD活性进行测定。在单因素实验的基础下,进行了响应面优化实验,得到了最佳提取工艺:磷酸缓冲溶液pH为8,抽提时间为1h,热处理温度为70℃,热处理时间为15min。在该条件下SOD的理论酶活为580.49U/mL,通过验证实验得到SOD的实际活性为587.60U/mL,误差为1.2%。结果表明,该模型可以较好的反应出小麦苗中SOD的提取条件,可将这技术应用到生产实际中。
本实验以廉价易得的小麦苗作为原料,所采用的试剂价廉、仪器简单、操作简便。该技术可为小麦苗深加工提供一定的技术参考依据,同时也为小麦苗的综合利用提供了新的思路。近年来,利用SOD能清除O2-的功能,SOD产品不断推出,应用于食品、保健、医疗等诸多行业。因此,利用廉价易得的原料,通过简单的加工过程而制备具有重要应用价值的SOD,其前景是十分广阔的。
[1]李时珍.本草纲目谷部[M].北京:人民卫生出版社,1979:1455.
[2]施瑛,汪梅,徐娟,等.麦苗汁的营养成分及其抗氧化活性测定[J].食品科学,2005,26(1):215-218.
[3]黄碧光,刘思衡.麦苗的营养保健价值及其开发利用[J].食品研究与开发,2001(10):2-5.
[4]胡俊,史树贵,李露斯.神经系统疾病与超氧化物歧化酶[J].中国临床康复,2005,33(9):130-133.
[5]杜艳玲,陈瑞.脑缺血状态下超氧化物歧化酶的保护功能[J].中国临床康复,2005,21(9):194-195.
[6]郭勇.酶工程[M].第二版.北京:科学出版社,2004:101-102.
[7]SAKIN M L,OESTERHELT D.Puriification of a manganesecontaining superoxide dismutase from Halo bacterium halobium [J].Arch Biochem BiopHys,1998,260(2):806-810.
[8]田春美,钟秋平.超氧化物歧化酶的现状研究进展[J].中国热带医学,2005,5(8):1730-1732.
[9]李永利.邻苯三酚自氧化法测定SOD活性[J].中国卫生检验杂志,2000,10(6):673.
[10]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[11]张晓燕.超氧化物歧化酶的研究现状及在食品中的应用综述[J].扬州职业大学学报,2002,6(1):34-37.
[12]丁琳.石榴叶超氧化物歧化酶的纯化及性质研究[J].辽宁化工,2005,34(11):464-467.
[13]陈莉,申小蓉,赵红洋,等.佛甲草中SOD提取条件的优化[J].草原与草坪,2009(1):1-6.
[14]张彩莹.不同来源的超氧化物歧化酶部分理化性质比较研究[J].安徽农业科学,2007,35(15):4426-4429.
[15]TANER J A,GETZOFF E D,RICHARDSOM J S,et al. Structure and medcha-nism of copper zinc superoxide dismutase [J].Nature,1983,306:284-287.
[16]许雅娟,赵艳景,胡虹.邻苯三酚自氧化法测定超氧化物歧化酶活性的研究[J].西南民族大学学报,2006,32(6):1207-1212.
Study on optimization of SOD extraction conditions from wheat seedlings
CONG Jun,XU Jie,REN Fei,ZHANG Zhi-qing*
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
The phosphate buffer was used to extract SOD,the antioxidant component of wheat seedlings.Four key extraction process parameters factors selected for single-factor tests were phosphate buffer pH value,extraction time,heat treatment temperature,and the heat treatment time.Four factors and three levels of response surface analysis(RSA)was used to determine the optimum levels of four factors above.Then activity of the SOD was measured by adjacent benzene three phenolic autoxidation method.RSA results indicated that the optimal levels of these parameters were as follows:phosphate buffer pH value 8.0,extraction time 1h,the heat treatment temperature 70℃and the heat treatment time 15min.Under these conditions,the activity of the SOD was up to 587.60U/mL.This study provided a new direction for the comprehensive utilization of wheat seedlings.
wheat seedlings;superoxide dismutase;adjacent benzene three phenolic autoxidation method;response surface analysis
Q937.1
B
1002-0306(2014)04-0213-06
2013-07-04 *通讯联系人
丛军(1988-),男,硕士研究生,研究方向:功能性食品。
四川省教育厅重点项目(09ZA081)。
