基质固相分散-高效液相色谱法同时测定冬虫夏草和蛹虫草中的9种核苷及碱基
2014-02-25王志兵张洪玉方志勇陈思蓉
王志兵,张洪玉,刘 洋,方志勇,陈思蓉,李 硕
(长春工业大学化学与生命科学学院,吉林长春130012)
基质固相分散-高效液相色谱法同时测定冬虫夏草和蛹虫草中的9种核苷及碱基
王志兵,张洪玉,刘 洋,方志勇,陈思蓉,李 硕
(长春工业大学化学与生命科学学院,吉林长春130012)
目的:建立基质固相分散-高效液相色谱法(MSPD-HPLC)同时测定野生冬虫夏草、深层发酵培养的蛹虫草菌丝体和固态培养的蛹虫草子实体中的腺嘌呤、腺苷、胸腺嘧啶、胸苷、尿嘧啶、尿苷、胞嘧啶、鸟苷和虫草素。方法:采用MSPD-HPLC法同时测定上述9种核苷及碱基。结果:MSPD提取条件为:弗罗里硅土为分散剂,分散剂与样品质量比为4∶1,15mL石油醚为淋洗剂,15mL甲醇为洗脱剂。标准曲线在线性范围内具有较好的线性关系(r>0.9997),化合物的检出限和定量限分别为12.4~79.4ng·mL-1和41.2~264.6ng·mL-1。日内和日间精密度均低于7.28%。样品加标回收率在81.54%~95.77%之间。结论:本法简单快速,样品用量少,可广泛应用于中草药和生物药品中核苷和碱基的同时测定。
基质固相分散,核苷类物质,冬虫夏草,蛹虫草子实体,蛹虫草菌丝体,高效液相色谱
冬虫夏草(Cordyceps sinensis(Berk.)Sacc.)作为我国传统名贵中药,含有虫草素、虫草多糖、虫草酸和SOD[1-2]等多种活性成分,常用于治疗盗汗、高血糖、高血脂、肾衰竭、心律不齐、心脏病和肝炎等多种疾病[3-5]。由于野生冬虫夏草稀缺、价格昂贵,许多研究者致力于寻找冬虫夏草的替代品。目前,人们通过深层发酵培养和固态培养技术获得了大量蛹虫草(Cordyceps militaris)菌丝体和子实体[6-7]。然而在市场上却出现了许多假冬虫夏草及其伪劣替代品。据相关报道,冬虫夏草中最重要的活性成分是核苷类物质及其碱基,它们已被广泛用作冬虫夏草及其替代品的质控指标[8-9]。因此,建立一种用于同时测定冬虫夏草和蛹虫草中核苷类成分的检测方法是极其重要的。
目前,冬虫夏草中核苷类物质的测定方法有液相色谱-质谱联用(LC-MS)、毛细管电泳(CE)、离子对反相分配色谱(IP-RPC)、毛细管电色谱(CEC)和高效液相色谱法(HPLC)[2,4-5,7-8,10-16]。样品前处理方法有溶剂萃取法、回流提取法、超声辅助提取法、微波辅助提取法、高压液相提取、超临界流体萃取和固相萃取等方法[12,14]。该类方法虽然可获得较高的提取率,但却耗时、费力,并且需要大量的样品和溶剂。基质固相分散法(Matrix solid-phase dispersion,MSPD)是由美国Barker教授等首次提出的一种类似于固相提取的样品预处理方法[17],此法高效、快速、操作简便,且集提取、净化、分离于一身,现已被广泛应用于动物、蔬菜、水果等食品中药物残留和植物中化学成分的提取等方面[18-21]。因此,本研究首次将基质固相分散提取技术与高效液相色谱法相结合用于冬虫夏草及其替代品中的核苷类物质的测定,并对影响基质固相分散的提取条件进行了优化。
1 材料与方法
1.1 材料与仪器
野生冬虫夏草(样品1) 购于吉林大药房;液体深层发酵培养的蛹虫草菌丝体(样品2) 由实验室自制;人工培养的蛹虫草子实体(样品3) 购于长白山特产有限公司,分别将上述三种样品在60℃的烘箱中干燥后粉碎,过40目筛,备用;标准品腺嘌呤、腺苷、胸腺嘧啶、胸苷、尿嘧啶、尿苷、胞嘧啶、鸟苷和虫草素 美国Sigma公司,纯度均大于99%;色谱级甲醇 美国Fisher公司;其余试剂 均为分析级,购买于北京化工厂;超纯水 由Milli-Q水纯化系统(美国Millipore公司)制得;硅胶、活性炭、硅藻土、弗罗里硅土、酸性氧化铝、中性氧化铝和碱性氧化铝 购于中国药品生物制品检定所。
LC-20AB高效液相色谱仪、SPD-20A紫外检测器 日本岛津;PinnacleⅡC18色谱柱 5μm,4.6mm× 250mm,美国瑞斯泰克;KQ-100DE超声波清洗器 江苏昆山市超声仪器有限公司;RE-52C旋转蒸发仪 上海亚荣。
1.2 贮备液的制备
将腺嘌呤、腺苷、胸腺嘧啶、胸苷、尿嘧啶、尿苷、胞嘧啶、鸟苷和虫草素分别溶解在含90%甲醇的水溶液中,获得500μg·mL-1的标准储备液,工作溶液是由标准储备液经甲醇稀释得到的。
1.3 基质固相分散提取[17-21]
准确称取0.050g样品,并按比例再准确称取一定质量分散剂于玛瑙研钵中,混合均匀后研磨5min,然后将混合物转移到底部有一层脱脂棉的自制玻璃柱中,并在混合物的顶部放一层脱脂棉,用玻璃棒压实。先用15mL淋洗剂淋洗样品混合物,弃去淋洗液,再用15mL洗脱剂洗脱,收集洗脱液于25mL蒸馏烧瓶中,在40℃下旋蒸至干,用500μL甲醇回溶,溶解液过0.22μm滤膜,进行HPLC分析。
1.4 色谱条件
流动相:0.1%乙酸水溶液(A)-甲醇(B)。梯度洗脱条件为:0~8min,5%B;8~13min,5%~10%B;13~13.5min,10%~15%B;13.5~17.5min,15%~18%B;17.5~23min,18%~24%B;23~34min,24%B;34~39min,5%B。流速:0.5mL·min-1;进样量:5μL;柱温:25℃。紫外检测波长:254nm。
1.5 提取率的计算
式中,C:样品提取液中目标化合物的浓度,μg· mL-1;V:样品提取液的体积,mL;m:样品质量,g。
1.6 基质固相分散提取条件的确定
为了获得最佳的提取率,本文考察了影响基质固相分散的提取条件,即分散剂的种类、分散剂与样品质量比、淋洗剂种类及体积、洗脱剂种类及体积。所有实验平行操作三次。
1.6.1 分散剂的种类和样品与分散剂的质量比 为了找到最合适的分散剂,本实验考察了硅胶、弗罗里硅土、酸性氧化铝、中性氧化铝和碱性氧化铝样品提取率的影响。并分析了弗罗里硅土和样品的质量比(1∶1、2∶1、4∶1、6∶1、8∶1)对提取率的影响。
1.6.2 淋洗剂的种类和体积 研究了正己烷、石油醚、二氯甲烷、氯仿和乙酸乙酯作为淋洗剂对目标化合物的淋洗效果。并考察了当样品用量为0.050g,分散剂质量为0.20g时,淋洗剂体积(5、10、15、20、25mL)对目标化合物提取率的影响。
1.6.3 洗脱剂的种类和体积 本实验考察了甲醇、乙腈、乙醇和丙酮4种洗脱剂对核苷类化合物的洗脱能力,并考察了洗脱剂的体积(5、10、15、20、25mL)对目标化合物提取率的影响。
1.6.4 净化剂的影响 为了进一步去除洗脱液中的少量杂质,在MSPD提取过程中,将0.2g不同种类的净化剂(活性炭、氧化铝、硅藻土和硅胶)分别装入MSPD玻璃柱底部,以研究净化剂对洗脱液的净化效果。
2 结果与讨论
2.1 标准品色谱图
标准品色谱图如图1所示。尿嘧啶,尿苷,胸苷,胞苷,腺嘌呤,鸟苷,胸腺嘧啶,腺苷和虫草素与其相邻色谱峰的分离度均大于1.5,拖尾因子在1.10~1.20,理论塔板数以各色谱峰计均在5000以上。

图1 标准品色谱图Fig.1 Chromatograms of the standard solution
2.2 基质固相分散提取条件的确定
2.2.1 分散剂的种类和样品与分散剂的质量比 分散剂的种类是MSPD提取中一个重要的参数。在MSPD过程中,分散剂不仅作为吸附分离材料,而且还是分散样品的载体。实验结果如图2所示,当使用3种氧化铝作为分散剂时,目标化合物的提取率均低于其他分散剂;使用弗罗里硅土和硅胶作为分散剂时,目标化合物的提取率最高。然而,弗罗里硅土比硅胶更容易研磨和转移。因此,本实验选择弗罗里硅土为分散剂。
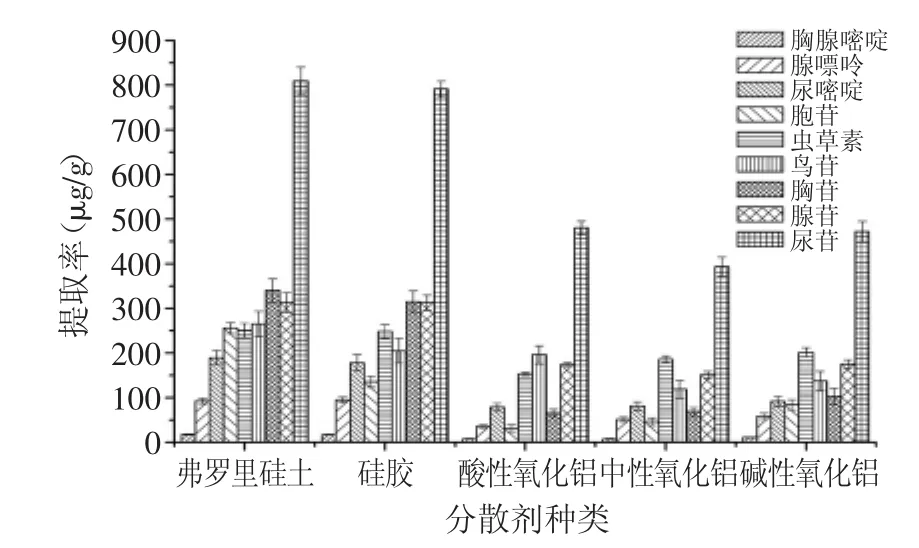
图2 分散剂种类对提取率的影响Fig.2 Effect of the type of dispersant on the extraction yields
从图3可以看出,质量比对化合物提取率的影响并不明显,考虑到当质量比为4∶1时,化合物的提取率比其他比例时稍高。因此,本实验选择弗罗里硅土与样品质量比为4∶1。
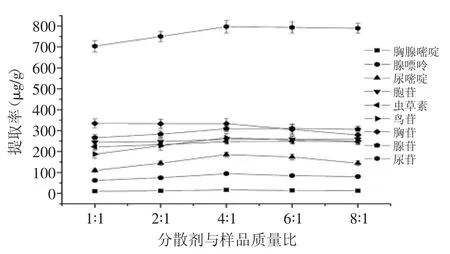
图3 分散剂与样品质量比对提取率的影响Fig.3 Effect of the ratio of dispersant to sample on the extraction yields
2.2.2 淋洗剂的种类和体积 为了去除样品中的油脂和少量杂质,在样品洗脱之前要先用非极性溶剂淋洗MSPD柱。淋洗剂的使用不仅能获得干净的、无干扰的色谱图,还能在旋蒸过程中获得完全干燥的提取物,从而减少目标化合物的损失。实验结果表明,以石油醚作为淋洗剂时,目标化合物可获得更高的提取率,结果见图4。
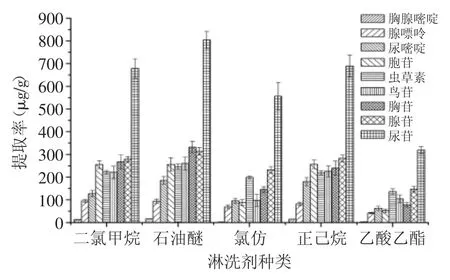
图4 淋洗剂种类对提取率的影响Fig.4 Effect of the type of washing solvent on the extraction yields
实验结果如图5所示,当石油醚的体积从5mL增加到15mL时,腺苷、尿嘧啶、尿苷、胞苷、胸苷和虫草素的提取率略有增加,当体积从15mL增加到25mL时,提取率基本不变。然而,随着石油醚体积的不断增加,腺嘌呤和胸腺嘧啶的提取率基本没有变化。因此,本实验选择石油醚用量为15mL。
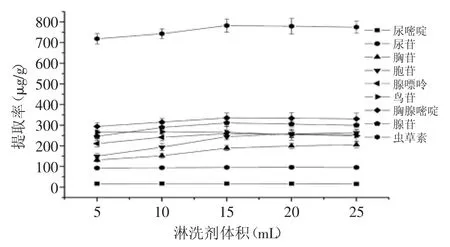
图5 淋洗剂体积对提取率的影响Fig.5 Effect of volume of washing solvent on the extraction yields
2.2.3 洗脱剂的种类和体积 由于核苷类物质为极性物质,易溶于极性有机溶剂,而难溶于非极性溶剂。实验结果表明,洗脱溶剂的选择对目标化合物的萃取效果有很大影响,且强极性的甲醇对目标化合物的洗脱能力明显优于乙腈、乙醇和丙酮,9种目标化合物的回收率均较高。因此,本实验选择甲醇作为基质固相分散的洗脱剂。洗脱剂的体积对目标化合物提取率的影响结果见图6,当洗脱剂体积从5mL增加到15mL时,核苷和碱基的提取率稍有增加,而当洗脱剂的体积从15mL增加到25mL时,化合物提取率趋于平稳。所以,选择甲醇体积为15mL。

图6 洗脱剂体积对提取率的影响Fig.6 Effect of volume of elution solvent on the extraction yields
2.2.4 净化剂的影响 实验结果表明,当使用氧化铝作为净化剂时,虽然色谱图较干净,干扰峰较少,但化合物回收率也随之降低;当使用其他净化剂时,所获得的色谱图与无净化剂时相比并没有明显的区别。所以,本实验未使用净化剂。
2.3 方法验证
2.3.1 线性关系 配制含有9种目标化合物的混合标准品储备液,并稀释到合适的浓度,在最佳色谱条件下,检测不同浓度化合物的峰面积,然后用峰面积(A)对分析物浓度(C)作图,绘制标准曲线,得到线性回归方程。各化合物在0.11~385.00μg·mL-1范围内有很好的线性关系,相关系数r>0.9997。详细结果见表1。
2.3.2 检出限和定量限 检出限(LOD)和定量限(LOQ)是信噪比(S/N)分别为3和10时实验方法所能检出和定量的目标化合物的最低浓度。9种核苷和碱基的检出限和定量限见表1。
2.3.3 适用性和精密度 为了评价该法的适用性和精密度,本实验分析3种不同种类的虫草样品(即野生冬虫夏草、深层发酵培养蛹虫草菌丝体和人工固体培养蛹虫草子实体)中的9种核苷和碱基。实验结果表明(见表2),样品中尿嘧啶、尿苷、胸腺嘧啶、胞苷、腺嘌呤、鸟苷、胸苷、腺苷和虫草素的含量分别是40.52~179.95、261.73~548.61、8.75~82.63、18.61~956.70、42.11~134.79、81.76~241.03、12.06~33.93、241.99~267.85、0~3419.78μg·g-1。从表2可以看出,尿苷、鸟苷和腺苷是野生冬虫夏草、人工培养蛹虫草菌丝体和子实体中的主要化合物,这与先前的报道是一致的[1,6,8]。而且,人工培养的蛹虫草子实体和菌丝体中的核苷及碱基含量并不相同,这可能与培养基组成、培养方式、生长条件和采摘时期等因素有关。另外,与蛹虫草子实体和菌丝体相比,野生冬虫夏草中的胸腺嘧啶、胞苷和虫草素含量较低,尤其是虫草素,富含于人工培养的蛹虫草子实体中,而在野生冬虫夏草中很少能检测到。3种样品提取物的色谱图见图7。
精密度采用相对标准偏差(RSD)来表示。日内精密度是一天内连续分析六次样品得到的,日间精密度是每天分析两次,连续分析三天得到的。日内和日间精密度RSD列于表2中。结果表明,核苷和碱基的日内和日间精密度RSD分别是1.19%~5.07%和2.12%~7.28%。
2.3.4 回收率 为了分析该法的准确度,本实验研究了加标样品的回收率。加标样品是向样品中添加混合标准品溶液得到的。为了保证标准溶液能均匀的分散于样品中,加标时需加入适量甲醇,直到样品粉末被甲醇完全浸没为止,小心混匀后于室温下自然干燥24h。将混合物按本法进行提取和分析。9种化合物的回收率列于表3中,其相对标准偏差均低于6.56%。
3 结论
本研究将基质固相分散提取法与高效液相色谱检测技术相结合,建立一种用于冬虫夏草及其替代品中核苷和碱基的分析方法。本法简单快速,样品用量少,各化合物的检出限和定量限分别为12.4~79.4ng·mL-1和41.2~264.6ng·mL-1,加标样品回收率在81.54%~95.77%之间。本法测定结果令人满意,可被广泛应用于中草药和生物药品中核苷和碱基的同时测定。
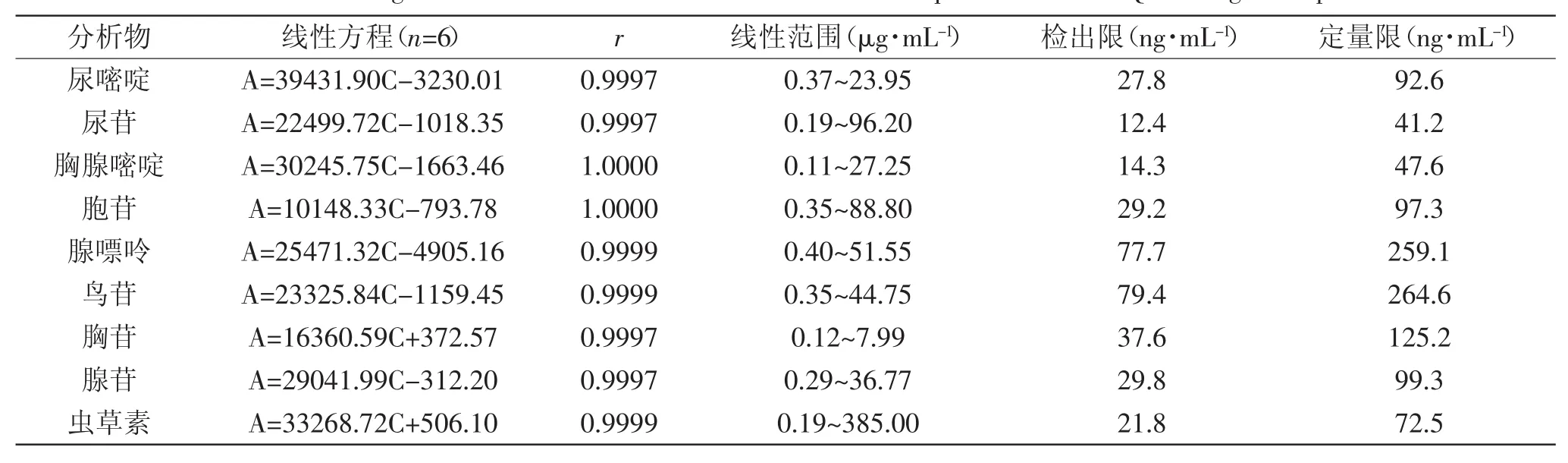
表1 各目标化合物的线性方程,相关系数,检出限和定量限Table.1 Linear regression data,limit of detection(LOD),limit of quantification(LOQ)of target compounds
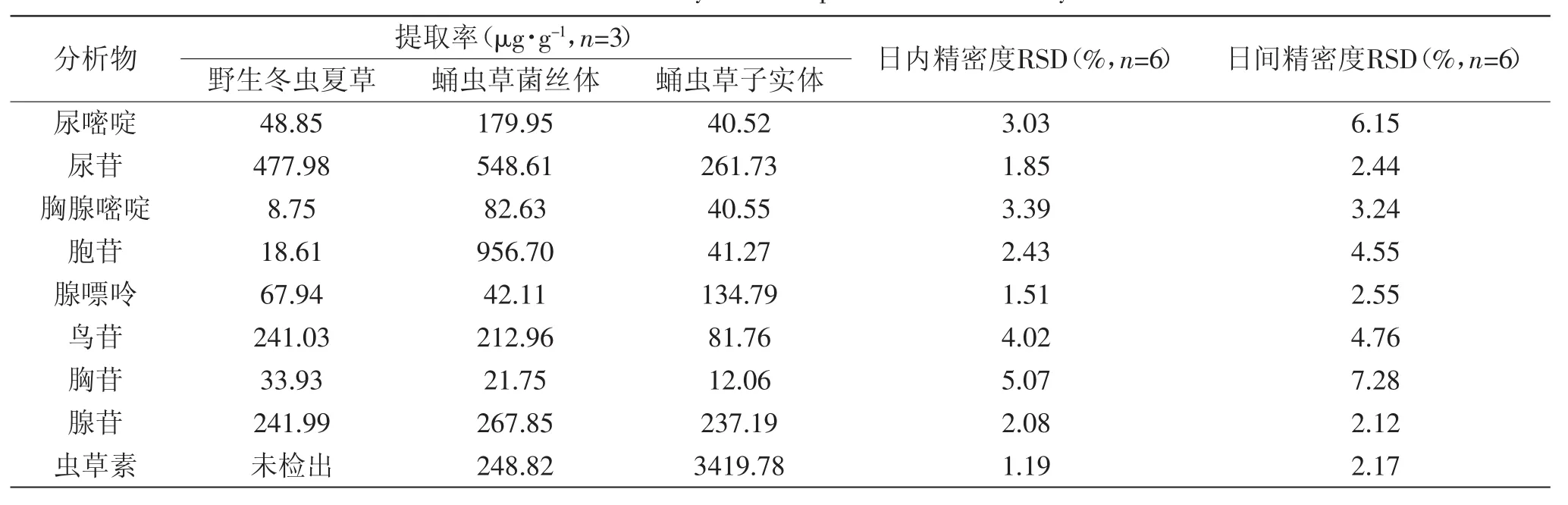
表2 化合物的提取率和精密度Table.2 Extraction yields and precision for the analytes
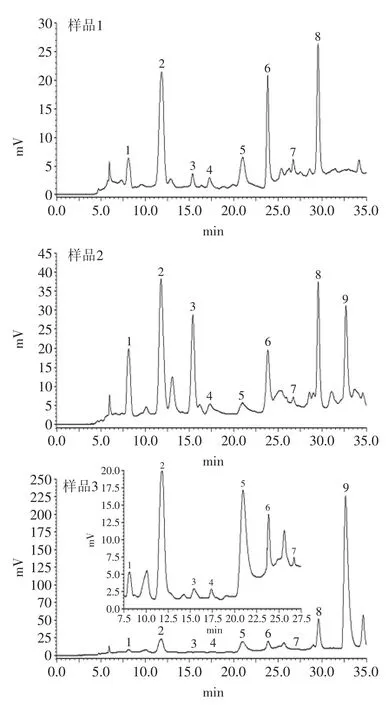
图7 样品提取物的色谱图Fig.7 Chromatograms of the extracts

表3 化合物的回收率Table.3 Recoveries of the analytes
[1]王征,刘建利.冬虫夏草化学成分研究进展[J].中草药,2009,40(7):1157-1160.
[2]张虹,吴雪美.高效液相色谱-质谱联用法分析冬虫夏草及其功能食品中的活性成分[J].中国食品学报,2007,7(5):113-120.
[3]Das S K,Masuda M,Sakurai A,et al.Medicinal uses of the mushroom Cordyceps militaris:Current state and prospects[J]. Fitoterapia,2010,81(8):961-968.
[4]Yang F Q,Guan J,Li S P.Fast simultaneous determination of 14 nucleosides and nucleobases in cultured Cordyceps using ultra-performance liquid chromatography[J].Talanta,2007,73(2):269-273.
[5]Xie J W,Huang L F,Hu W,et al.Analysis of the Main Nucleosides in Cordyceps Sinensis by LC/ESI-MS[J].Molecules,2010(15):305-314.
[6]杨昕,斯陆勤,涂秩平,等.不同产地人工蛹虫草子实体及冬虫夏草中核苷类成分的比较[J].医药导报,2009,28(10):1354-1356.
[7]黄兰芳,郭方遒,梁逸曾,等.HPLC-ESI-MS测定冬虫夏草和蚕蛹虫草中腺苷和虫草素含量[J].中国中药杂志,2004,29(8):762-764.
[8]梁洪卉,程舟,杨晓伶,等.HPLC定量分析冬虫夏草的主要核苷类有效成分[J].中药材,2008,31(1):58-60.
[9]范志华,汤卫华,林霖.HPLC法测定冬虫夏草发酵菌丝粉中腺苷的含量[J].现代食品科技,2007,23(7):94-97.
[10]于荣敏,叶斌,宋丽艳.人工培养蛹虫草高效液相色谱指纹图谱的初步研究[J].中草药,2007,38(9):1403-1405.
[11]张博,杨黎彬,李金娟.高效液相色谱法测定虫草菌粉中腺苷的含量[J].光谱实验室,2011,28(2):899-901.
[12]Li S P,Li P,Lai C M,et al.Simultaneous determination of ergosterol,nucleosides and their bases from natural and cultured Cordyceps by pressurised liquid extraction and high-performance liquid chromatography[J].J Chromatogr A,2004,1036(2):239-243.
[13]Guo F Q,Li A,Huang L F,et al.Identification and determination of nucleosides in Cordyceps sinensis and its substitutes by high performance liquid chromatography with mass spectrometric detection[J].J Pharm Biomed Anal,2006,40(3):623-630.
[14]Fan H,Li S P,Xiang J J,et al.Qualitative and quantitative determination of nucleosides,bases and their analogues in natural and cultured Cordyceps by pressurized liquid extraction and high performance liquid chromatography-electrospray ionization tandem mass spectrometry(HPLC-ESI-MS/MS)[J].Anal Chim Acta,2006,567(2):218-228.
[15]Huang L F,Liang Y Z,Guo F Q,et al.Simultaneous separation and determination of active components in Cordyceps sinensis and Cordyceps militarris by LC/ESI-MS[J].J Pharm Biomed Anal,2003,33(5):1155-1162.
[16]Yang F Q,Ge L,Yong J H,et al.Determination of nucleosides and nucleobases in different species of Cordyceps by capillary electrophoresis-mass spectrometry[J].J Pharm Biomed Anal,2009,50(3):307-314.
[17]Barker S A.Applications of matrix solid-phase dispersion in food analysis[J].J Chromatogr A,2000,880(1-2):63-68.
[18]王重洋,王远鹏,王宁,等.基质固相分散-超快速液相色谱法测定牛肉中磺胺类兽药[J].分析化学,2013,41(1):83-87.
[19]胡秋芬,郭红,周元清,等.基质固相分散-高效液相色谱法测定虫草中甘露醇[J].理化检验-化学分册,2008,44(10):940-944.
[20]Enríquez-Gabeiras L,Gallego A,Garcinuño R M,et al. Interference-free determination of illegal dyes in sauces and condiments by matrix solid phase dispersion(MSPD)and liquid chromatography(HPLC-DAD)[J].Food Chem,2012,135(1):193-198.
[21]Shi X L,Jin Y R,Liu J B,et al.Matrix solid phase dispersion extraction of ginsenosides in the leaves of Panax ginseng[J].Food Chem,2011,129(3):1253-1257.
Simultaneous determination of nine nucleosides and nucleobases in Cordyceps sinensis and Cordyceps militarris by matrix solid-phase dispersion coupled with high performance liquid chromatography
WANG Zhi-bing,ZHANG Hong-Yu,LIU Yang,FANG Zhi-yong,CHEN Si-rong,LI Shuo
(College of Chemistry and Life Science,Changchun University of Technology,Changchun 130012,China)
Objective:To develop a matrix solid-phase dispersion(MSPD)-high performance liquid chromatography(HPLC)for simultaneous determination of uracil,adenine,thymine,uridine,adenosine,thymidine,cytidine,guanosine and cordycepin in natural Cordyceps sinensis,cultured Cordyceps militarris mycelia and Cordyceps militarris fruiting bodies.Methods:Nine nucleosides and nucleobases were extracted by MSPD and determined by HPLC.Results:The experimental conditions for the MSPD were optimized.Florisil was used as dispersant,petroleum ether as washing solvent and methanol as elution solvent.The ratio of Florisil to sample was selected to be 4∶1.The calibration curve had good linear relationship(r>0.9997).The limits of detection and quantification were in the range of 12.4~79.4ng·mL-1and 41.2~264.6ng·mL-1,respectively.Intra-and interday precision were lower than 7.28%.The recoveries were between 81.54%and 95.77%.Conclusion:The present method was simple,and consumed less sample.The present MSPD-HPLC method should be applied for simultaneous extraction of nucleosides and nucleobases in herbal materials,pharmaceutical products and biological drugs.
matrix solid-phase dispersion extraction(MSPD);nucleoside compounds;Cordyceps sinensis;Cordycepsmilitarris fruitingbodies;Cordycepsmilitarris mycelia;high-performanceliquidchromatography(HPLC)
TS207.3
A
1002-0306(2014)04-0083-06
2013-05-21
王志兵(1982-),男,博士,讲师,研究方向:中药与食品分析。
吉林省医药产业发展专项资金(YYZX201130-2)。
