动物组织中赛庚啶竞争酶联免疫法的建立
2014-02-24万宇平罗晓琴郝小妹崔廷婷黄宝兵朱亮亮
万宇平,罗晓琴,郝小妹,崔廷婷,黄宝兵,朱亮亮
(1.北京勤邦生物技术有限公司,北京102206;2.大同市农产品质量安全检验检测中心,山西大同037004)
动物组织中赛庚啶竞争酶联免疫法的建立
万宇平1,罗晓琴1,郝小妹1,崔廷婷1,黄宝兵2,朱亮亮1
(1.北京勤邦生物技术有限公司,北京102206;2.大同市农产品质量安全检验检测中心,山西大同037004)
建立快速检测动物组织中赛庚啶的竞争酶联免疫法。制备赛庚啶人工抗原作为包被原,使用辣根过氧化物酶标记的单克隆抗体,构建快速检测动物组织中赛庚啶的竞争酶联免疫法。结果表明,Logit/Log拟合标准曲线方程为Y=-2.051 8X-1.353 4,相关系数R为0.995 7,半数抑制浓度(IC50)为0.23 μg/L,动物组织样本的检测限为0.3 μg/kg,赛庚啶阳性样本的加标回收率为85.1%~114.5%,样本重复检测结果的变异系数为5.2%~9.6%。建立的竞争酶联免疫吸附方法具有较好的特异性、回收率和重复稳定性,可用于动物组织中赛庚啶残留的检测。
动物组织;赛庚啶;竞争酶联免疫
赛庚啶(cyproheptadine)是一种抗组胺药,具有抗胆碱能和镇静作用,可用于治疗各种过敏性疾病,也可用于改善患者食欲[1-3]。近几年在国内某些饲料产品中发现添加[4],可能是为了通过刺激食欲来提高动物生长速度以达到增加体质量的目的。但食用含有赛庚啶残留的动物源性产品会对人体造成不利影响,对儿童的作用更为明显,高浓度可直接引发昏迷、呼吸急促、全身无力等中毒症状,严重者则直接导致死亡[4-5]。因此,我国农业部第1519号公告将赛庚啶列入《禁止在饲料和动物饮水中使用的物质》清单。目前已有关于饲料、尿样及药剂中赛庚啶检测方法的报道,主要采用液相色谱-串联质谱法[6-12]。但该方法不适合现场大批量样本的快速检测。因此,有必要建立动物源性食品及其相关产品中赛庚啶残留的测定方法。本研究结合实际工作需要,建立了竞争酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)快速测定动物组织中的赛庚啶,该方法较为灵敏、操作步骤简单,检测时间短,非常适合中小企业、基层检测机构现场大量样本的检测。
1 材料与方法
1.1 材料与试剂
猪肉、牛肉、猪肝等样本:超市;赛庚啶标准品(纯度≥99%)、去甲基赛庚啶(纯度≥99%)、二甲基亚砜(dimethyl sulfoxide,DMSO)(优级纯)、N,N-二甲基甲酰胺(dimethyl formamide,DMF)(纯度≥99%)、碳化二亚胺(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC)(纯度≥99%)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)(纯度≥99%)、卵清蛋白(ovalbumin,OVA):美国Sigma公司;醛基活化的辣根过氧化物酶:美国Thermo公司;其余试剂为国产分析纯;赛庚啶单克隆抗体杂交瘤细胞株为北京勤邦生物技术有限公司制备保存。
1.2 仪器与设备
MK3酶标仪:美国Thermo公司;DSY-Ⅲ氮吹仪:北京金科精华苑科技有限公司;SH-400A均质器:上海禾工科学仪器有限公司;AUY220精密电子天平:日本岛津公司;THZ-103B振荡器:上海一恒科学仪器有限公司;LD-3离心机:江苏同君仪器科技有限公司。
1.3 方法
1.3.1 赛庚啶半抗原合成
称取0.55 g去甲基赛庚啶和1 mL吡啶溶于10 mL DMSO中,制成A液;称取0.39 g溴乙酸叔丁酯溶于5 mL DMSO后于40℃条件下缓慢滴入A液中,滴加完毕后继续反应4 h,蒸除溶剂;简单柱层析分离后,除去溶剂,加入20 mL DMSO和5 mL甲酸,室温条件下反应20 h,蒸除溶剂,乙醇-水体系中重结晶得到羧基赛庚啶,即为目标半抗原。
1.3.2 赛庚啶全抗原合成
全抗原合成采用活泼酯法,将半抗原与卵清蛋白(OVA)偶联合成包被抗原,具体操作过程:取20 mg赛庚啶半抗原溶于1 mL DMF中,取30 mg EDC和NHS用0.2 mL去离子水充分溶解后加入半抗原溶液中,室温条件下搅拌反应24 h,得到B液;取50 mg OVA充分溶解于3.8 mL柠檬酸盐缓冲液(citrate buffer,CB)(pH 9.6)中,将B液逐滴缓慢加入蛋白溶液中,并于室温条件下搅拌反应24 h;将终反应液在4℃0.01 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)(pH 7.4)中透析72 h,每隔8 h换液1次。最后将无色溶液封装后于-20℃冰箱保存。
1.3.3 酶标抗体的制备
使用辣根过氧化物酶标记抗体,制备方法参考张世伟等[13]的研究。将0.3 mg纯化的抗体溶解于0.1 mol/L pH 9.5的碳酸盐缓冲液中。加入0.1 mL 10 mg/mL的活化醛基的辣根过氧化物酶溶液后4℃反应过夜。加入30 μL 0.2 mol/L的赖氨酸终止反应,透析纯化后备用。
1.3.4 竞争ELISA方法的建立
每孔加100 μL包被抗原,37℃温育2 h;倾去包被液,经磷酸盐吐温缓冲液洗涤1次,每孔加入200 μL封闭液,37℃温育2 h,倒掉封闭液;每孔加入50 μL系列浓度的赛庚啶标准溶液(或样品溶液)和50 μL酶标单克隆抗体,25℃避光反应40 min;洗涤4~5次后加入底物液A液(过氧化脲)和B液(四甲基联苯胺)各50 μL/孔,25℃显色15 min,2 mol/L H2SO4溶液终止反应后,设定酶标仪于波长450 nm处测定每孔吸光度值(OD450nm值)。
1.3.5 标准曲线的绘制
采用竞争ELISA方法建立标准曲线,分别选择赛庚啶标准品质量浓度0、0.05 μg/L、0.15 μg/L、0.45 μg/L、1.35 μg/L、4.05 μg/L,以质量浓度为0 μg/L时的OD值为B0值,相应赛庚啶浓度的OD值为B值,以评定模型Logit(B/B0)为纵坐标,以赛庚啶标准品质量浓度(μg/L)的对数为横坐标,绘制标准曲线图。将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的质量浓度,乘以其对应的稀释倍数即为样本中喹诺酮类药物的实际质量浓度。
1.3.6 样本前处理方法的建立
用均质器均质样本;称取(2.0±0.05)g均质后的样本至50 mL聚苯乙烯离心管中;加入0.3 mL 2 mol/L硫酸溶液和3.7 mL乙腈,用振荡器振荡5 min混匀,室温条件下4 000 r/min离心5 min;移取2 mL上层有机相至50 mL聚苯乙烯离心管中,加入0.2 mL 2 mol/L氢氧化钠溶液,轻轻振荡20 s,再加入2 mL三氯甲烷和4 mL正己烷,用振荡器振荡5 min混匀,室温条件下4 000 r/min离心5 min;移取2 mL上层有机相至10 mL干净玻璃试管中,于50~60℃水浴氮气流下吹干;加入1 mL复溶液,用涡旋仪涡动30 s,待检。
1.3.7 ELISA方法的评价
敏感性:用半数抑制浓度(50%inhibiting concentration,IC50)和检测限来评价方法的灵敏度。测定20次标准曲线的IC50,统计其平均值和浮动范围;测定20个空白样本,求出其B/B0在标准曲线上对应的质量浓度的平均值(Xˉ)和标准差(S),方法检测限(method detection limit,MDL)=Xˉ+3S。
准确性和重复性:用回收率和变异系数分别来评价ELISA方法的准确性和重复性。以三个不同质量浓度的赛庚啶标准品分别对空白猪肉、牛肉、猪肝样本进行添加回收率实验,计算回收率和变异系数(coefficient of variation,CV)。
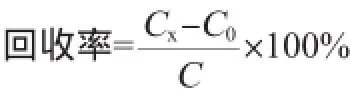
式中:Cx为添加了一定赛庚啶浓度的样本经过标准曲线分析得到的实际质量浓度,μg/kg;C0为空白样本经过标准曲线分析得到的实际质量浓度,μg/kg;C为实际添加的赛庚啶质量浓度,μg/kg。
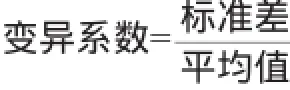
稳定性:将ELISA方法涉及到的各种试剂制备足量保存于37℃环境中,每隔1 d取出适量,分别测定0 μg/kg标准品的OD450nm值、IC50及按上述方法进行添加回收实验所得的回收率,直到方法的灵敏度和回收率开始下降为止,根据实验结果判断相关试剂的稳定性。
2 结果与分析
2.1 标准曲线的确定
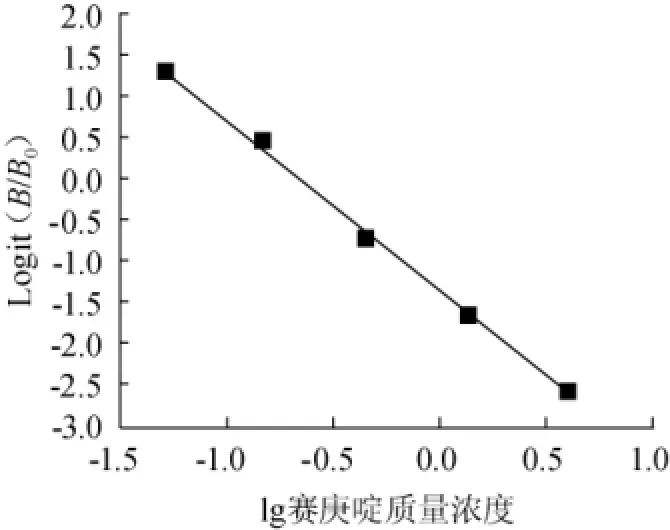
图1 赛庚啶的检测标准曲线Fig.1 Standard curve for cyproheptadine detection
在0.05~4.05 μg/L质量浓度范围内,Logit(B/B0)与赛庚啶质量浓度对数呈现良好的线性关系(见图1),建立拟合回归直线方程为Y=-2.051 8X-1.353 4,相关系数r为0.995 7,半数抑制浓度(IC50)为0.23 μg/L。
2.2 敏感性测定
统计20次标准曲线的IC50平均值为0.22 μg/kg,浮动范围为0.20~0.25 μg/kg;20个空白样本的B/B0在标准曲线上对应的质量浓度的平均值()和标准差(S)见表1,综合考虑几种样本的检测限数据,本方法对动物组织样本的检测限确定为0.3 μg/kg。
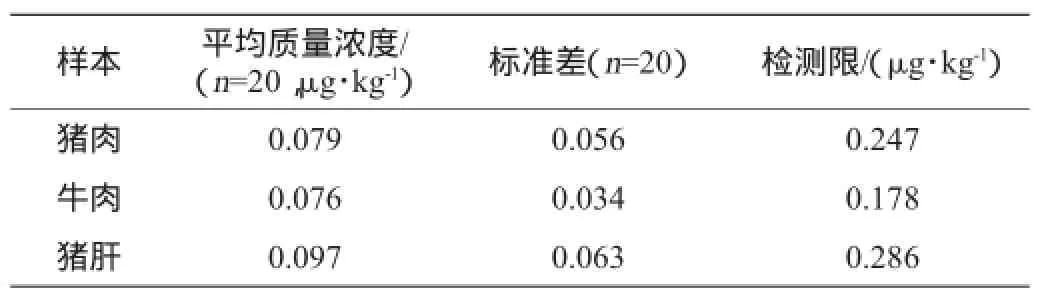
表1 方法对动物组织的检测限Table 1 Limit of detection for animal tissue
2.3 准确性和重复性测定
取空白猪肉、牛肉、猪肝样本,按表2所述的赛庚啶质量浓度添加对其进行加标回收率实验,每个质量浓度做5个平行,计算加标回收率和变异系数,结果见表2。

表2 方法的准确性和重复性测定Table 2 Accuracy and repeatability of ELISA method
由表2可知,以三个不同质量浓度的赛庚啶标准品对空白猪肉、牛肉、猪肝样本进行添加,其加标回收率为85.1%~114.5%,样本重复检测结果的变异系数为5.2%~9.6%,<10%,说明该ELISA方法测定动物组织中赛庚啶残留具有良好的准确性和重复性,可用于动物组织中赛庚啶残留测定。
2.4 稳定性测定
经测定,涉及到的各种试剂能在37℃条件下稳定保存9 d,第10天开始各项参数出现下降。根据生化试剂在37℃每稳定1 d,可相当于4~10℃保存一个半月[14],可知,若将这些试剂组装成商品化试剂盒,可在4℃条件下至少稳定保存12个月。
3 结论
本研究以实验室自制的单克隆抗体为基础,初步建立了动物组织中赛庚啶残留检测的竞争酶联免疫法。该方法的IC50浮动范围为0.20~0.25 μg/L,对组织样本的检测限为0.3 μg/kg;赛庚啶阳性样本加标回收率为85.1%~114.5%,样本重复检测结果的变异系数为5.2%~9.6%,具有良好的准确性和重复性,可用于动物组织中赛庚啶残留测定。赛庚啶竞争酶联免疫方法的建立,为进一步开发免疫检测试剂盒奠定了基础[15],并为食品和饲料中赛庚啶残留的监控提供了便捷、灵敏的检测方法。
[1]吴剑平,张鑫,顾欣,等.分散液相微萃取/超高效液相色谱-串联质谱法检测猪尿中盐酸赛庚啶残留量的研究[J].分析测试学报,2013,32(7):834-839.
[2]KONSTANDI M,DELLIA-SFIKAKI A,VARONOS D.Effect of cyproheptadine hydrochloride on ingestive behaviors[J].Pharmacol Res,1996, 33(1):35-40.
[3]IWAKI M,OGISO T,FUJII Y.Pharmacokinetics of cyproheptadine and its metabolites in rats[J].Biol Pharm Bull,1994,16(12):1276-1281.
[4]李志业,张军.高效毛细管电泳法测定盐酸赛庚啶的含量[J].郑州大学学报:医学版,2009(4):849-850.
[5]曹莹,蒋音,张文刚.高效液相色谱法分析饲料中的赛庚啶[J].中国饲料,2011(2):39-40.
[6]陈其煌.高效液相色谱-串联质谱法测定猪肝中可乐定和赛庚啶[J].浙江农业学报,2013(3):623-629.
[7]FENTE C A,REGAL P,VAZQUEZ B,et al.Development and validation of an LC-MS/MS confirmatory method for residue analysis of cyproheptadine in urine of food-producing animals[J].J Agr Food Chem,2009, 57(6):2595-2598.
[8]陈其煌.高效液相色谱-串联质谱法测定猪尿液中盐酸可乐定和盐酸赛庚啶[J].福建农业学报,2012,27(6):596-600.
[9]曲斌,陆桂萍,蒋天梅,等.固相萃取-超高效液相色谱串联质谱法快速测定猪尿中的赛庚啶[J].中国兽药杂志,2013,47(1):28-31.
[10]吴红英.高效液相色谱法测定盐酸赛庚啶片中盐酸赛庚啶的含量[J].海峡药学,2011(10):52-54.
[11]李丹妮,张文刚,严凤,等.超高效液相色谱-串联质谱法检测饲料中盐酸可乐定和盐酸赛庚啶[J].中国兽药杂志,2011,45(10):20-24.
[12]XESÙS F,LEI Y,SEYED V H,et al.Development and validation of LC-MS/MS method for the determination of cyproheptadine in several pharmaceutical syrup formulations[J].J Pharmaceut Biomed,2009, 50(5):1044-1049.
[13]张世伟,赖心田,洪晓明,等.竞争酶联免疫法测定食品中鸡蛋过敏原[J].检验检疫学刊,2012,22(6):41-43.
[14]唐伟国.医学检验诊断试剂的制备与应用[M].上海:上海科学技术文献出版社,1996.
[15]潘熙萍,楼佳俊,张高精,等.草甘膦残留的酶联免疫分析方法的建立[J].湖北农业科学,2012,51(5):1002-1005.
Establishment of competitive enzyme linked immunosorbent assay for determination of cyproheptadine in animal tissue
WAN Yuping1,LUO Xiaoqin1,HAO Xiaomei1,CUI Tingting1,HUANG Baobing2,ZHU Liangliang1
(1.Beijing Kwinbon Biotechnology Co.,Ltd.,Beijing 102206,China; 2.Datong Examine and Inspection Centre for Agriculture Products Safety and Quality,Datong 037004,China)
A competitive enzyme linked immunosorbent assay(ELISA)for fast detection of cyproheptadine residues in animal tissue was developed. The one step competitive ELISA method was established using cyproheptadine complete antigen as coating antigen and radish peroxidase labeled monoclonal antibody for reaction antibody.Results showed that the Logit/Log calibration curve was Y=-2.051 8X-1.353 4(correlation coefficient R= 0.995 7),the half inhibitory concentration(IC50)was 0.23 μg/L,and the limitation of detection for animal tissue was 0.3 μg/kg.The added standard recovery for cyporheptadine residues in animal tissue was in the range of 85.1%-114.5%,and the coefficient of variation was from 5.2%to 9.6%.The developed ELISA method could be applied to quantitative detection for cyproheptadine residues in animal tissue.
animal tissue;cyproheptadine;ELISA
R392-33
A
0254-5071(2014)10-0130-03
10.11882/j.issn.0254-5071.2014.10.031
2014-07-16
快速检测技术及电动汽车相关产品和材料检测验证技术研究与示范(2012BAK26B04)
万宇平(1982-),男,兽医师,硕士,研究方向为食品安全快速检测技术。
