酒曲中羧甲基纤维素酶活力测定影响因素分析
2014-02-24赵爽纪凤娣赵章林宋昊郑玉芝艾金忠胡军
赵爽,纪凤娣,赵章林,宋昊,郑玉芝*,艾金忠,胡军
(1.北京一轻研究院,北京101111;2.北京红星股份有限公司,北京101400)
酒曲中羧甲基纤维素酶活力测定影响因素分析
赵爽1,纪凤娣1,赵章林1,宋昊1,郑玉芝1*,艾金忠2,胡军2
(1.北京一轻研究院,北京101111;2.北京红星股份有限公司,北京101400)
对还原糖法测定酒曲中羧甲基纤维素酶活力的影响因素进行了探讨,建立了适合酒曲中羧甲基纤维素酶活的测定方法。研究了酒曲中酶的提取方法(缓冲液与酒曲提取比例、酒曲中酶的溶出方式)、酶解反应条件(酶促反应pH、反应温度、酶液与底物添加量)及空白的选择。结果表明,最优条件为酒曲经-20℃冷冻过夜处理,用15倍质量的缓冲液振荡提取30 min,5 000 r/min离心5 min,上清为原始酶液。酶解反应条件为pH值4.8,样品为0.50 mL酶液和2.00 mL底物,空白为0.50 mL酶液和2.00 mL缓冲液,同时50℃反应30 min后添加3.0 mL DNS试剂,沸水浴显色10 min,冷却后空白补加2.00 mL底物,样品管补2.00 mL缓冲液,分别用水定容至25 mL,测定波长540 nm。
酒曲;羧甲基纤维素酶活力;提取;酶解条件;空白选择
固态白酒酒糟为白酒酿造过程中的主要副产物,我国每年白酒丢糟产量都>2 500万t[1]。酒糟含有一定的蛋白质、脂肪以及粗纤维等,说明固态白酒酒糟具有利用价值。依照循环经济及可持续发展思路,固态白酒酒糟的资源化利用具有现实意义。据统计,白酒丢糟的粗纤维含量为18%~24%,其中包括纤维素和木质素。纤维素分子结构特殊,难以被人类充分利用,造成巨大的资源浪费和严重的环境污染,如酒曲中的纤维素酶能将酒槽的纤维素水解为可发酵糖,将提高酒糟的再利用率,极有发展前景。
纤维素酶是一种多组分的复合酶,近年来在食品工业、饲料工业生产及环保等领域中都有较大的应用价值[2]。秦广利等[3]应用纤维素酶对酱香型白酒资源化利用进行了研究,在残糟中添加纤维素酶10 U/g,出酒率比原糟提高了2.61%。岳思君等[4]筛选了有良好分解效果的纤维素分解菌。但是不同来源的纤维素酶组成及各组分比例有较大差异,同时纤维素酶作用的底物也比较复杂,致使纤维素酶活力的测定方法很多,且方法复杂而不统一[5-10]。并且不同的测定条件,对酶活力的最终测定结果有一定影响。目前常用的测定方法有:羧甲基纤维素(还原糖法)酶活力测定方法、滤纸酶活力法和棉花糖化力法等。国内许多单位分别采用了以上各种方法并进行了种种修改,使测定的方法更加多样化,造成不同产品、不同结果之间无法相互比较的局面。目前,尚未见测定酒曲中纤维素酶活力方法的研究。因酒曲实际是多种酶的复合制剂,包括糖化酶、淀粉酶、纤维素酶等,因此纯的酶制剂的测定方法不适用于酒曲中纤维素酶的测定,羧甲基纤维素酶活力(car-boxymethylcellulose activity,CMCA)主要代表外切β-1,4葡聚糖苷酶和内切酶的活力总和,在研究和实际生产中应用比较普遍。因此,为了消除其他酶对测定结果的影响,选择适宜的酶活力测定条件,提高酒曲中纤维素酶活力测定结果的准确性,本研究参考我国轻工行业标准QB 2583—2003《纤维素酶制剂》[11]所采用的测定条件,对羧甲基纤维素酶(carboxymethyl cellulose,CMC)的提取(标准方法并没有此部分)及活力测定中的几个主要影响因素进行了深入研究,以期为酒曲纤维素酶活的测定摸索出适合的酶液提取及测定条件,达到在酒曲测定方法与活力表示上的统一,便于相互比较与交流。
1 材料与方法
1.1 材料与试剂
3,5-二硝基水杨酸(3,5-Dinitrosalicylic aeid,DNS)(化学纯)、氢氧化钠、酒石酸钾钠、苯酚、无水亚硫酸钠、乙酸、乙酸钠、葡萄糖均为分析纯:国药集团化学试剂有限公司;实验样品为某市售酒曲。
DNS试剂:称取3,5-二硝基水杨酸(10±0.1)g,置于约600 mL水中,逐渐加入氢氧化钠10 g,在50℃水浴中(磁力)搅拌溶解,再依次加入酒石酸钾钠200 g、苯酚2 g和无水亚硫酸钠5 g,待全部溶解并澄清后,冷却至室温,用水定容至1 000 mL,过滤。贮存于棕色试剂瓶中,于暗处放置7 d后使用。
pH 4.8乙酸缓冲溶液:称取三水乙酸钠8.16 g,溶于约750 mL水中,加入乙酸2.31 mL,用水定容至1 000 mL。调节溶液的pH至(4.8±0.05)备用。
底物为CMC-Na溶液:称取3.333 g CMC-Na,缓缓加入乙酸缓冲液约400 mL并加热至80~90℃,边加热边磁力搅拌,直至CMC-Na全部溶解,冷却后用相应的缓冲液稀释至500 mL,用2 mol/L盐酸或氢氧化钠调节溶液的pH为(4.8±0.05),贮存于冰箱中备用。
1.2 仪器与设备
UV-2802分光光度计:北京合众日盛科技有限公司;PHS-3C pH计:北京博翔兴旺科技有限公司;Omni-Ruptor 4000超声波破壁仪:Omni International;HF-2000R冷冻离心机:上海利鑫坚离心机有限公司;HZS-H水浴振荡器:北京东联哈尔仪器制造有限公司;HWS24电热恒温水浴锅:上海一恒北京英博瑞科技有限公司;BSA224S-CW分析天平、HZ85-2型磁力搅拌器:北京博翔兴旺科技有限公司。
1.3 方法
1.3.1 纤维素酶活力检测方法
检测方法参考我国轻工行业标准QB 2583—2003《纤维素酶制剂》。CMCA定义:1 g固体酶在(50±0.1)℃、指定pH条件下,1 h水解羧甲基纤维素钠底物,产生出相当于1 mg葡萄糖的还原糖量,为1个酶活力单位,U/g。羧甲基纤维素酶活力公式:
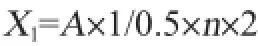
式中:X1为羧甲基纤维素酶活力,U/g;A为吸光度值在标准曲线上查得的还原糖量,mg;1/0.5为换算成酶液1 mL;n为酶样的稀释倍数;2为时间换算系数。
标准曲线的绘制:与QB 2583—2003不同,分别配制质量浓度为0.40 mg/mL、0.80 mg/mL、1.20 mg/mL、1.60 mg/mL、2.00 mg/mL、3.00 mg/mL的葡萄糖溶液,对应的葡萄糖量为0.20 mg、0.40 mg、0.60 mg、0.80 mg、1.00 mg、1.50 mg,以葡萄糖量(x)为横坐标,波长540 nm下测得的吸光度值(y)为纵坐标,绘制标准曲线。
1.3.2 测定条件优化
对空白样的选择、缓冲液与酒曲提取比例、酒曲中酶的溶出方式、酶促反应pH、反应温度、酶液与底物添加量6个因素进行考察(单因素试验的条件,是在其他条件固定的情况下进行的),以纤维素酶活力为考察指标,对酶活力进行单因素方差分析,比较各水平之间是否存在显著性差异。
(1)空白样的选择
样品管:样品0.5 mL,2.00 mL底物,50℃水浴30 min,3 mL DNS试剂。
空白1:2.00 mL底物,50℃水浴30 min,煮沸时加0.50 mL酶液(终止空白),反应结束时加3 mL DNS试剂;
空白2:2.00 mL底物+0.50 mL灭活酶液,其中酶液在沸水中煮15 min灭活,50℃水浴30 min,反应结束时加3 mL DNS试剂;
空白3:2.00 mL底物+0.50 mL酶液+3 mL DNS试剂,50℃水浴30 min;
空白4:0.50 mL酶液+2.00 mL缓冲液,不加底物,50℃水浴30 min,反应结束时加3 mL DNS试剂;
空白5:0.50 mL酶液,50℃水浴30 min,加3 mL DNS试剂,煮沸显色后补2.00 mL底物;
空白6:0.50 mL酶液+2.00 mL缓冲液,50℃水浴30 min,加3 mL DNS试剂,煮沸显色冷却后补2.00 mL底物;样品管补2.00 mL缓冲液。
(2)缓冲液与酒曲质量比
考察缓冲液与酒曲的质量比为5∶1、10∶1、15∶1、20∶1的提取效果。
(3)酒曲中酶的溶出方式
方式1:酒曲+缓冲液振荡提取;
方式2:研磨过的酒曲+缓冲液振荡提取;
方式3:液氮研磨过的酒曲+缓冲液振荡提取;
方式4:-20℃冷冻过夜的酒曲+缓冲振荡液提取;
方式5:酒曲+缓冲液混合后,-20℃冷冻过夜后振荡提取;
方式6:超声破壁提取。振荡提取条件为30℃、150 r/min水浴振荡30 min;超声条件为强度40%,脉冲50%,15 min。
(4)酶促反应pH
考察pH值分别为4.2、4.5、4.8、5.1、5.4时,纤维素酶活的变化。
(5)酶促反应温度
考察温度为30℃、40℃、50℃、60℃、70℃、80℃、90℃时纤维素酶活的变化。
(6)酶液与底物添加量
对0.50 mL+2.00 mL,1.00 mL+2.00 mL,2.00 mL+2.00 mL这三种情况的酶活进行了测定,前者为酶液量,后者为底物量。
2 结果与分析
2.1 标准曲线的绘制
以葡萄糖量(x)为横坐标,波长540 nm条件下测得的吸光度值(y)为纵坐标,绘制标准曲线,结果见图1。对标准曲线进行线性回归,得到回归方程:y=0.450 7x+0.002 1,相关系数R2为0.999 4,表明二者线性关系良好。
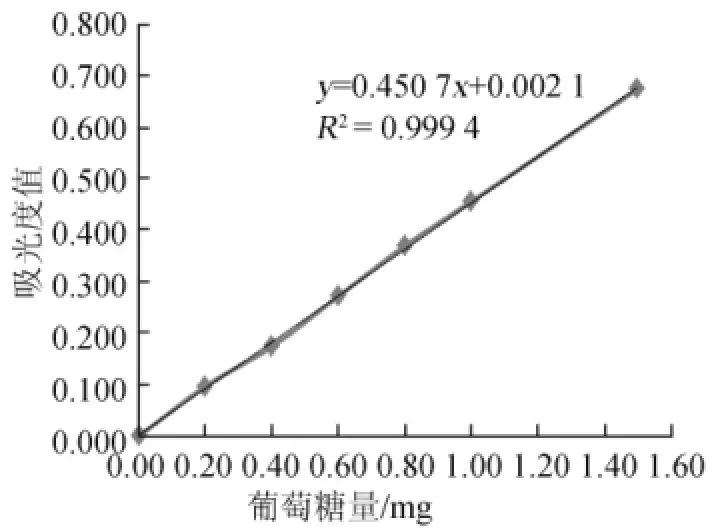
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 空白样的确定
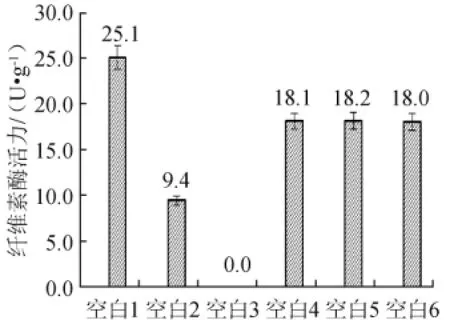
图2 不同空白对纤维素酶活力的影响Fig.2 Effect of different blank on CMCA
实验结果表明,以空白1所测酶活最高,但此空白没有考虑到酶液本身糖化酶、淀粉酶及还原糖的影响,所以使得测量结果偏高。以空白2所测酶活较低,由于酒曲酶液中含有淀粉,在灭活酶液的时候淀粉糊化,使酶液变得黏稠,比色管中有少量固体颗粒,影响吸光度值的测定。以空白3未检测出酶活力值,分析原因是因为DNS试剂并不能很好的终止酶反应,使得空白管与样品管同时在发生酶解反应。以空白4、5、6分别得出的酶活值比较接近,这样进行空白处理,既可扣除本底的还原糖影响,又可扣除糖化酶、淀粉酶等的影响;由于酶液中有少量的淀粉,使得糖化酶、淀粉酶作用于淀粉产生少量还原糖,测定的酶活结果低于空白1,这样得出的结果更合理。5号空白酶液未在缓冲液中进行反应,结果不如6号稳定,空白6对于测定酒曲中的纤维素酶活力设计的更科学,合理的消除了酶液本身的影响,并且空白管与样品管的体系一致,所以后续实验以6号空白处理方法进行测定。
2.3 缓冲液与酒曲提取比例的确定
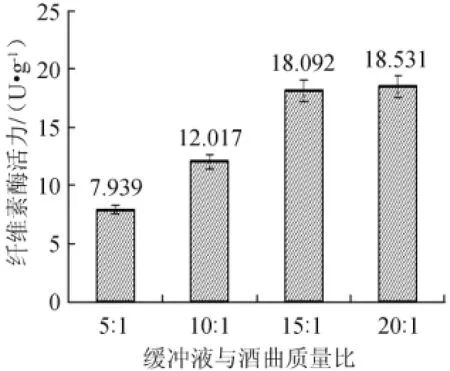
图3 不同缓冲液与酒曲质量比对纤维素酶活力的影响Fig.3 Effect of different buffer and starter ratio on CMCA
由结果分析可知,采用缓冲液与酒曲的质量比为5∶1和10∶1的提取液,纤维素酶活力分别是7.939和12.017,而采用15∶1与20∶1提取时,纤维素酶活力分别为18.092和18.531,无显著差异(P>0.05),说明15:1提取已将酶提取的较完全,因此,缓冲液与酒曲的质量比15∶1为宜。
2.4 酒曲中酶溶出方式的确定
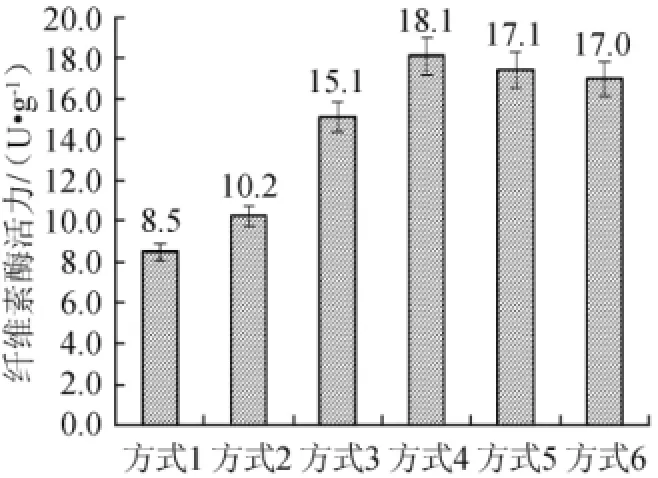
图4 不同酒曲中酶溶出方式对纤维素酶活力的影响Fig.4 Effect of different starter treatment on CMCA
由图4可知,酒曲+缓冲液振荡提取酶活最低;比较冷冻与研磨方式可知,无论先加或后加缓冲液将酒曲-20℃冷冻过夜,测定的酶活结果均比研磨的效果要好,同时节省时间,且酒曲先冷冻后加缓冲液提取操作方便易行;冷冻处理后振荡与超声破壁比较,振荡效果略好,这可能是因为振荡提取加大了溶液分子之间的碰撞,且振荡温度较高,更有利于纤维素酶的提取。这里超声破壁的方式并没有表现出优势,分析原因可能由于酒曲本身体系复杂,并且超声温度较低不利于酶的提取,综合能源、时间等因素考虑,后续实验采取酒曲-20℃冷冻过夜后加缓冲液振荡方式进行提取。
2.5 酶促反应pH的确定
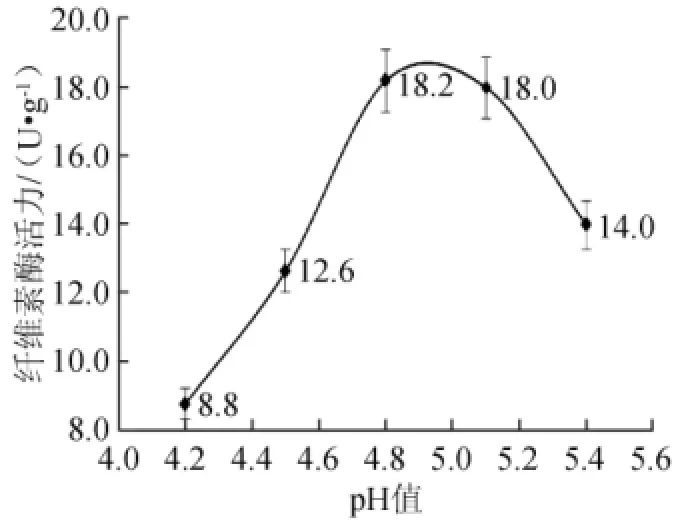
图5 不同pH对纤维素酶活力的影响Fig.5 Effect of diffierent pH on CMCA
在纤维素酶系中作用于底物的最适pH大多在4.0~5.5[12]之间,酶促反应pH较为集中,但又不统一,pH在4.6~6.2之间[13-16]。对纤维素酶测得结果进行显著性方差分析,差异显著(P<0.01);对结果进行比较分析发现,pH 4.8与pH 5.1纤维素酶活力差异不显著(P>0.05),说明酒曲中的纤维素酶在pH为4.8~5.1之间均可,本实验选择pH值为4.8,与标准方法一致。
2.6 酶促反应温度的确定
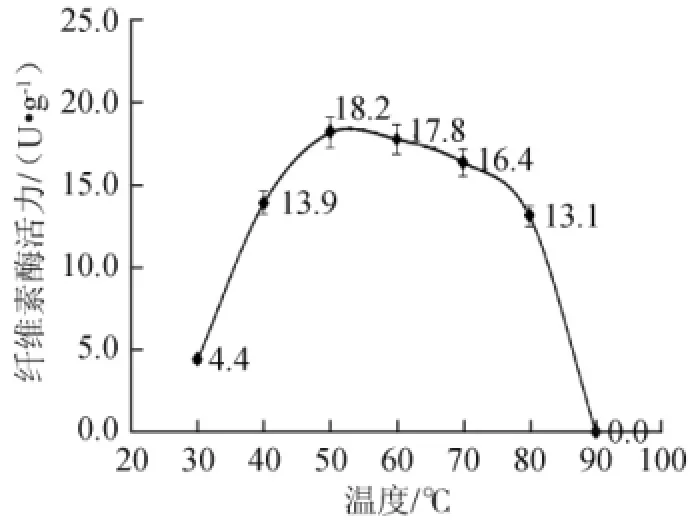
图6 不同温度对纤维素酶活力的影响Fig.6 Effect of diffierent temperature on CMCA
大多数化学反应的速率都和温度有关,酶促反应也是如此。在不同温度条件下进行某种酶促反应,以测得的反应速率为横坐标,温度为纵坐标作图,即可得到钟罩型曲线[17]。目前,在用DNS法测定纤维素酶活力的方法中常用的酶促反应温度为40~50℃[18,19]。
由图6可见,纤维素酶活力呈现出先增加后降低的趋势,整个反应近似于钟罩型曲线。当酶解温度为50℃时,酶活力最高。对纤维素酶测得结果进行显著性方差分析,差异显著(P<0.01);对酶解温度进行两两比较发现,50℃与60℃时纤维素酶活力差异并不显著(P>0.05),说明酒曲中的纤维素酶比较耐高温,选择50℃为最适温度。
2.7 酶液与底物添加量的确定
本实验对1.3.2中的酶液与底物添加量三种水平的酶活进行了测定。第一个水平酶活为18.1 U/g,后两种水平由于酶液加的量比较大,酶液中淀粉酶及糖化酶酶解和本身含有的还原糖导致空白管吸光度较大,均>1,致使结果不准确且不稳定。所以本实验采取酶液和底物对应的添加量为0.50 mL+2.00 mL。
3 结论
本实验参考QB 2583—2003《纤维素酶制剂》中还原糖法测定羧甲基纤维素酶活力,对酒曲中的CMCA的影响因素进行了探讨,结果表明,最优条件为酒曲经-20℃冷冻过夜处理,用15倍的缓冲液振荡提取30 min,5 000 r/m离心5 min,上清为原始酶液。酶解反应条件为pH 4.8,样品0.50 mL和2.00 mL底物,空白为0.50 mL酶液和2.00 mL缓冲液,同时50℃反应30 min后添加3.0 mL DNS试剂,沸水浴显色10 min,冷却后补加2.00 mL底物,样品管补2.00 mL缓冲液,该检测方法适合酒曲的羧甲基纤维素酶测定。
[1]李新社,陆步诗.大曲丢糟代替米糠生产小曲的效果研究[J].酿酒,2006(7):65-66.
[2]邱雁临.纤维素酶的研究和应用前景[J].粮食与饲料科技,2001(8):30-31.
[3]秦广利,郭坤亮,汪强,等.纤维素酶对白酒酒糟资源化利用研究[J].酿酒科技,2009(4):34-35.
[4]岳思君,李学斌,李爱华,等.高酶活纤维素分解菌分离筛选的研究[J].安徽农业科学,2009,37(1):11-12,15.
[5]GHOSE T K,PATHAK A N,BISARIS V S.Symposium on enzymatic hydrolysis of cellulose[M].Finland:finnish national fund for research and development,1975.
[6]ROSE A H.Economic microbiology:microbial enzymes and bioconversions[M].New York:Academic Press Inc,1980.
[7]STELLMACH B.酶的测定方法[M].钱嘉渊译.北京:中国轻工业出版社,1992.
[8]GHOSE T K.Measurement of cellulose activities[J].Pure Appl Chem, 1987,58(2):257-268.
[9]SUANNE K.Optimizing the use of cellulose enzymes[J].Textile Chemist and Colorist February,1994,(2):13-15.
[10]WOOD T M.The cellulase of fusarium solani purification and specificity of theβ-(1,4)-glucanase and theβ-D-glucosidase components[J]. Biochem J,1971,121:353.
[11]中华人民共和国国家发展和改革委员会.QB 2583—2003,纤维素酶制剂[S].北京:2003.
[12]张树政.酶制剂工业[M].北京:科学出版社,1984:595-623.
[13]姜心,陈伟,周波,等.纤维素酶活测定影响因素的研究[J]. 2010(5):65-68.
[14]刘幸乐,姚继明,吴远明.酸的种类、pH和温度对酸性纤维素酶活力的影响[J].印染助剂,2012,29(12):11-14.
[15]谭占仙.研究pH值、温度对纤维素酶活力的影响[J].黑龙江科技,2009(6):10.
[16]孙盈,田永强,赵丽坤.纤维素酶的CMC酶活测定条件的研究[J].食品工业科技,2013(2):68-71.
[17]王镜岩,朱圣庚,徐长法.生物化学[M].北京:北京高等教育出版社,2002.
[18]游庆红,尹秀莲.黑曲霉原生质体诱变及其产纤维素酶条件研究[J].酿酒科技,2010(4):34-37.
[19]白爱枝,闫祖威,梁运章.黑曲霉产纤维素酶液体发酵条件的优化[J].食品科技,2008,34(3):11-13.
Analysis of affecting factors on determination of carboxymethyl cellulose activity in starter
ZHAO Shuang1,JI Fengdi1,ZHAO Zhanglin1,SONG Hao1,ZHENG Yuzhi1*,AI Jinzhong2,HU Jun2
(1.Beijing Industrial Technology Research Institute,Beijing 101111,China;2.Beijing Red Star Co.,Ltd.,Beijing101400)
The influence factor of reducing sugar method on carboxyl methyl cellulose activity(CMCA)of starter was discussed and a testing method suitable for CMCA determination was established.The research focused on the effect of enzyme extraction method in starter(extraction ratio of buffer and starter,enzyme extraction methods of starter),enzymolysis reaction conditions(enzymatic reaction pH,reaction temperature,enzyme and substrate addition)and blank choice.Experimental results showed that the optimal determination conditions were overnight cooling at-20℃, extracted through oscillation by 15 times quality buffer for 30 min,centrifuged with 5 000 r/min for 5 min.The supernatant was the crude enzyme solution.The reaction conditions of enzyme hydrolysis were as follows:0.50 ml enzyme with 2.00 ml substrate as sample and 0.50 ml enzyme with 2.00 ml buffer solution as blank,reaction time 30 min,temperature 50℃and pH 4.8.Then 3.0 ml DNS reagent was added and water bathed for 10 min for chromogenic reaction.After cooling,the blank was supplemented with 2.00 ml substrate and the sample was supplemented with 2.00 ml buffer solution,and then water were added to the solution to 25 ml.Finally the absorbance was determined at 540 nm.
starter;carboxymethyl cellulose activity;extract;hydrolysis conditions;blank choice
TS207.3
A
0254-5071(2014)10-0118-05
10.11882/j.issn.0254-5071.2014.10.028
2014-07-09
赵爽(1988-),女,硕士研究生,研究方向为食品生物技术。
*通讯作者:郑玉芝(1965-),女,教授级高级工程师,博士,研究方向为食品加工与检测。
