不同质量窖泥细菌群落的研究
2014-02-24杜礼泉罗惠波黄治国苟云凌贺新生王远成饶家权王晓刚范昌明唐聪
杜礼泉,罗惠波,黄治国,苟云凌,贺新生*,王远成,饶家权,王晓刚,范昌明,唐聪
(1.西南科技大学生命科学与工程学院,四川绵阳621010;2.四川省绵阳市丰谷酒业有限责任公司,四川绵阳621000;3.四川理工学院生物工程学院,四川自贡643000)
不同质量窖泥细菌群落的研究
杜礼泉1,2,罗惠波3,黄治国3,苟云凌2,贺新生1*,王远成2,饶家权2,王晓刚2,范昌明2,唐聪2
(1.西南科技大学生命科学与工程学院,四川绵阳621010;2.四川省绵阳市丰谷酒业有限责任公司,四川绵阳621000;3.四川理工学院生物工程学院,四川自贡643000)
采用多聚酶链式反应结合变性梯度凝胶电泳指纹分析技术(PCR-DGGE),对不同质量窖泥中细菌群落结构进行分析,从微生物角度说明了不同质量窖泥细菌种群的复杂性,同时,鉴定出了常见的芽孢杆菌、醋酸杆菌等微生物,以及发现可能的新菌种和尚未在窖泥研究中报道的瘤胃球菌。以质量最好的窖泥为参照,其他窖泥的质量与其跟参照窖泥的细菌群落间相似性指数总体呈正相关。这一规律为今后研究窖泥培养、养护和应用提供了理论依据。
浓香型白酒;窖泥;细菌群落
在浓香型白酒生产中,质量较好的窖泥生产酒的质量较好,质量较差的窖泥生产酒的质量也较差,如何使窖泥尽快转变为优质窖泥以及使优质窖泥不退化是白酒行业长期以来的追求。
通过对不同质量窖泥的研究,确定优质窖泥中微生物的种(群)、数量、所占比例以及在白酒酿造中的作用,为窖泥的培养、养护以及窖泥功能菌的应用提供理论依据,则成为窖泥微生物研究的重要内容。
随着分子生物学技术的发展,聚合酶链式反应(polymerase chain reaction,PCR)相关技术在特殊微生态环境中微生物群落分析中已经有了广泛的应用[1-10]。但是,采用分子生物学的方法研究不同质量窖泥中细菌群落结构及其变化还未见报道。因此,本实验采用多聚酶链式反应结合变性梯度凝胶电泳指纹分析技术(polymerase chain reactiondenaturing gradient gel electrophoresis,PCR-DGGE),对不同质量窖泥中细菌群落结构及进行分析,通过对窖泥细菌16S rDNA的克隆分析和DGGE图谱比较,并对优势微生物进行测序鉴定,对不同质量窖泥中细菌群落的构成有了更深入的认识,为今后研究窖泥培养、养护和应用提供了理论依据。
1 材料与方法
1.1 材料与试剂
窖泥样品取自四川省绵阳市丰谷酒业有限责任公司白酒生产窖池,根据公司窖泥质量标准分别采集7个不同品质窖泥样品(窖池底部中央),混合,迅速用冰盒运回,-20℃保藏。
7个不同品质窖泥根据产质量酒能力评分如下:1号:7.0分;2号:6.2分;3号:5.5分;4号:4.7分;5号:3.4分;6号:1.6分;7号:1.1分。窑泥产质量酒能力计算公式为:N=(A× 0.4+B×0.3+C×0.2+D×0.1)×100;式中:N为窖泥产质量酒能力,单位为“分”;A为所产调味酒的粮糟比;B为所产优级酒的粮糟比;C为所产一级酒的粮糟比;D为所产二级酒的粮糟比;A、B、C、D数据均为最近一年平均值。N值越大,说明窖泥产质量酒的能力越强,窖泥的质量就越好。酒质评分标准见表1。
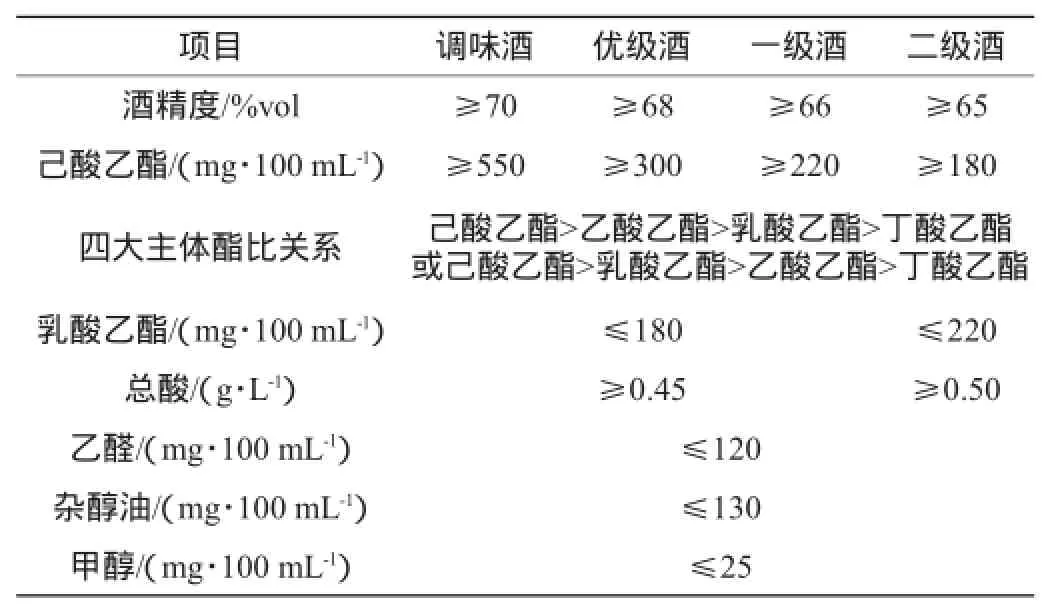
表1 酒质评分标准Table 1 Evaluation standard of liquor quality
1.2 仪器与设备
DGGE电泳仪、My Cycler型PCR仪:美国BIORAD公司;通用型恒压恒流电泳仪:北京君意东方电泳设备有限公司;Bio-Best 200E型凝胶成像分析系统:美国SIM公司;Universal 32R型高速冷冻离心机:德国Hettich公司;MX-S型可调式混匀仪、SK-L180-Pro型水平脱色摇床:美国赛洛捷克公司;SW-CG-1F型超净工作台:苏州苏洁净化设备有限公司。
1.3 实验方法
1.3.1 窖泥微生物总DNA的提取及检测
微生物总DNA的提取:采用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-酚抽提法[11]和DNA纯收试剂盒相结合的方法提取窖泥中微生物总宏基因组。
细菌PCR扩增:选用通用引物U968f-GC/L1401r[12-13],可以扩增出470 bp左右的片段。
PCR产物检测:取5 μL PCR扩增产物加入1 μL 6× loading buffer混匀,取3 μL DL2000TM DNA Marker作对照。于1%琼脂糖凝胶上140 V电泳25 min,溴化乙锭(ethidium bromide,EB)染色,在凝胶成像系统中观察并拍照保存。
1.3.2 窖泥PCR扩增产物变性梯度凝胶电泳及图像分析
窖泥PCR扩增产物采用DGGE技术分析细菌群落的构成。按比列配制高、低浓度的凝胶溶液(45%,65%,交联度为38.97∶1.03,胶浓度为8%,其配制方法见表2)。电泳完毕用用含有SYBR-Green的1×TAE电泳缓冲液滴加到电泳胶上进行染色,染色分三次进行,每次15 min,拍照保存DGGE图谱。采用Quantity One分析软件进行DGGE图谱的多样性指数、相似性指数分析。
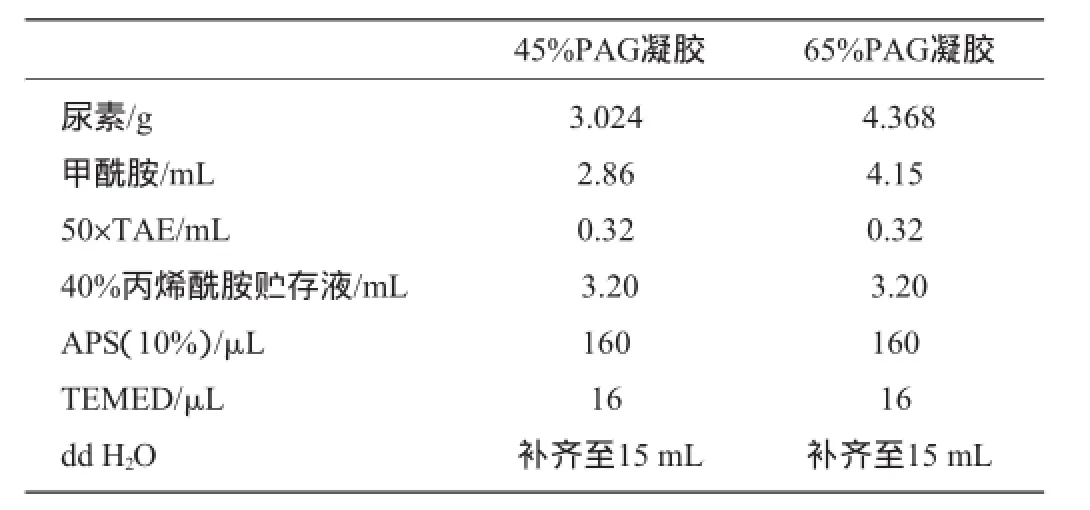
表2 变性凝胶配方Table 2 Formulation of denaturing gel
1.3.3 DGGE条带切胶条带回收DNA以及PCR扩增、测序
在凝胶成像仪上选取目标条带切胶条带回收DNA,5 μL回收产物作为模板进行PCR扩增,选用TaKaRa MiniBEST DNA Fragment Purification Kit进行PCR产物的回收纯化,再通过DNA片段连接T载体,大肠杆菌E.coli DH5α感受态转化进行克隆。各样品挑选克隆得到的白色菌落3个送至上海英潍捷基测序,测序引物为344f-GC/522r。测序结果在GenBank上进行比对,确定对应条带种属信息。
2 结果与分析
2.1 不同质量窖泥细菌16S rRNA V6-V8区基因的获取
窑泥微生物总DNA进行提取后,经0.1%琼脂糖凝胶电泳检测,结果见图1。
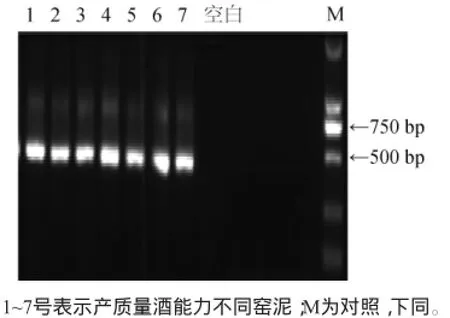
图1 不同质量窖泥细菌PCR扩增结果Fig.1 PCR amplification results of bacteria in pit mud with different quality
2.2 不同质量窖泥细菌16S rRNA V6-V8区基因DGGE电泳
为了将目标片段最大程度的分离得到最优的DGGE图谱,则需要适合该样品的电泳条件。目前很多文献中所述的水平胶电泳电压通常在90~200 V之间,时间为2~12 h,但是电泳时间过短不利于条带的分离,本试验优化之后使用电泳电压为120 V,时间为12.5 h,电泳凝胶梯度最终确定变性梯度为45%~65%,电泳条带得到了较好的分离,试验得到条带清晰的DGGE图谱(见图2)。由图2可知,每个样品的16S rDNA PCR产物得到了较好的分离。

图2 不同质量窖泥细菌的DGGE图谱Fig.2 DGGE pattern of the bacteria in pit mud with different quality
2.3 不同质量窖泥细菌DGGE图谱丰度及优势度的分析
丰度在图谱上代表了每个泳道中有效的条带,也可以认为是表达了该条带对应样品所表征出的物种数。
优势度表征了该物种在整个群落中所占比例大小,Quantity One在图谱分析中可以进行TIF分析(即灰度分析)以条带相对质量值得以体现,其值大小与条带峰面积和明暗程度呈正比,在图谱中则代表了相对应条带的优势度。
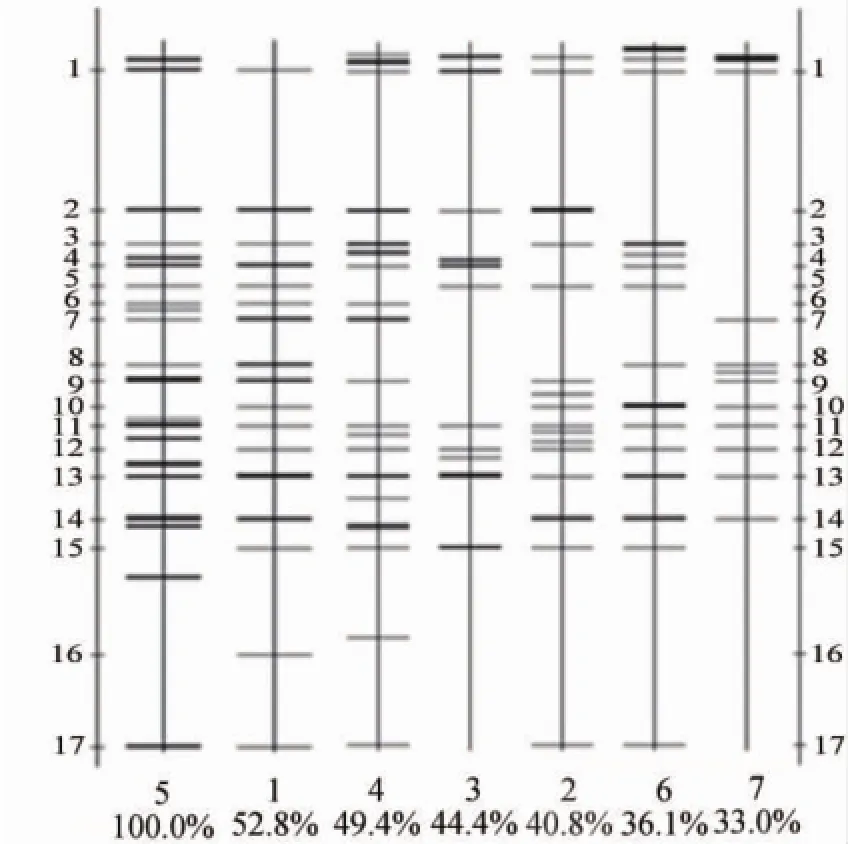
图3 不同质量窖泥细菌的DGGE电泳条带位置比较图Fig.3 Compare image of DGGE bands of the bacteria in pit mud with different quality
由图3和表3可知,不同质量窖泥细菌的丰度值在11~22之间,表明不同质量窖泥之间的细菌种群数差异很大,或者是在PCR表达过程中出现了一定的偏向性。同时,也可看出不同质量窖泥细菌的种群数都较丰富,但窖泥细菌的种群数与窖泥的质量无相关性;通过对不同质量窖泥的细菌DGGE图谱优势度分析,1号、11号、13号条带为不同质量窖泥细菌共有的条带,但各条带的优势度与窖泥的质量无相关性。
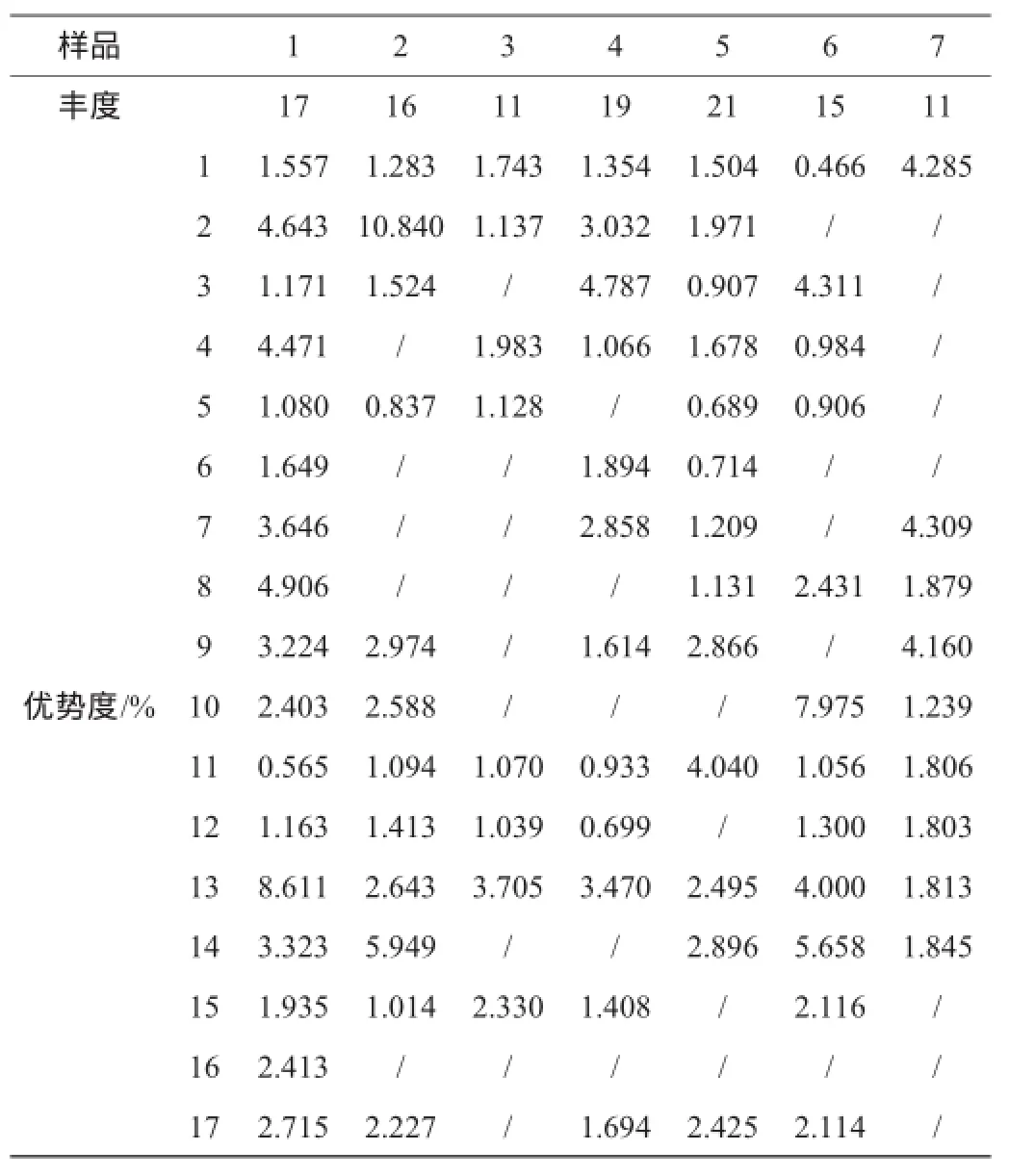
表3 不同质量窖泥细菌条带丰度及优势度Table 3 Abundance and dominance of the bacterial strips in pit mud with different quality
2.4 不同质量窖泥细菌DGGE图谱的多样性指数分析

图4 不同质量窖泥细菌DGGE图谱的多样性指数Fig.4 Diversity index of DGGE patterns of the bacteria in pit mud with different quality
Shannon-Wiener多样性指数(H值)包含两个因素:(1)种类数目,即丰度值;(2)种类中个体分配上均匀性[14]。因此,窖泥多样性指数的高低由窖泥微生物种类和均衡性共同决定。窖泥多样性指数越高,窖泥中的生物多样性就越高。

式中:H为Shannon-Wiener多样性指数;pi为第i个条带的优势度;S为每一个泳道的丰度值。
不同质量窖泥细菌DGGE图谱的多样性指数分析结果见图4。由图4可知,不同质量窖泥细菌DGGE图谱的多样性指数最低是0.72(3号窖泥),最高为1.65(1号窖泥),但不同质量窖泥细菌DGGE图谱的多样性指数与窖泥的质量无相关性。
2.5 不同质量窖泥细菌DGGE图谱的相似性指数分析
实验通过Quantity One软件对各个样品之间的相似性进行了分析,得出不同质量窖泥细菌群落之间的相似度见表4。
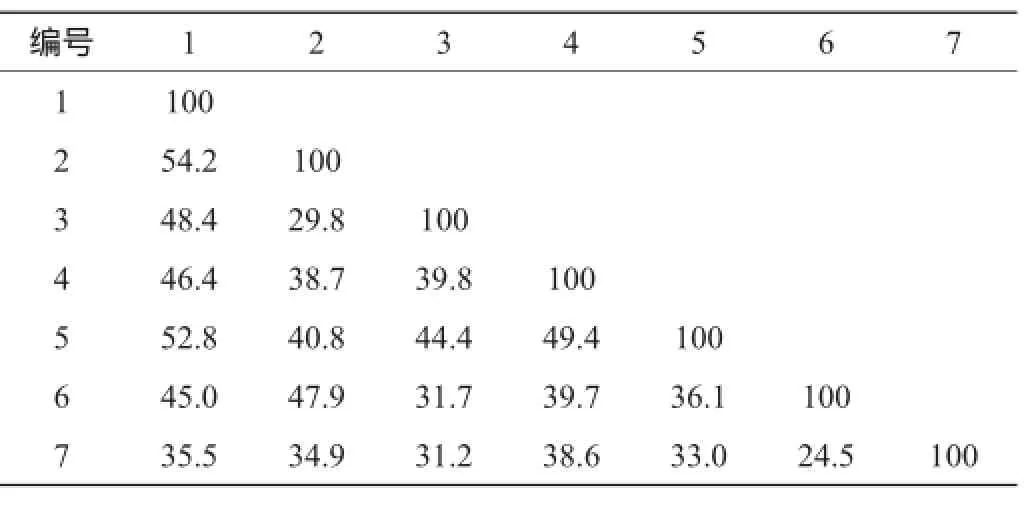
表4 不同质量窖泥细菌群落间的索伦森配对相似性系数值Table 4 Sorenson pairwise similarity coefficient of the bacterial community in pit mud with different quality %
由表4可知,不同质量窖泥细菌群落之间的相似度为:以1号窖泥(本实验中质量最好的窖泥)为参照,其他窖泥的质量与其跟参照窖泥的细菌群落间相似性指数总体呈正相关。
2.6 不同质量窖泥细菌DGGE优势条带切胶回收及鉴定

表5 细菌16S rRNA V3区基因的DGGE切胶条带的测序结果分析Table 5 Sequencing results of the bands cut from the bacterial 16S rRNA V3 DGGE gels
DGGE电泳结束染色后选取了15个优势条带进行切胶回收,切胶回收条带经968f和1401r重新PCR后,将二次PCR产物进行纯化并连接到PGM-T载体上,载体转化到E.coli DH5α感受态细胞中,通过蓝白斑筛选每个切胶条带挑取约3个阳性单克隆送上海英潍捷基公司进行测序。测序结果只有11个条带获得序列并在NCBI上进行比对,相似率基本>90%,比对结果(表5)显示11个条带所代表的细菌包括了常见的芽孢杆菌、醋酸杆菌等,也有在窖泥中未培养出的瘤胃球菌,条带5没有具体的菌种结果,只是表明为一类细菌,在本实验中5号条带优势度也极为显著,这可能是窖泥中还未发现的新菌种,可以进一步进行研究。
3 结论与展望
根据不同质量窖泥细菌DGGE图谱丰度、优势度和多样性指数的分析,可看出不同质量窖泥细菌的种群数都较丰富,既有共有细菌种群,也有部分窖泥才具有的特定细菌种群,窖泥细菌DGGE图谱的丰度、多样性指数、各条带的优势度与窖泥的质量无相关性,这从微生物角度说明了不同质量窖泥中细菌种群的复杂性。
根据不同质量窖泥细菌群落之间相似度的分析,发现以质量最好的窖泥为参照,其他窖泥的质量与其跟参照窖泥的细菌群落间相似性指数总体呈正相关,即窖泥质量越好,表现为其与最优质参照窖泥的细菌群落间相似性指数越高。
根据不同质量窖泥部分细菌鉴定结果的分析,包括了常见的芽孢杆菌、醋酸杆菌等微生物[15],表明窖池中的细菌种类很丰富,其中的有些细菌是互利共生的关系,也有的细菌与古菌也存在互利共生的关系[16]。同时,本实验中条带5没有具体的菌种结果,可能是窖泥中还未发现的新菌种,有必要进一步进行研究,鉴定的瘤胃球菌尚未在窖泥研究中有所报道,对丰富浓香型白酒窖池中细菌类的信息有一定作用。
本实验从微生物角度说明了不同质量窖泥细菌种群的复杂性,以及本实验在窖泥细菌方面的鉴定结果和新的发现,特别是发现以质量最好的窖泥为参照,其他窖泥的质量与其跟参照窖泥的细菌群落间相似性指数呈正相关这一规律,为今后研究窖泥培养、养护和应用提供了理论依据。
[1]张洪勋,王晓谊,齐鸿雁.微生物生态学研究方法进展[J].生态学报,2003,23(5):988-995.
[2]王海英,张文学,施思,等.水井坊窖底泥微生物群落结构的DGGE分析[J].中国酿造,2012,31(2):38-41.
[3]施思,王海英,张文学,等.浓香型白酒不同窖泥的微生物群落特征分析[J].酿酒科技,2011(5):38-41.
[4]陶勇,徐占成,李东迅,等.窖泥细菌群落结构演替及其与环境因子的相关性[J].酿酒科技,2011(9):42-46.
[5]罗惠波,甄攀,黄治国.浓香型白酒窖池细菌群落[J].微生物学通报,2010,37(11):1621-1627.
[6]黄治国,甄攀,罗惠波.浓香型白酒窖池古菌群落研究[J].西南大学学报:自然科学版,2010,32(12):91-96.
[7]郑佳,张良,沈才洪,等.浓香型白酒窖池微生物群落结构特征[J].应用生态学报,2011,22(4):1020-1026.
[8]向文良.中国浓香型白酒窖池窖泥中原核微生物群落空间异质性的研究[D].成都:西华大学硕士论文,2013.
[9]李家民,邹永芳,王海英,等.DGGE法初步解析沱牌酒厂窖底泥微生物群落结构[J].酿酒科技,2013(3):36-39.
[10]罗青春,刘超兰,吴正云,等.不同年份窖泥中主要产甲烷菌的荧光定量PCR研究[J].酿酒科技,2013(12):17-20.
[11]赵兴青,杨柳燕,陈灿,等.PCR-DGGE技术用于湖泊沉积物中微生物群落结构多样性研究[J].生态学报,2006(11):3610-3616.
[12]林海龙,李伟光,闫险峰,等.中药废水污泥群落结构解析中PCRDGGE引物的选择与评价[J].环境科学,2011(5):1505-1510.
[13]SANCHEZ O,GASOL J M,MASSANA R,et al.Comparison of different denaturing gradient gel electrophoresis primer sets for the study of marine bacterioplankton communities[J].Appl Environ Microbiol, 2007,73(18):5962-5967.
[14]翟祖欢.PCR-DGGE在真菌群落研究中的应用解析[J].齐齐哈尔大学学报,2010,26(3):57-59.
[15]何翠容,吴冬梅,郑佳,等.浓香型白酒窖池细菌与古菌随窖龄变化的特征[J].酿酒科技,2013(1):27-30.
[16]唐云容,钟方达,张文学.浓香习酒窖泥微生物菌群多样性及系统发育分析[J].酿酒科技,2011(12):24-27.
Bacterial community in pit muds with different quality
DU Liquan1,2,LUO Huibo3,HUANG Zhiguo3,GOU Yunling2,HE Xinsheng1*,WANG Yuancheng2,RAO Jiaquan2, WANG Xiaogang2,FAN Changming2,TANG Cong2
(1.School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China; 2.Forgood Liquor Industry Co.,Ltd.,Mianyang 621000,China; 3.School of Bioengineering,Sichuan University of Science&Engineering,Zigong 643000,China)
The bacterial community in pit muds with different quality was analyzed by polymerase chain reaction denaturing gradient gel electrophoresis(PCR-DGGE).The complexity of their bacterial community structures was illustrated from the microbial point of view.At the same time,common Bacillus spp.,Acetobacter spp.and other microbes were identified,as well as new species and not reported Rumen aureus in the study of pit mud were discovered.Using the optimal pit mud as reference,the relationship between other pit mud quality and their similarity index between bacterial community and the reference was in positive correlation.The result provided a theoretical basis for study of pit mud culture,maintain and application in the future.
Luzhou-flavor liquor;pit mud;bacterial community
TS261.1
A
0254-5071(2014)10-0113-05
10.11882/j.issn.0254-5071.2014.10.027
2014-07-24
绵阳市科技计划项目(12CGZH15)
杜礼泉(1975-),男,高级工程师,硕士研究生,主要从事白酒生产工艺与酿酒微生物的研究工作。
*通讯作者:贺新生(1965-),男,教授,本科,主要从事菌物资源研究工作。
