反相高效液相色谱法测定刺梨中芦丁和槲皮素的含量
2014-02-20王振伟魏家红黄河水利职业技术学院河南开封475000
王振伟,魏家红(黄河水利职业技术学院,河南开封475000)
反相高效液相色谱法测定刺梨中芦丁和槲皮素的含量
王振伟,魏家红
(黄河水利职业技术学院,河南开封475000)
建立反相高效液相色谱法测定刺梨中芦丁和槲皮素的含量。采用Waters Sunfire ODS C18色谱柱(4.6 mm×150 mm,5 μm),流动相为甲醇-0.2%磷酸缓冲溶液(60:40),流速1.0 mL/min,检测波长360 nm,柱温30℃,进样量10 μL。结果表明,在上述色谱条件下,芦丁和槲皮素良好分离,质量浓度分别在2~100 μg/mL(R2=0.999 1)和1~100 μg/mL(R2=0.999 2)之间线性关系良好。平均加标回收率分别为98.27%和99.15%,相对标准偏差(RSD)分别为2.98%和3.76%,重现性实验RSD分别为芦丁2.18%(n=5),槲皮素1.76%(n=5)。测得刺梨中芦丁和槲皮素的平均含量分别为7.070 mg/g和1.352 mg/g。RP-HPLC法简便快捷、灵敏,结果准确,可用于刺梨中黄酮成分含量的检测。
刺梨;黄酮;反相高效液相色谱;芦丁;槲皮素
刺梨(Rosa roxburghii)是蔷薇科蔷薇属落叶灌木,又名缫丝花、文先果、送春归,是集药用、保健、食用、观赏为一体的绿色特新水果,多分布于贵州、云南、河南等省。刺梨营养价值及食用价值极高,已有报道刺梨有提高免疫功能、延缓衰老、抗氧化、抗动脉粥样硬化、抗肿瘤、解毒镇静、降血脂等多种生物学作用[1-4],近年来,有关刺梨果实中丰富的天然抗氧化物质(黄酮类化合物及超氧化物歧化酶等)引起人们的广泛关注[5-8]。
黄酮类化合物作为刺梨的主要生物活性成分之一,具有消除自由基、抗氧化、降血糖血脂、降血压、抗肿瘤等作用,其中芦丁和槲皮素是其主要活性成分,芦丁具有降低毛细血管通透性、抗病毒、镇痛、抗氧化及抑制醛糖还原酶等药理活性,槲皮素具有降低血压、增强毛细血管抵抗力、减少毛细血管脆性、降血脂、增加冠脉血流量等作用。因此研究刺梨中芦丁和槲皮素含量的测定对于刺梨的质量评价及资源的开发利用具有重要的意义。芦丁和槲皮素的分析检测方法已报道有分光光度法、催化动力学光度法、薄层色谱法、高效液相色谱法、毛细管电泳法、荧光光谱法等[9-15],其中最常用的是高效液相色谱法。为了综合开发刺梨这种植物资源,本实验用微波辅助提取刺梨中的总黄酮,并建立了反相高效液相色谱法同时测定芦丁和槲皮素含量的方法,为刺梨制品质量评价和资源利用提供可借鉴的简便、可行、效率高、重复性好的分析方法。
1 材料与方法
1.1 材料与试剂
刺梨:购自河南开封医药大厦。
芦丁、槲皮素(标准品):中国药品生物制品检定所;甲醇(色谱纯):天津四友精细化学品有限公司;磷酸、磷酸氢二钾、磷酸二氢钠、无水乙醇等均为分析纯:天津德恩化学试剂有限公司;实验用水为超纯水。
1.2 仪器与设备
MDS-6微波消解萃取仪:上海新仪微波化学科技有限公司;Waters 1525高效液相色谱仪、2487紫外检测器:美国沃特世公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂;HC-3018R冷冻离心机:科大创新股份有限公司中佳分公司。
1.3 实验方法
1.3.1 样品溶液制备
干燥的刺梨果实粉碎过40目筛,准确称取粉末2.00 g,置于具塞三角烧瓶中,加入体积分数为60%的乙醇40 mL,微波功率400W辅助提取3min,离心分离得到上清液,转移至50 mL容量瓶中加体积分数为60%的乙醇定容作为待测液,进样前用0.45 μm滤膜过滤后作为供试品溶液[1,8]。
1.3.2 混合对照品溶液的制备
精密称取120℃干燥至恒质量的芦丁标准品及槲皮素标准品各25 mg,全部置于25 mL容量瓶中,加体积分数为80%的乙醇溶解并定容至刻度,配成芦丁和槲皮素质量浓度均为1 mg/mL的混合对照品标准溶液。精密量取此混合标准溶液0.1 mL、0.2 mL、0.5 mL、1.0 mL、2.0 mL、5.0 mL、10.0 mL,分别置于100 mL容量瓶中,加流动相至刻度,摇匀过滤后备用。
1.3.3 色谱条件
色谱柱为Waters sunfire ODS C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇-0.2%磷酸溶液(60∶40);柱温30℃;流速1.0 mL/min;进样量10 μL,检测波长以扫描为准。
2 结果与分析
2.1 检测波长的确定
我的画院:画院坐落在美丽的地方,有很多美丽的故事。如果想到其与宋代有着各种联系,立刻让人感到渺小,又让人振奋,力争创作出美丽的画,以不负各方。
将芦丁和槲皮素对照品溶液利用紫外分光光度计在波长200~600 nm范围内扫描,最大吸收峰对应的波长即为检测波长,结果如图1所示。结果表明,在波长254 nm和360 nm处有两个吸收峰,鉴于低波长处杂质的干扰,选用360 nm作为检测波长。

图1 芦丁和槲皮素标准品紫外光谱图Fig.1 Spectrogram of rutin and quercetin standard samples
2.2 标准曲线的绘制
精密吸取1.3.2中配制好的质量浓度为1μg/mL、2μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL和100 μg/mL的混合对照品溶液各10μL进样,以峰面积(Y)为纵坐标,对照品溶液的质量浓度(X)为横坐标,绘制标准曲线,结果见图2。芦丁和槲皮素的线性回归方程为Y=15 618X-11 087(R2=0.9991)和Y=2063.7X-923.8(R2=0.9992)。结果表明,芦丁和槲皮素质量浓度分别在2~100μg/mL和1~100μg/mL之间线性关系良好。

图2 芦丁和槲皮素标准曲线Fig.2 Standard curves of rutin and quercetin
2.3 精密度实验
为考察方法的稳定性,在上述色谱条件下,精密吸取质量浓度为50 μg/mL的混合对照品溶液10 μL进样,重复进样5次,记录其峰面积分值,结果见表1。分别计算芦丁、槲皮素的峰面积相对标准偏差(relative standard deviation,RSD)值,其中芦丁RSD为0.85%、槲皮素RSD为0.97%,结果表明,精密度良好。

表1 精密度实验结果Table 1 Results of precision experiment
2.4 重现性实验

表2 精密度实验结果Table 2 Results of repeatability experiment
2.5 加标回收率实验
为考察方法的准确度,精密移取5份已知含量的样品供试液200 μL。分别精密加入100 μg/mL的混合对照品溶液50μL混合,精密吸取10μL。在上述色谱条件下进行分析,结果见表3。由表3可知,芦丁平均回收率98.27%,RSD为2.98%,槲皮素平均回收率99.15%,RSD为3.76%表明实验准确性好。
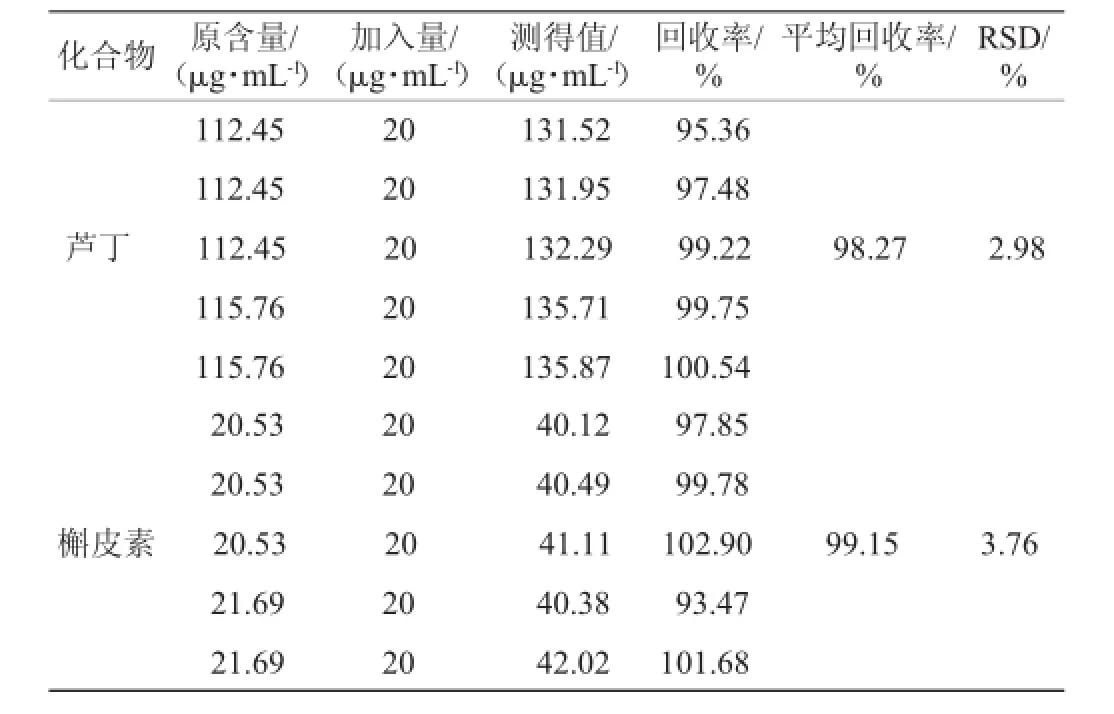
表3 回收率实验结果Table 3 Results of recovery experiment
2.6 样品含量的测定

图3 混合标准对照品(A)及样品(B)色谱图Fig.3 HPLC chromatograms of mixed reference substances(A)and sample(B)
按照上述色谱条件,在波长360 nm条件下,分别精密吸取芦丁和槲皮素混合对照品溶液和供试品溶液各10 μL进样。其色谱图结果见图3。
由图3可知,混合对照品中芦丁和槲皮素分离良好,通过保留时间进行定性,芦丁标样的保留时间为2.406 min,槲皮素标样的保留时间是4.449 min,样品分别在2.315 min和4.633 min中出现峰值。这两种物质在10 min内能够完全分离,互不干扰。除了芦丁和槲皮素在刺梨黄酮提取物中存在,仍有很多未知成分亟待确定。随后的工作中,需对刺梨中其他几种黄酮成分进行定性和定量分析,进一步确定刺梨中黄酮的种类和含量。
准确吸取样品溶液10 μL注入高效液相色谱仪,测定芦丁和槲皮素峰面积,平行3次,按照外标法计算刺梨果实样品中芦丁和槲皮素的含量,结果见表4。
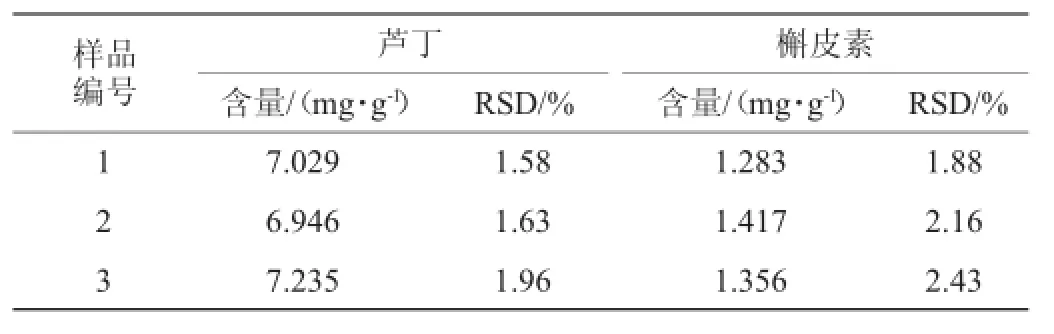
表4 刺梨样品中芦丁和槲皮素含量测定结果(n=3)Table 4 Determination results of rutin and quercetin in samples(n=3)
由表4可知,芦丁和槲皮素是刺梨黄酮的主要成分,其中芦丁的平均含量为7.070 mg/g,槲皮素的平均含量为1.352 mg/g,RSD值均<3%。反向高效液相色谱法用于同时测定刺梨中芦丁和槲皮素的含量,具有可行性。
3 结论
芦丁和槲皮素是刺梨果实中主要的黄酮成分,可以作为刺梨黄酮测定的指标。实验采用微波提取刺梨果实中芦丁和槲皮素,方法操作简便、样品前处理简单、提取效率高。采用反向液相色谱法测定芦丁和槲皮素含量,以甲醇-0.2%磷酸缓冲溶液(60∶40)作为流动相能够保证芦丁和槲皮素在10 min之内出峰,分析速度快,分离效果好。实验建立的同时测定刺梨中芦丁和槲皮素含量的方法,简化了分析过程,方法迅速、结果可靠,可为刺梨资源的合理开发利用和质量评价提供理论依据。
[1]王振伟,胡晓冰,王恺,等.微波辅助提取刺梨中总黄酮的工艺参数优化[J].光谱实验室,2012,29(3):1527-1530.
[2]ZHANG C,LIU X,QIANG H,et al.Inhibitory effects ofRosa roxburghii Tratt juice onin vitrooxidative modification of low density lipoprotein and on the macrophage growth and cellular cholesteryl ester accumulation induced by oxidized low density lipoprotein[J].Clin Chim Acta, 2001,313(1):37-43.
[3]张晓玲,瞿伟蔷,孙斌,等.刺梨总黄酮的提取纯化工艺研究[J].中成药,2005,27(9):1089-1091.
[4]田宏哲,周艳明,赵瑛博,等.刺梨中芦丁成分的定量测定[J].食品科学,2009,30(10):203-205.
[5]王慧,黄聪,刘思源,等.HPLC测定刺梨中杨梅素和槲皮素的含量[J].中国实验方剂学杂志,2013,19(1):109-111.
[6]何伟平,朱晓韵.刺梨的生物活性成分及产品开发研究进展[J].广西轻工业,2011(11):1-3.
[7]安华明,刘明,杨曼,等.刺梨有机酸组分及抗坏血酸含量分析[J].中国农业科学,2011,4(10):2094-2100.
[8]涂国云,刘利花.刺梨的营养成份及保健药用[J].中国林副特产,2006(1):68-70.
[9]刘冲,李丽丽.芦丁的含量测定方法研究进展[J].亚太传统医药,2009,5(9):135-137.
[10]贾冬冬,李淑芬,杨宏玲,等.RP-HPLC法测定桑叶中芦丁和异槲皮苷含量[J].食品科学,2008,29(8):499-501.
[11]李敏晶,游景艳,刘忠英,等.微波辅助流动萃取槐花中的黄酮类成分[J].高等学校化学学报,2004,25(5):850-852.
[12]王克勤,罗军武,陈静萍,等.芹菜提取物中芹菜素的HPLC与HPTLC定量分析研究[J].食品科学,2008,29(4):291-295.
[13]王丽峰,彭敬东,刘丽敏,等.高效液相色谱法同时测定柿叶和连翘中黄酮和三萜类化合物的含量[J].中国实验方剂学杂志,2008,27(增刊):176-179.
[14]吴亮亮,石雪萍,张卫明,等.反相高效液相色谱法测定不同品种花椒中芦丁和槲皮素的含量[J].中国野生植物资源,2011,30(1):54-56.
[15]李艳艳,周光明,辛丹敏,等.HPLC法测定杜仲中绿原酸和芦丁[J].西南大学学报:自然科学版,2010,32(1):59-62.
Determination of rutin and quercetin inRosa roxburghiiby RP-HPLC
WANG Zhenwei,WEI Jiahong (Yellow River Conservancy Technical Institute,Kaifeng 475000,China)
RP-HPLC method for quantitative determination of rutin and quercetin in Rosa roxburghii was established.Waters sunfire ODS C18column (4.6 mm×150 mm,5μm)was used as fixed phase,and methanol-0.2%phosphate buffer solution(60:40)was used as mobile phase running with a flow rate of 1.0 ml/min.The detection wavelength was 360 nm and the column temperature was 30℃.The results showed that rutin and quercetin were well separated by this method.The rutin and quercetin were in good linear relationship in concentration range of 2-100 μg/ml(R2=0.999 1)and 1-100 μg/ml(R2=0.999 2),respectively.The standard addition recovery was 98.27%and 99.15%,relative standard deviation was 2.98%and 3.76%, and the relative standard deviation of reproducibility experiment was 2.18%(n=5)and 1.76%(n=5),respectively.The average content of rutin and quercetin in Rosa roxburghii were 7.07 mg/g and 1.352 mg/g.The RP-HPLC method was simple,quick,accurate and sensitive,which can be used in rutin and quercetin content determination.
Rosa roxburghii;flavonoids;RP-HPLC;rutin;quercetin
O657.72
A
0254-5071(2014)07-0109-04
10.11882/j.issn.0254-5071.2014.07.025
2014-05-12
河南省教育厅自然科学基金项目(12B530003)
王振伟(1980-),男,讲师,硕士,研究方向为天然产物提取分离及活性研究。
