即食湿面条中腐败微生物的分离和鉴定的初步研究
2014-02-20许玉慧许喜林辛淑敏华南理工大学轻工与食品学院广东广州510640
许玉慧,许喜林*,辛淑敏(华南理工大学轻工与食品学院,广东广州510640)
即食湿面条中腐败微生物的分离和鉴定的初步研究
许玉慧,许喜林*,辛淑敏
(华南理工大学轻工与食品学院,广东广州510640)
为探究即食湿面条中的腐败微生物,通过形态学鉴定,生化鉴定等手段对导致即食湿面条腐败的微生物进行分离纯化和鉴定,初步证明引起即食湿面条腐败的优势微生物主要是枯草芽孢杆菌(Bacillus subtilis),地衣芽孢杆菌(Bacillus licheniformis)和巨大芽孢杆菌(Bacillus megaterium)。
即食湿面条;腐败微生物;分离;鉴定
面条是一种源自中国,具有源远流长历史的食物。目前,中国市场上的面条类食品主要由三大类组成:挂面,方便面,即食湿面条(又称保湿鲜面(long life,LL))[1]。然而,随着工业化规模的不断扩大,人们对营养要求、风味口感、方便快捷等需求的与日俱增,即食湿面条以其不脱水、营养卫生、口感好、携带和食用方便等特点,在中国市场的发展空间将会越来越大。但是即食湿面条属于高水分食品,容易导致腐败微生物的滋生,因此,防止微生物的腐败变质是保证即食湿面条品质的关键之一[2]。研究即食湿面条中的腐败微生物十分必要。
目前,国内外对各类面条有一定研究,周其中[2]对生鲜湿面进行研究,证明细菌和霉菌是主要的腐败菌群,但其未对细菌属进行鉴定。黄斌等[3]对生鲜湿面建立了危害分析和关键环节控制点(hazard analysis and critical control point,HACCP)系统,进行了危害分析并建立关键控制点。JENSEN N等[4]对澳大利亚多个超市出售的高湿面条中的腐败菌群进行调查分析,结果表明主要为大肠菌群、乳酸菌、酵母菌和霉菌。然而对即食湿面条中腐败微生物的相关报道相对较少,有李昌文等[5]对即食湿面条的保鲜研究,但其未对腐败微生物进行分离鉴定。本研究对即食湿面条中的腐败微生物进行分离纯化,通过形态学鉴定和生化鉴定探究导致即食湿面条腐败的优势微生物,从而从微生物角度控制其腐败变质,为即食湿面条的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
面粉:购于后勤市场,产自山东鲁王集团有限公司。
1.1.2 试剂
30%过氧化氢溶液、靛基质、革兰氏染色剂、V-P试剂、硝酸盐、吲哚等均为分析纯:广东环凯公司;氯霉素:湖北众诚药业有限公司。
1.1.3 培养基
分离和计数培养基采用营养琼脂:用于细菌分离;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:用于酵母和霉菌的分离;孟加拉红培养基:用于霉菌的分离;平板计数琼脂(plate count agar,PCA)培养基:用于平板计数。
生化鉴定培养基采用休和利夫森二氏培养基、V-P实验培养基、硝酸盐还原实验培养基、丙酸盐培养基、柠檬酸盐实验培养基、吲哚实验培养基、葡萄糖氧化发酵培养基、明胶水解培养基、淀粉水解培养基等,按照《常见细菌系统鉴定手册》[6]和《食品微生物实验室手册》[7]配制。
1.2 仪器与设备
pHS-3C型精密pH计、MP502B型电子天平:上海精科天平公司;HY300-3型超净工作台:苏净华科净化仪器有限公司;GZX-9070型电热恒温培养干燥两用箱:厦门医疗电子仪器厂;HH.B11.360-S型电热恒温培养箱:上海跃进医疗机械厂;HG303-3型电热恒温培养箱:南京实验仪器厂;H·S·G-ⅡB-4型电热恒温水浴锅:上海迅大机电仪器有限公司;DragonMed型手动单道可调式移液器:上海大龙医疗设备有限公司;XSP-3CA型单目生物显微镜:上海光学仪器六厂;GI36TW型全自动高压灭菌锅:致微仪器有限公司,BL-smart型拍击式均质器:北京祥龙环宇生物技术有限公司。
(4)政府采取的激励无效概率为X,政府采取的激励有效概率为1-X。购房者购买和使用普通建筑的概率为Y,购房者购买和使用被动房的概率为1-Y。如下表2所示:
1.3 实验方法
1.3.1 即食湿面条的制作工艺流程

1.3.2 即食湿面条的微生物计数
菌落总数测定:参照GB/T 4789.2—2010《食品卫生微生物学检验菌落总数测定》[8];霉菌及酵母菌测定:参照GB/T 4789.15—2010《食品卫生微生物学检验霉菌和酵母菌计数》[9]。
1.3.3 即食湿面条中微生物的分离纯化
在无菌条件下,取25 g变质面条于装有225 mL无菌水的无菌均质袋中,振荡2 min,依次作10-4,10-5,10-6,10-7梯度稀释,吸取1 mL样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取1 mL空白稀释液加入两个无菌平皿内作空白对照。及时将15~20 mL冷却至46℃的分离培养基倾注平皿,并转动平皿使其混合均匀。平板凝固后,(36±1)℃培养(48±2)h。培养后,挑取不同形态的单菌落,平板划线分离,进行纯培养。
1.3.4 即食湿面条的腐败验证实验
挑取一小环所有可疑菌落加入1 mL无菌水中,制成菌悬液,依次加入煮至白芯消失的面条中,并做空白对照,放入37℃培养箱中,每隔12 h观察面条的感官状况,判定面条是否变黏稠,易断,有酸败味,并测定菌落总数,从而筛选出导致面条腐败变质的微生物。筛选出的微生物放置在4℃的冰箱中保藏,用于后续研究。
参考《常见细菌系统鉴定手册》[3]采取菌落观察、革兰染色、芽孢染色等方法对实验中分离得到的菌株进行初步鉴定;通过硝酸盐还原、接触酶、氧化酶、葡萄糖、甘露醇、木糖发酵实验、V-P实验、明胶水解、淀粉水解、柠檬酸盐利用、丙酸盐利用、吲哚实验、耐盐性实验、耐热性等生化鉴定实验对分离的菌株进行生化鉴定。
2 结果与分析
2.1 即食湿面条微生物计数
将1.3.3中得到的稀释液分别接种到营养琼脂培养基、PDA培养基(添加氯霉素)、孟加拉红培养基,经培养后,各培养基中微生物的生长情况如表1所示。

表1 各培养基中微生物的生长情况Table 1 Growth situation of microorganisms in mediums
由表1可知,适宜细菌生长的营养琼脂培养基微生物长较多,适宜酵母和霉菌生长的PDA培养基(添加氯霉素)和适宜霉菌生长的孟加拉红培养基均为检测到微生物的生长。从而得知导致面条腐败的主要优势微生物是细菌。
2.2 细菌的分离纯化及验证筛选
从营养琼脂培养基中挑选出15个不同形态的菌落,反复划线分离,进行纯培养,并标记为A1、A2、A3、A4、A5;B1、B2、B3、B4、B5;C1、C2、C3、C4、C5;将筛选出的15枝菌株制成1 mL菌悬液加入新鲜即食湿面条中,12 h后观察感官情况,对照组依然有面条的香味,颜色也无明显变化,实验组均出现面条变黏稠,易断,颜色变黄,且有明显的酸臭味,测得其菌落总数均超过国家标准105CFU/mL[8]。
2.3 腐败菌的初步鉴定
根据《常见细菌系统鉴定手册》[6]和《食品微生物实验室手册》[7],采取菌落观察、革兰氏染色、芽孢染色等染色方法,对实验中分离得到的菌株进行初步观察;通过硝酸盐还原、接触酶、氧化酶、葡萄糖、甘露醇、木糖发酵实验,V-P实验、水解明胶、水解淀粉、柠檬酸盐、丙酸盐、吲哚实验、耐盐性实验、耐热性等生化鉴定实验对实验中分离得到的菌株进行生化鉴定[11]。据初步鉴定结果,15株菌株可分为3类,A2、B3、C3、C5为一类,A3、A4、A5、B1、B4为一类,A1、B2、B5、C1、C2、C4为一类,以A1为代表类属地衣芽孢杆菌(Bacillus licheniformis),以A2为代表类属枯草芽孢杆菌(Bacillus subtilis),以A3为代表类属巨大芽孢杆菌(Bacillus megaterium)。其菌落形态特征,革兰氏染色特征,生化鉴定结果分别见图1、图2及表2。
由图1可知,A1菌落形态呈圆形,直径2~4 mm,边缘锯齿状,表面干燥,乳白色,不透明;A2菌落形态呈圆形,直径3~5 mm,边缘齿状,表面隆起黏稠,乳白色,不透明;A3菌落呈圆形,直径3~4 mm,边缘齿状,表面有皱褶,乳白色,不透明。
由图2可知,15种菌株均是革兰氏阳性菌,A1呈杆状,长链状,产芽孢,偏端生,椭圆形,孢囊不膨大;A2呈短杆状,链状,产芽孢,中生或偏端生,椭圆形或柱形,孢囊不膨大;A3呈杆状,产芽孢,偏中生,椭圆形,孢囊不膨大。根据《常见细菌鉴定手册》对产芽孢细菌间的鉴别,符合上述特征的有芽孢杆菌属、脂环酸芽孢杆菌属。

图1 腐败菌菌落形态Fig.1 Colonial morphology of spoilage organisms

图2 革兰氏染色结果Fig.2 Results of gram staining
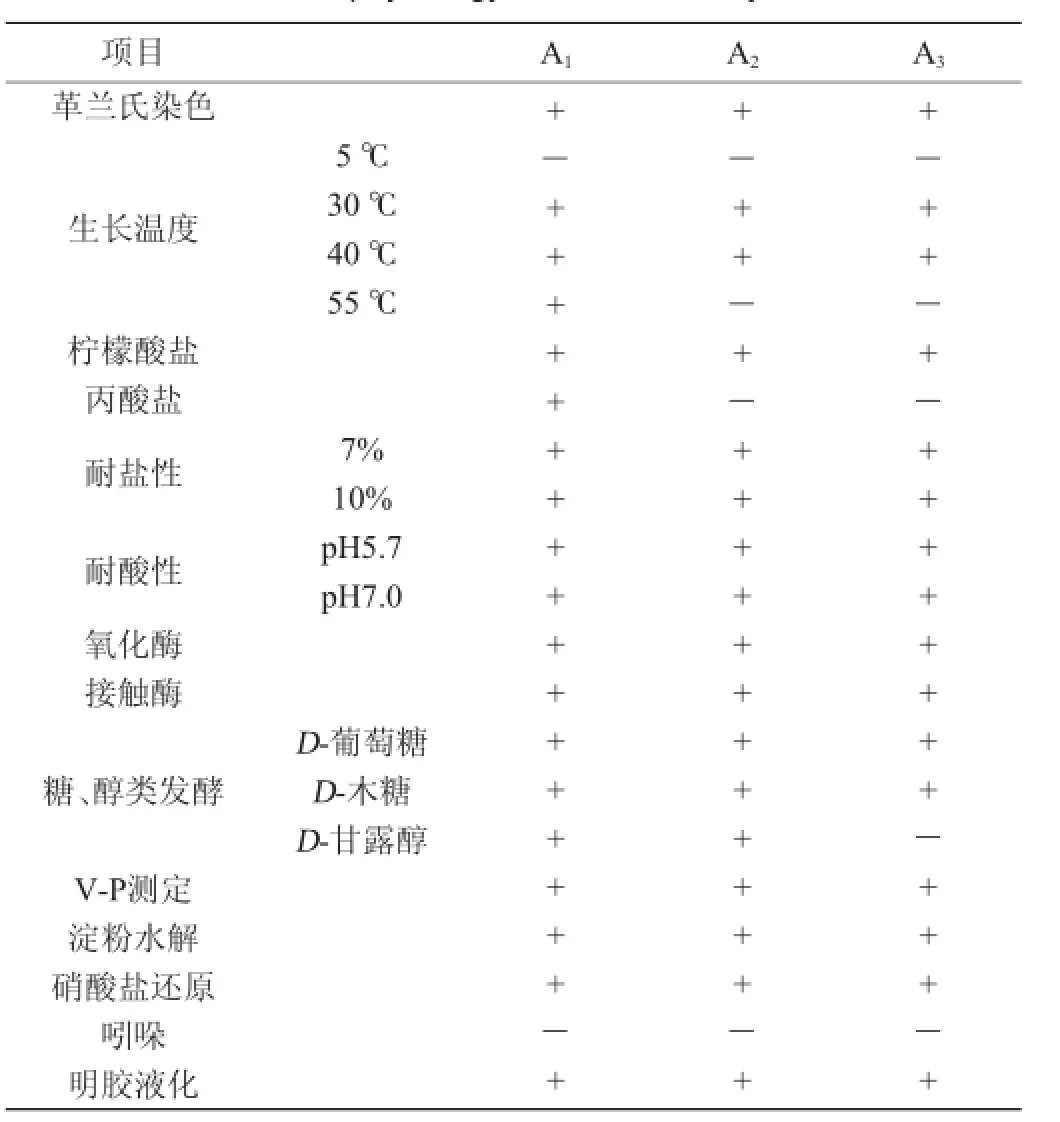
表2 生理生化鉴定结果Table 2 Results of physiology and biochemistry identification
由表2可知,接触酶为阳性、硝酸盐还原为阳性、能够发酵利用葡萄糖,根据《常见细菌鉴定手册》,《伯杰细菌手册》得出这15个菌株均属于芽孢杆菌属,结合剩余生化鉴定结果得出以A1为代表的一类为地衣芽孢杆菌(Bacillus licheniformis),以A2为代表的一类为枯草芽胞杆菌(Bacillus subtilis),以A3为代表的一类为巨大芽孢杆菌(Bacillus megaterium)。
3 结论
通过对即食湿面条中腐败微生物进行分离纯化,得到15种菌株,经过腐败验证实验证明15种菌株均是导致热制面腐败的微生物。经过革兰氏染色,生化鉴定,初步判定15种菌株分为三类,以A1为代表的A1、B2、B5、C1、C2、C4为地衣芽孢杆菌(Bacillus licheniformis),以A2为代表的A2、B3、C3、C5为枯草芽孢杆菌(Bacillus subtilis),以A3为代表的A3、A4、A5、B1、B4为巨大芽孢杆菌(Bacillus megaterium)。
目前国内对面条的保鲜研究方面面相对狭窄,主要集中研究酸处理和添加防腐剂对生鲜面条保鲜效果的影响。刘增贵[12]以面条的酸度、口感和保质期为指标,对酸液槽中酸液的酸度、酸洗时间、酸洗温度三个酸洗工艺参数进行最优化试验,得出了酸洗的比较理想的工艺参数。此外,叶银枝等[13]研究表明,在pH值为6.2,使用0.05%脱氢醋酸钠防腐防霉剂,结合使用3%乳酸钠抑菌剂一起加工生产出来的湿面条,在室温30℃能保鲜24 h。黄淑霞等[14]研究了防腐剂如山梨酸钾、尼泊金乙酯、柠檬酸等对湿生面条的保鲜作用,并得出采用复配的方法可使面条在30℃条件下保存5 d,4℃条件下保存22 d而不变质的结论。刘增贵[12]研究了二氧化氯与双氧水对湿生面条的保鲜研究。LEE J K等[15]就壳聚糖对生鲜湿面的防腐效果进行了研究。本研究对即食湿面条中腐败微生物进行分离纯化,得出地衣芽孢杆菌、枯草芽孢杆菌、巨大芽孢杆菌是主要优势腐败微生物,进一步为面条的保鲜提供针对性措施,例如在防腐剂的选择上,溶菌酶、乳酸链球菌素等天然防腐剂均对革兰氏阳性菌起到很好的杀菌效果,适宜运用到面条生产。
[1]蒋志红,吴莹.面条类食品的现状和发展[J].粮食与油脂,2003(S1):16-19.
[2]周其中.生鲜湿面保质保藏技术的研究[D].长沙:中南林业科技大学硕士论文,2009.
[3]黄斌,郑晓冬,王洪成.HACCP在出口保鲜湿面生产中的应用[J].粮油加工,2007(7):99-101.
[4]JENSEN N,HOCKING A D,MISKELLY D,et al.Microbiological safety of high moisture noodles:marketplace survey of noodles sold in Australia[J].Food Aust,2004,56(3):71-73.
[5]李昌文,刘延奇.即食湿面条的保鲜研究[J].粮食加工,2008(2):67-68. [6]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001.
[7]HARRIGAN W F.食品微生物实验室手册[M].北京:中国轻工业出版社,2004.
[8]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 4789.2—2010食品卫生微生物学检验菌落总数测定[S].北京:中国标准出版社,2010.
[9]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T4789.15—2010食品卫生微生物学检验霉菌和酵母菌计数[S].北京:中国标准出版社,2010.
[10]徐青,许喜林,王蔚瑜.凉茶中腐败微生物的分离纯化及初步鉴定的研究[J].食品科技,2012,37(11):31-34.
[11]王儒,许喜林,刘永琪,等.调味酱中腐败微生物的分离和鉴定的初步研究[J].中国酿造,2013,32(7):43-45.
[12]刘增贵.湿生面条的保鲜研究[D].无锡:江南大学硕士论文,2008.
[13]叶银枝,林金莺,王德生.湿面条的保鲜研究[J].中国食品添加剂,2002(5):4-7.
[14]黄淑霞,曾实,蔡静平,等.湿生面条保鲜的研究[J].郑州粮食学院学报,1997(2):15-19.
[15]LEE J K,LEE H J,PARK Y K.Praparation of noodle with laver powder and its characteristics[J].Korean Journal of Food Science and Technology,2000,32(2):298-305.
Separation and identification of spoilage microorganisms in instant wet noodles
XU Yuhui,XU Xilin*,XIN Shumin
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
To explore the major spoilage microorganisms in instant wet noodles,the methods of morphological identification and biochemical identification were used to separate,purify and identify the microorganisms that lead to spoilage in instant wet noodles.Result showed that the dominant microorganisms which leaded to the spoilage of noodles wereBacillus subtills,Bacillus licheniformisandBacillus megaterium.
instant wet noodles:spoilage microorganisms;separation:identification
TS255.1
A
0254-5071(2014)07-0068-04
10.11882/j.issn.0254-5071.2014.07.015
2014--
广东省农业攻关科技计划项目(2012B020311002)
许玉慧(1990-),女,硕士研究生,研究方向为食品微生物学。
*通讯作者:许喜林(1964-),男,副教授,博士,研究方向为食品质量控制。
