利用响应面分析法优化深绿木霉Tr16液体发酵产孢培养基研究
2020-06-08陈晨钱林于稳欠
陈晨 钱林 于稳欠

摘要 采用响应面分析法(RSAM)对深绿木霉(Trichoderma atroviride)菌株Tr16液体发酵产孢培养基进行优化。通过Plackett-Burman(PB)方法,先筛选出培养基中影响产孢量的3个主要因素:MgSO4、H8MoN2O4和酵母提取物,再运用“最陡爬坡路径法”和RSAM,确定主要因子之间的交互影响并筛选出最佳液体发酵培养基配方。结果表明,最佳培养基配方:葡萄糖5 g/L、KH2PO4 8 g/L、MgSO4 1.29 g/L、丙三醇10 mL/L、蔗糖10 g/L、H8MoN2O4 0.99 mL/L、酵母提取物4.83 g/L、可溶性淀粉5 g/L。经过3次平行测试,Tr16的平均孢子产量为6.19×108 CFU/mL,与预测最大孢子产量接近,比未優化的培养基孢子产量提高了70.8%。
关键词 响应面法;深绿木霉;产孢;优化
中图分类号 S476.1 文献标识码 A 文章编号 0517-6611(2020)10-0117-04
doi:10.3969/j.issn.0517-6611.2020.10.031
Abstract Response surface analysis method (RSAM) was used to optimize the liquid fermentation culture medium for spore production of Trichoderma atroviride strain Tr16. Through PlackettBurman method (PB), three main factors (MgSO4, H8MoN2O4 and yeast extract) affecting sporulation quantity in the medium were firstly screened out. Then, the steepest climbing path method (SCPM) and RSAM were used to determine the interaction among the main factors and the best formula of liquid fermentation medium was screened and determined. The results showed that the optimal formula of the medium was glucose 5 g/L, KH2PO4 8 g/L, MgSO4 1.29 g/L, glycerol 10 mL/L, sucrose 10 g/L, H8MoN2O4 0.99 mL/L, yeast extract 4.83 g/L, soluble starch 5 g/L. After three parallel tests, the average spore yield of Tr16 was 6.19×108CFU/mL, which was close to the predicted maximum spore yield and was 70.8% higher than that of the unoptimized medium.
Key words Response surface method (RSM);Trichoderma atroviride;Spore production;Optimization
早在20世纪30年代科研工作者就发现,木霉菌(Trichoderma spp.)对多种植物病原菌有拮抗作用[1]。作为一种生防菌,木霉菌的抗菌机制有占位竞争、产生抗生素、重寄生、诱导抗性等[2]。目前在世界范围内,商业化生产和应用的各种活体木霉菌生物农药已有300多种,在绿色、有机农业生产和现代农业可持续发展中,对多种植物病害的绿色防控起到了良好的助推作用[3]。随着现代生物技术的不断发展,在发酵设备和工艺上为生产优质的木霉菌孢子提供了一定的支撑[4],但如何通过液体发酵获得大量的木霉菌孢子,仍是制约木霉菌产业化生产的关键因素之一。
微生物发酵过程机理复杂,影响因素众多,对微生物发酵工艺进行优化显得尤为重要,已成为发酵水平的决定因素,其相关的研究也越来越多[5]。同时,许多试验技术和设计方法在微生物发酵工艺优化中得到应用。传统的优化试验方法有单因素法、正交设计法等,当考察的因子较多以及因素之间存在交互作用时,试验次数会大增,甚至试验结果不准确[6]。而很多其他方法即使减少了试验次数,却未能给出直观的图形,不能凭直觉观察其最优点。有的虽能找出最优值,但又难以直观地判别优化区域。由Bxo 和 Willsno 最早提出,后经 Hill 和 Htlnetr 进一步完善的响应曲面法(response surface method,RSM)在微生物发酵工艺优化研究中成功克服了传统方法的缺点,取得了良好效果[7]。然而我国在木霉菌发酵培养基优化的研究方面,目前主要采用单因素法和正交法。对深绿木霉液体发酵,以及利用RSAM优化深绿木霉液体发酵产孢培养基的研究目前鲜有报道。笔者采用RSAM,对深绿木霉产孢培养基进行了优化,使菌株Tr16在发酵液中的孢子产量提高了70.8%,为产业化生产深绿木霉提供了参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株。
深绿木霉(Trichoderma atroviride)菌株Tr16,由上海万力华生物科技有限公司从西瓜根际土壤中分离获得,并保藏。
1.1.2 供试培养基。
马铃薯葡萄糖琼脂培养基(PDA):200 g 去皮马铃薯开水煮沸 20 min,过滤,滤液中加入20 g葡萄糖,20 g琼脂粉,定容1 L,充分混匀,用1 L三角瓶分装,每瓶装500 mL,121 ℃灭菌20 min,冷却至50 ℃,无菌条件下倒入培养皿,凝固备用[8]。
液体发酵培养基:葡萄糖5 g/L、KH2PO42 g/L、MgSO4 1 g/L、丙三醇10 mL/L、蔗糖1 g/L、H8MoN2O4 0.5 mL/L、酵母提取物41 g/L、可溶性淀粉5 g/L。
H8MoN2O4母液配制:0.1 g/L H8MoN2O4·2H2O 的母液,4 ℃冰箱保存,使用时按照要求用量添加到培养基中。
1.1.3 供试试剂。
葡萄糖、KH2PO4、MgSO4、丙三醇、蔗糖、H8MoN2O4、酵母提取物、可溶性淀粉等试剂均为分析纯(上海润捷化学试剂有限公司)。
1.1.4 供试设备。
显微镜(Olympus BX51),摇床(SY2020天呈设备有限公司),天平(OHAUS CP64)。
1.2 试验方法
(1)Tr16 种子发酵液制备。将纯化的 Tr16 菌块转移至 PDA 平板上培养72 h(28 ℃),在无菌条件下刮取长在平板上的分生孢子,用无菌水配成含5×107CFU/mL分生孢子悬浮液备用。
(2)摇瓶测试培养条件。设定摇床的温度为30 ℃,转速为200 r/min,装液量为110 mL/500 mL摇瓶,接种量为2%(V/V),每个处理3个重复,培养144 h。
(3)发酵液孢子含量测定。用血球计数板法。
木霉菌孢子个数(CFU/mL)=80个小方格细胞总数/80×400×10 000×稀释倍数
1.3 试验设计
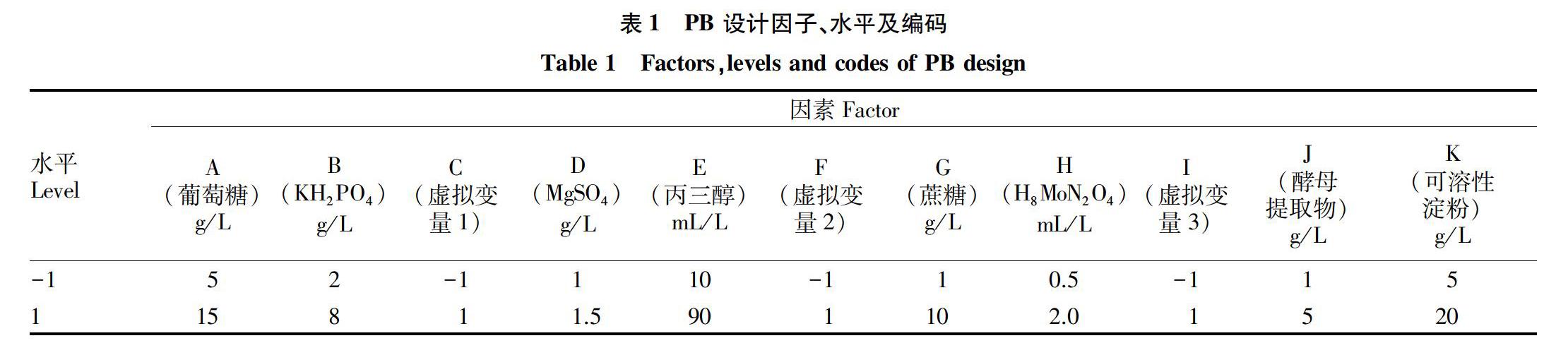
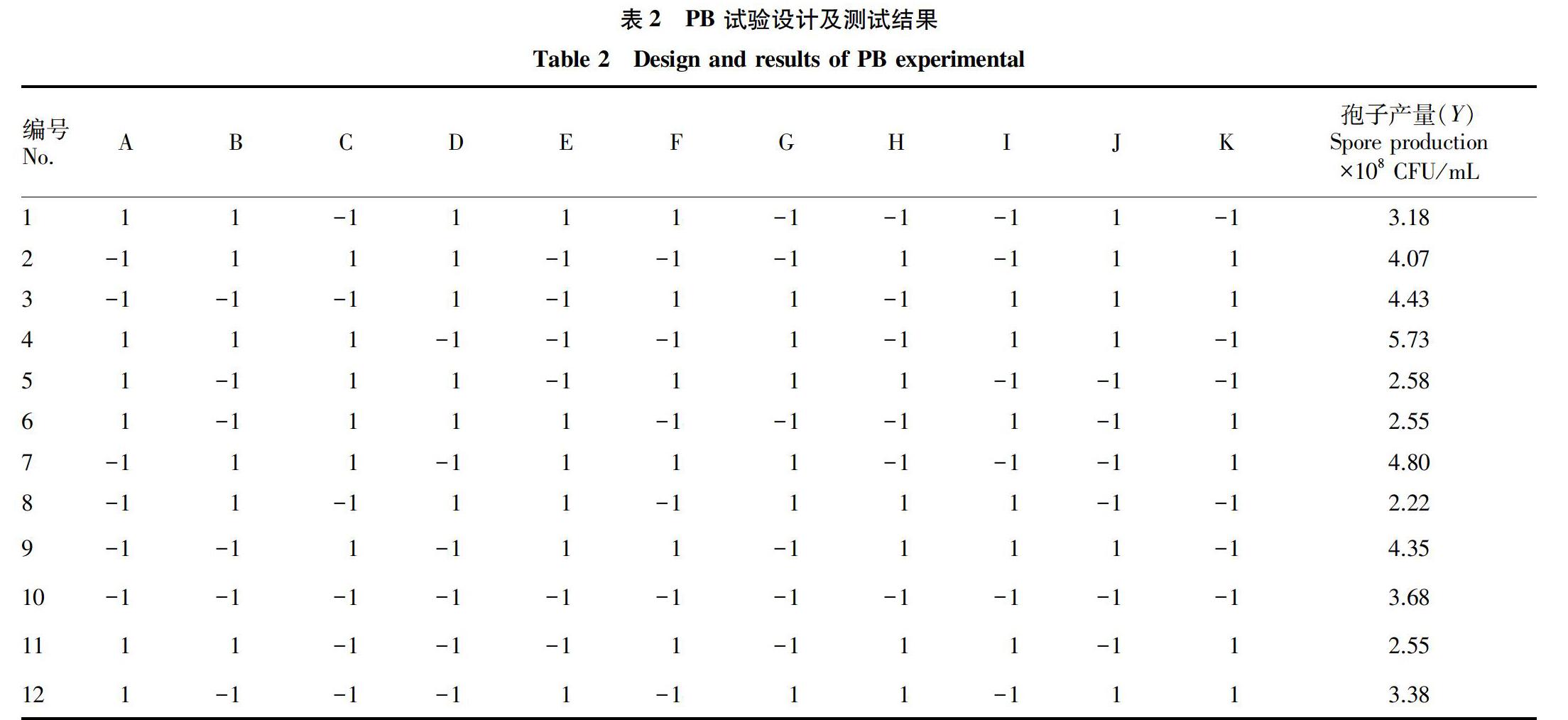
(1)根据 Plackett- Burman(PB)的设计原理,选取11个变量因素,分别为A(葡萄糖)、B(KH2PO4)、D(MgSO4)、E(丙三醇)、G(蔗糖)、H(H8MoN2O4)、J(酵母提取物)、K(可溶性淀粉),以及3个虚拟变量:C、F、I(以便估算误差),共进行12次发酵测试,响应值为发酵液体的产孢量。PB 测试设计见表1。采用 Design- Expert 8.0.6 软件,对表2中12次发酵测试的孢子产量进行回归分析,得到各因子对孢子产量的影响偏差回归系数,以及各因子对孢子产量影响的显著差异性。
(2)最陡爬坡法(SCPM)试验。根据 PB 试验得到的 3个正或负显著影响因素效应值,设定 SCPM 试验的正负步长、爬坡方向,确定3个显著影响因素的最佳值区。
(3)Box- Behnken(BB)设计。依据 PB 试验原理和最陡爬坡试验结果,设计一个对菌株Tr16发酵培养基3因素3水平的 RSAM试验。使用软件Design-Expert 8.0.6 构建试验设计并对试验结果进行分析。
(4)验证试验。用所得到的最佳培养条件进行3次平行发酵试验,得到平均值后与理论值进行比较,以验证测试的模型是否可靠,进而得出最终优化结果[9]。
2 结果与分析
2.1 PB 设计测试结果
通过 PB 设计,其测试结果(表2、3)表明,酵母提取物、MgSO4、H8MoN2O4 对孢子产量的影响最大,葡萄糖、KH2PO4、丙三醇、蔗糖、可溶性淀粉对孢子产量无显著影响,其中酵母提取物的影响为正效应,MgSO4、H8MoN2O4的影响为负效应。
2.2 SCPM 测试结果
根据PB测试结果,明确了酵母提取物、MgSO4、H8MoN2O4 是发酵培养基中对孢子产量影响最大的3个因素。再根据 SCPM 原理,设定这3个因素的爬坡方向及步长测试,其设计和测试结果见表4。由表4可知,测试2和测试3的孢子产量变化不大,说明此3个因素在这2个测试中的用量浓度值,已很接近最佳用量值。因此,该试验选择酵母提取物 5 g/L、MgSO4 1.3 g/L、H8MoN2O4 1 mL/L为中心点,展开响应面对发酵培养基的优化。
2.3 RSAM 对发酵培养基优化的测试结果
以酵母提取物、MgSO4、H8MoN2O4 3个因素为自变量,BB 试验设计及结果见表5。
利用 Design-Expert 8.0.6 软件对回归模型进行响应面分析,得到各响应面三维图和等高线图(图1~3)。
从图1~3可以看出,随着培养基中酵母提取物、MgSO4和H8MoN2O4浓度的增加,孢子含量先增加后下降,表明两因素间交互作用明显。根据回归方程式的求解,得到响应面模型极值点,即酵母提取物、MgSO4、H8MoN2O4最佳使用浓度为4.83 g/L、1.29 g/L、0.99 mL/L时,按此用量配制的发酵液培养基,能使菌株Tr16的孢子产量达6.19× 108 CFU/mL最大值。
2.4 回归模型结果试验验证
根据响应面分析法得到的最优发酵培养基培养配方,进行了3次平行发酵测试,进一步对响应面模型进行验证。3次测试的孢子产量分别为6.17×108、6.36×108、6.09×108 CFU/mL,平均孢子产量为6.21×108 CFU/mL。这个数值与理论值6.19×108 CFU/mL非常接近。2个数值的相对吻合,證明了响应面模型的可靠性。优化后的培养基:葡萄糖 5 g/L、KH2PO4 8 g/L、MgSO4 1.29 g/L、丙三醇 10 mL/L、蔗糖 10 g/L、H8MoN2O4 0.99 mL/L、酵母提取物 4.83 g/L、可溶性淀粉 5 g/L。
3 结论与讨论
用 RSAM 法对发酵培养条件进行优化,能够精准地判断和评价各因素之间的交互作用,从而获得一个最佳组合。袁辉林[10]对一株植物促生菌的培养基进行了优化,首先利用 PB 设计对影响 SZ7-1 生长的11 个营养因素进行评价,并筛选出显著影响因子:玉米糖浆、酵母膏和 K2HPO4;其次用最陡爬坡试验逼近以上 3 因素最优水平;最后采用RSM 法对 3 个显著因素的最佳水平范围进行研究,得到的最佳浓度分别为玉米浆28 g/L、酵母膏 14 g/L 和 K2HPO4 2.2 g/L。该测试结果与以上研究结果相似,通过PB 设计试验筛选出酵母提取物、MgSO4、H8MoN2O4对孢子含量贡献较大,其中酵母提取物对孢子含量的影响最为明显,然后利用 BB 设计建立了3个主要因素与响应值之间的二次回归模型,并由此确定了木霉菌Tr16产孢的最佳配方为酵母提取物、MgSO4、H8MoN2O4,最佳浓度为4.83 g/L、1.29 g/L、0.99 mL/L。
在优化过程中,RSAM 可以单独针对微生物发酵的培养条件进行优化,也可综合培养基组分和培养条件一起进行考察。 目前,利用该方法对不同微生物的发酵条件进行优化,均不同程度地提高目标产物的产量[11]。Lotfy等[12]采用 BB 设计,用一种新分离的黑曲霉进行发酵,生产柠檬酸。在对该黑曲霉培养基进行优化的同时,也对培养条件进行了优化。结果发现,当孢子浓度为 108 CFU/mL,pH为4.0,通气量为 6 500 mL/min,温度为 31.5 ℃时,柠檬酸的生产率可达 87.81%,是优化前的14倍。该测试结果与以上研究结果说明,在微生物培养基的优化工作中,PB 设计、最陡爬坡试验和响应面分析法结合是一种逻辑性强、效果良好的过程优化过程。木霉菌 Tr16 经过 RSAM 测试,孢子含量明显提高,达6.21×108 CFU/mL,与理论值相近,比未优化的培养基孢子产量提高了70.8%。该结果将为木霉菌 Tr16 液体发酵的放大和工业化生产提供了可参考数据。
参考文献
[1] 惠有为,孙勇,潘亚妮,等.木霉在植物真菌病害防治上的作用[J].西北农业学报,2003,12(3):96-99.
[2] 台莲梅,高俊峰,张亚玲,等.拮抗长枝木霉T115D菌株发酵条件[J].江苏农业科学,2013,41(10):333-334.
[3] WEINDLING R.Studies on lethal principle effective in the parasitic action of Trichoderma lignorum in Rhizoctinia solani and other soil fungi[J].Phytopathology,1934,24:1153-1179.
[4] 高雪丽,吴坚平,徐刚,等.侧钩木霉的分离、鉴定及产孢条件优化[J].中国生物工程杂志,2014,34(2):84-92.
[5] BOSCOLO P R S,MENOSSI M,JORGE R A.Aluminuminduced oxidative stress in maize[J].Phytochemistry,2003,62(2):181-189.
[6] CHO U H,PARK J O.Mercuryinduced oxidative stress in tomato seedlings[J].Plant science,2000,156(1):1-9.
[7] SAMANTARY S.Biochemical responses of Crtolerant and Cr-sensitive mung bean cultivars grown on varying levels of chromium[J].Chemosphere,2002,47(10):1065-1072.
[8] 陳晨,旷文丰,陈娟,等.钙离子和蓝光对深绿木霉Tr775在液体发酵过程中分生孢子产量的影响[J].化学与生物工程,2018,35(1):36-40.
[9] 梁昌聪,郭立佳,刘磊,等.响应面法优化解淀粉芽孢杆菌C101发酵培养基[J].生物技术通报,2014(8):169-174.
[10] 袁辉林.植物促生菌培养优化及作用机理研究[D].北京:中国林业科学研究院,2011.
[11] 袁辉林,康丽华,马海滨.响应曲面法及其在微生物发酵工艺优化中的应用[J].安徽农业科学,2011,39(16):9498-9500,9502.
[12] LOTFY W A,GHANEM K M,ELHELOW E R.Citric acid production by a novel Aspergillus niger isolate:II.Optimization of process parameters through statistical experimental designs[J].Bioresource technology,2007,98:3470-3477.
