酿酒酵母的连续复合诱变及其突变株的快速筛选
2014-02-18吴新世董晓惠
吴新世,董晓惠,李 羚
(天津理工大学化学化工学院,天津300384)
筛选高产乙醇的酿酒酵母对于人类开发新能源具有重要意义.高产酿酒酵母可通过自然突变、菌种诱变或遗传改造等多种方式获得.菌种诱变是目前相对成熟的技术手段,它不需要十分了解菌株的遗传背景,且定向性好,突变得率较高.自从应用微生物领域开展菌种诱变以来,目的突变株的诱变和筛选一直是育种工作者重点攻克的方向之一.关于菌种诱变特别是酵母菌的诱变选育,已有大量研究报道[1-11],多种诱变筛选方法构成了微生物诱变育种的方法体系.目前,酵母菌突变株的诱变方法中,大多为单因素或双因素不连续诱变,诱变效果也不相同.虽然也有双因素连续诱变的报道[2],但过程相对简单,未形成完整的连续诱变方法体系.在诱变后的筛选过程中,为便于目的突变株的检出,常规筛选中需要人为地使菌株携带上某种筛选标记,但这种处理可能会对目的性状产生负面影响[12].因此,在不损伤亲株遗传背景的前提下检出目的菌株,对于突变株优良性状的获得以及防止菌株性能衰退等都具有重要意义.
本课题组利用己烯雌酚(diethylstilbestrol,DES)和UV对工业用酿酒酵母进行连续诱变,之后采用改进的发酵小管集气法筛选目的突变株.该连续诱变方法相对完整,筛选方法快速而且对亲株遗传背景没有损伤.
1 材料与方法
1.1 材料与仪器
出发菌株为高产乙醇的工业用酿酒酵母QD(Saccharomyces cerevisiae),由本实验室保存.
菌种诱变所用培养基为YEPD培养基;高渗再生培养基,即YEPD固体培养基中加入0.6mol/L甘露醇;突变株筛选所用培养基为YEPD培养基和甘蔗汁发酵培养基[13].
工具酶为蜗牛酶和纤维素酶,由北京鼎国生物科技有限公司生产.使用前用高渗稳定液配制成质量分数分别为1.5%的蜗牛酶和0.5%的纤维素酶混合酶液,现配现用,以0.22μm的微孔滤膜过滤除菌.
磷酸盐缓冲液:将7.9mL的Na2HPO4溶液(浓度为1.0mol/L)与92.1mL的NaH2PO4溶液(浓度为1.0mol/L)混合,得到浓度为0.1mol/L、pH 5.8的磷酸盐缓冲液.115℃灭菌20min.
高渗稳定液:上述磷酸盐缓冲液中加入甘露醇,使其最终浓度为0.6mol/L.115℃灭菌20min.
预处理剂:含0.05mol/L的EDTA和0.5mol/L的β-巯基乙醇的溶液,以0.22μm微孔滤膜过滤除菌.
仪器:SBA-40C型生物传感分析仪,由山东省科学院生产;DES,分析纯级,由天津市光复试剂公司生产;葡萄糖,由天津市江天化工科技有限公司生产.
1.2 实验方法
1.2.1 连续复合诱变
原生质体的制备与再生参照文献 [14-15].预处理前,为了减少细胞已吸收的营养物质对预处理及诱变效果的干扰,将培养至对数生长期的新鲜菌液离心后加入同体积无菌水,饥饿培养2h,再以生理盐水洗涤[16].之后进行预处理及原生质体的制备.
原生质体的连续复合诱变包括2个步骤:(1)单因素诱变;(2)双因素连续复合诱变.
(1)单因素诱变:将上述制得的原生质体进行DES诱变,方法参照文献[7-8].按常规方法绘制诱变曲线,判定本实验体系下DES诱变的致死率、最大正向突变率及其对应时间点.
(2)双因素连续复合诱变:上述诱变条件不变,选取DES诱变最大正向突变率对应的时间点,对酿酒酵母进行DES诱变.之后不进行任何处理,立即对上述DES诱变后的酵母菌培养物再次进行UV诱变,UV 诱变的时间分别设定为 0、10、20、30、40、50、60、70、80、90s.诱变后的培养物以高渗稳定液稀释到细胞浓度为1×10-3/L,涂高渗再生培养基平板,黑暗处培养48h.计算原生质体的致死率.挑取单菌落按以下方式进行高产菌株的筛选及正向突变率的计算.
绘制酵母菌突变株的生长曲线:将连续诱变获得的单菌突变株在最佳培养条件下(培养温度为30℃,pH值自然,转速为120r/min,YEPD培养基)转液体培养.以培养时间为横坐标、以菌液的吸光度值A600为纵坐标,每隔2h取样一次,测定溶液的吸光度值,绘制突变株培养液的吸光度值随培养时间变化的生长曲线.
试管液体培养基的配制及灭菌:配制YEPD培养基1000mL,分装入100个试管.取其中的50个试管,倒置放入充满YEPD液体培养基的发酵小管,将装有发酵小管的试管液体培养基(用a表示)和另外50个未装发酵小管的试管液体培养基(用b表示)共同在115℃、0.75MPa的湿热蒸汽下灭菌20min.
接种与培养:向未装发酵小管的试管液体培养基b中接入酵母菌突变株菌液,通入无菌空气条件下,30℃、150r/min振荡培养9h至对数生长末期,取出待用,记为c.
乙醇发酵:无菌操作.将a中的发酵小管从液体中取出,迅速倒置放入培养至对数生长期末期的培养液c中,立即向试管液体中通入无菌氮气,小心避免气体进入发酵小管,待完全排出液体中的氧气后密封试管口.将装有发酵小管的试管培养物c继续于30℃下静置培养至一个培养周期(包括不放发酵小管的菌体生长阶段、放入发酵小管后菌体发酵葡萄糖产乙醇和CO2的阶段).
乙醇高产菌株初筛:将上述完成一个培养周期的培养液取出,观察试管液体中发酵小管内的气泡产生及排出液体情况,根据发酵小管内气柱大小初步判断酵母菌产乙醇能力.气柱越大,产乙醇越多,从而快速筛选出高产乙醇的突变株.
产乙醇能力测定:将上述初筛得到的高产菌株接种甘蔗汁发酵培养基[13]进行产乙醇发酵.取样,适当稀释,使用SBA-40C型生物传感分析仪测定乙醇产量.
正向突变率计算:根据突变株的乙醇产量结果,计算连续诱变的正向突变率,公式如下:

1.2.2 常规复合诱变及筛选过程
原生质体的制备及再生参照文献[9-10].
原生质体的常规复合诱变及筛选:方法参照文献[2]和[8].诱变因子分别为DES和UV.
2 结果与分析
2.1 酿酒酵母原生质体的选择
酿酒酵母原生质体的生长情况如表1所示.

表1 原生质体的生长及再生率Tab.1 Forming rate and regeneration rate of protoplast
由表1可以看出,在对数生长期的中期,原生质体的形成率和再生率都比稳定期时的高,所以制备原生质体应选择处于对数生长期的新鲜培养物.
2.2 酿酒酵母连续诱变
2.2.1 DES诱变
对DES诱变应用常规方法计算致死率和正向突变率,绘制诱变曲线,结果如图1所示.
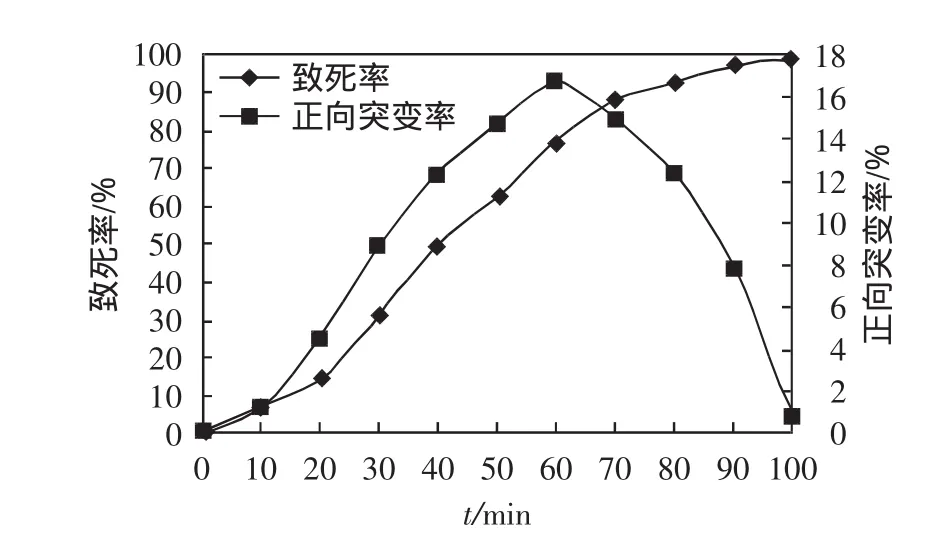
图1 DES诱变曲线Fig.1 Curve of DES mutagenesis
DES诱变结果表明,当诱变时间为100min时,酿酒酵母的致死率接近100%;当诱变时间为60min时,正向突变率达到最大值17.4%,此时致死率低于80%.
DES诱变的目的是求得最大正向突变率对应的时间点,为连续复合诱变提供参数依据.
2.2.2 连续复合诱变
连续复合诱变中,依据以上的实验参数,首先对酿酒酵母进行DES诱变,诱变时间选为60min.之后立即对DES诱变后的菌液进行UV诱变,诱变时间分别设定为 0、10、20、30、40、50、60、70、80、90s.
连续诱变后的菌液进行高产突变株的筛选,以诱变时间50s为例.
实验中需要绘制出每一个酵母菌突变株的生长曲线,这里仅绘出一个突变株mut112的生长曲线,如图2所示.由图2可知,菌株在既定培养条件下的延迟期为0~2h,对数生长期为2~10h,培养10h以后菌株进入稳定期.实验分析发现,其他突变株的生长曲线与mut112相同.
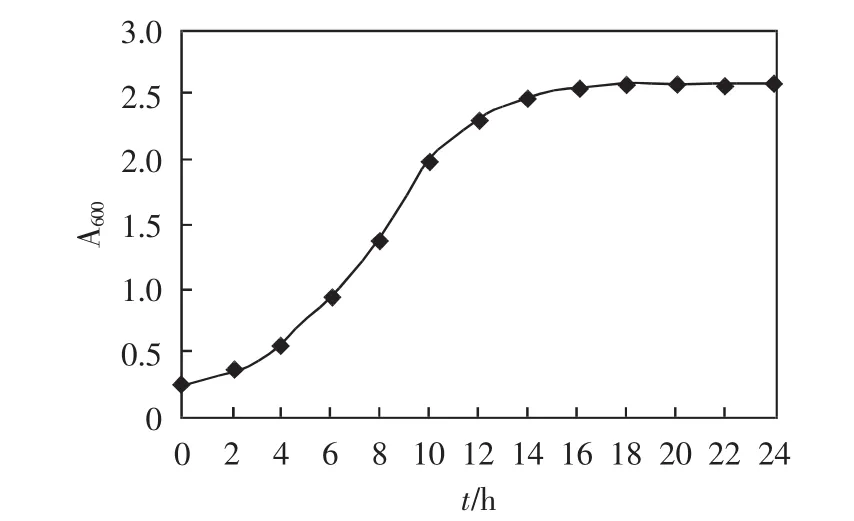
图2 突变株mut112的生长曲线Fig.2 Growth curve of mutant mut112
待各突变株培养至一个周期后,取出试管液体培养物,观察发酵小管内液体的排空情况.以原始菌株的发酵小管内气柱大小为参考,比较各突变株发酵小管中产气量大小,初筛得到30株产气量大于原始菌株的突变株,包括 mut3、mut24、mut37、mut56、mut89、mut105、mut112等.发酵小管内空气柱体积越大,里面的液体被排出越多,酵母菌产CO2越多,对应的乙醇产量就越高.表2列出了产气明显大于原始菌株的7株突变株.在筛到的159个突变株中,仅有30个菌株产气量大于原始菌株,其余均小于原始菌株或不产气.根据酵母菌的代谢特性,可利用发酵小管集气法初步定性表征酵母菌产CO2的能力,进而间接表征酵母菌产乙醇的能力.但是在利用这种方式考察酵母菌产乙醇能力时,不能在接入菌种后立即放入发酵小管,因为酵母菌在培养前期的生长繁殖时期进行有氧代谢,将葡萄糖彻底氧化获得能量的同时产生CO2,而且产CO2的效率较高.如果过早放入发酵小管,不容易区分小管内的CO2究竟通过有氧代谢还是无氧代谢产生,或前者与后者的比例有多大.如果把这些CO2不加区分都当成葡萄糖发酵产生的,很容易得到假的高产菌株.本实验对发酵小管集气法进行改进,可将目的突变株初步迅速地筛选出来.为防止酵母菌利用YEPD培养基中的酵母粉或蛋白胨作碳源进行产乙醇发酵而产生干扰,将上述初筛得到的30株正向突变株重新接种甘蔗汁发酵培养基[13]进行产乙醇发酵分析.乙醇标准溶液的质量浓度为40mg/100mL,发酵原液稀释400倍后,各个菌株的乙醇含量测得值如表2所示.
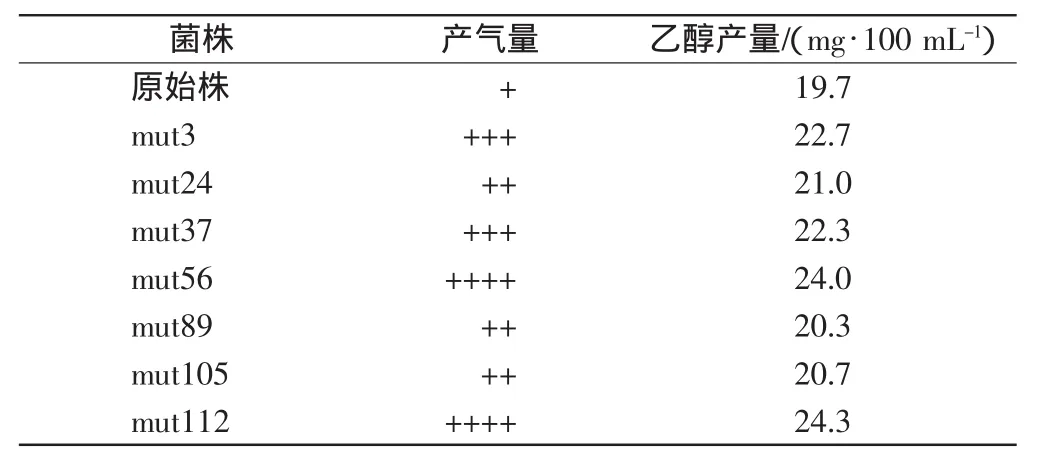
表2 突变株的产气能力Tab.2 Respective aerogenesis capacity of some mutants
由表2可以看出,mut3、mut56和mut112的乙醇产量相对较高,其中mut112的乙醇产量为9720mg/100mL(400×24.3 mg/100mL),比原始菌株的乙醇产量 7880mg/100mL(400×19.7mg/100mL)高出约23.4%.该突变株经传代16次以上,实验证明无菌种性能衰退现象.实验结果具有较好的重复性和稳定性,表明应用本方案可以快速检测出乙醇产量高的突变株.
据此可计算出经50s诱变后的正向突变率为18.9%.
连续复合诱变中其他时间点的突变株筛选及其正向突变率计算与50s时的相同.得到各个时间点对应的正向突变率,如表3所示.
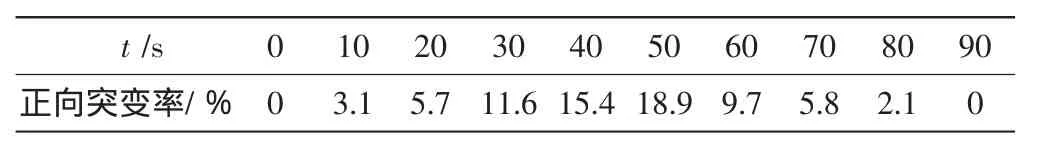
表3 不同诱变时间下连续复合诱变的正向突变率Tab.3 Positive mutation rates of consecutively combined mutagenesis in different mutation periods
根据以上计算结果,结合致死率绘制酵母菌的连续复合诱变曲线,如图3所示.
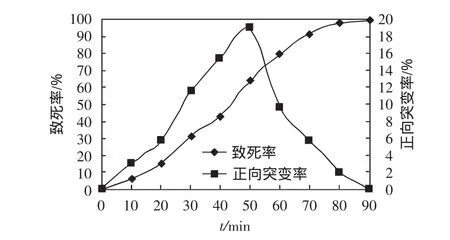
图3 连续复合诱变曲线Fig.3 Curve of consecutively combined mutagenesis
由图3可知,本实验采用双因素连续复合诱变的正向突变率最大值为18.9%,出现在50s,显示出该诱变方法具有较高的正诱变趋势.然而在连续诱变中,酵母菌的死亡速率大大加快,到90s时死亡率已接近100%,说明在DES和UV的连续作用下,大部分菌株的细胞物质被严重破坏,导致细胞无法正常代谢而死亡.
2.3 常规复合诱变
常规复合诱变中,DES诱变步骤与连续复合诱变相同,诱变曲线见图1.对DES诱变中筛选到的突变株再次进行UV诱变.结果如图4所示.
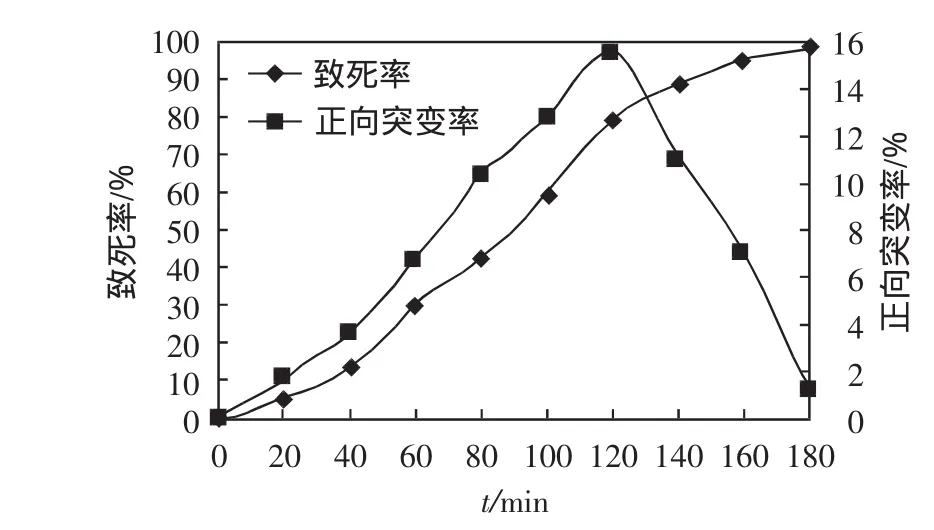
图4 UV诱变曲线Fig.4 Curve of UV mutagenesis
由图4可知,当UV诱变时间达到180s时,酿酒酵母的死亡率接近100%.此次诱变的正向突变率最大值为15.6%,诱变时间为120s.从UV诱变筛选到的菌株中,乙醇产量最高为9170mg/100mL,低于连续诱变筛选到的菌株产量(9720mg/100mL).
3 讨论与结论
本实验对酿酒酵母采用连续复合诱变方法,得到酵母菌的最大正向突变率为18.9%,较常规复合诱变提高了21.2%,实验数据具有较好的重复性和稳定性,初步证明了该诱变方法可行.同时,通过连续复合诱变筛选到一株高产菌株,其乙醇产量为9720mg/100mL,比原始菌株提高了23.4%,比常规复合诱变得到的突变株产量高出6.0%,菌株性能稳定,连续传代16代以上未出现菌株性能退化现象.
在突变株的筛选上,本实验在已有研究基础[3,13]上加以改进,分析酵母菌不同生理时期的生长特点,适时放置发酵小管,并通过控制发酵液中的溶氧量,保证发酵小管内的气体绝大部分通过葡萄糖发酵而产生.根据发酵小管内的产气量,初步、快速地推断出哪些突变株为高产菌株.再对这些突变株进行产乙醇能力分析.该方法排除了葡萄糖有氧氧化阶段生成CO2对筛选目的突变株的干扰,可一次淘汰更多的负向突变株,使目的突变株的筛选工作量大大减轻并节省了时间.应用本筛选方法很容易排除初筛中的假高产菌株.
关于突变株的筛选方法,国内外已有很多研究报道[1-12],也提出了许多不同思路.这些思路减轻了一些研究任务,目的和方向性也更明确,但工作量仍然繁重.有研究者为减轻工作量而能够快速筛选出目的突变株,人为地使菌株带上某种遗传标记.然而这种人为的遗传标记常常会损伤亲株的遗传背景,使目的突变株的优良性状弱化[12].本筛选方法在不损伤遗传背景的前提下对用发酵小管筛选高产菌株方法加以改进,是一种科学合理、逻辑严密的快速筛选方法.酵母菌突变株的筛选方法不局限于某一种,以产量性状为考察指标的突变株筛选最终要以目的产物的产量为考察依据,同时可辅以其他筛选方法[16],如底物葡萄糖的消耗量、CO2产量等.
[1] 章银良,雄卫东,张露,等.胁迫条件下酿酒酵母积累海藻糖的发酵研究[J].郑州轻工业学院学报:自然科学版,2003,18(2):50-52.
[2] 申乃坤,王青艳,秦艳,等.原生质体复合诱变选育耐高温高产乙醇酵母菌株[J].酿酒科技,2011,203(5):23-26.
[3] 田丰伟,程传荣,袁维涵,等.原生质体诱变选育ε-聚赖氨酸高产菌株[J].微生物学通报,2010,37(10):1457-1461.
[4] 曾庆梅,李志强,司文攻,等.紫外-微波复合诱变选育高产酿酒酵母菌株[J].微波学报,2010,8(S2):329-332.
[5]KUCSERA J,PFEIFFER I,FERENCZY L.A novel method for hybridization of Saccharomyces species without genetic markers[J].Canadian Journal of Microbiology,1998,44(10):956-964.
[6] HE X,HUAI W,TIE C,et al.Breeding of high ergosterol-producing yeast strains[J].Journal of Industrial Microbiology and Biotechnology,2000,25(1):39-44.
[7]贾学杰,王雅琴,李亮.复合诱变和抗性筛选高产谷胱甘肽酵母菌株[J].中国医药工业杂志,2005,36(10):604-607.
[8] 封晓霞,王雅琴.复合诱变和原生质体融合选育S-腺苷甲硫酿酒酵母高产菌株[J].北京化工大学学报:自然科学版,2011,38(6):87-92.
[9]SIPICZKI M,FERENCZY L.Protoplast fusion of Schizosaccharomyces pombe auxotrophic mutants of identical mating-type[J].Molecular and General Genetics,1977,151(1):77-81.
[10]邱秀文,吴晓玉,郭晓燕,等.啤酒酵母菌种改良方法[J].食品研究与开发,2012,33(7):169-173.
[11]叶世超,薛婷,王晓斐,等.酿酒酵母耐高温提高技术的研究进展[J].中国农学通报,2013,29(21):126-130.
[12]何培彦.酿酒酵母亲株无损伤融合子的构建和RAPD鉴定[D].杭州:浙江大学,2006.
[13]王晓斐.能源甘蔗汁高温酒精发酵酵母菌种的选育[D].福州:福建师范大学,2009.
[14]王明兹,施巧琴,周晓兰,等.提高酵母菌原生质体制备与再生的方法研究[J].微生物学杂志,2005,25(3):10-13.
[15]曹萌,闫飞,李洋,等.原生质体制备过程中各因素对酵母活力影响的研究[J].首都师范大学学报:自然科学版,2011,32(2):39-40.
[16]张克旭,陈宁,张蓓,等.代谢控制发酵[M].北京:中国轻工业出版社,2007:74.
