两个水稻叶片反向卷曲突变体的表型及遗传分析
2014-02-18苏余燕宋远丽栾维江
申 奥,苏余燕,宋远丽,栾维江
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
在水稻株型指标中,叶片的形态,特别是上位3片功能叶的形态直接影响群体的叶面积指数和受光效率,从而影响产量.早在20世纪70年代,松岛省三等[1]就提出了“理想稻”概念,其中重要的一点即为叶片直立,众多的株型研究也反复论证了叶片直立(较小的叶基角)的重要性[2].能够影响叶片直立的重要因素之一就是叶片的卷曲度,在叶片卷曲的水稻中,上位3片叶在开花期挺直,叶基角减小,便于叶片正反面受光以及减少对植株下部的遮光,提高了群体中下层叶片的光合作用[3].叶片适度卷曲之后还可以适当增加水稻的播插密度,在确保通风度的条件下,获得最佳的叶面积指数,通风度可以影响植株的抗病性.由于水稻叶片卷曲在农业生产实践中的重要作用,因此科学工作者密切关注卷叶性状[4-5],希望能利用这一性状改良水稻品种.
叶片卷曲是植物应对自然界中逆境刺激的一种反应,由叶片细胞膨压降低所引起,是内部水势状况和渗透调节结果的外部形态表现[6].环境因素方面,干旱胁迫是造成植物叶片卷曲的主要因素,植物通过叶片卷曲,改变叶片的电导率和有效叶面积,减少其拦截的辐射量,从而降低蒸腾作用,有效防止水分损失[7].另外,Price等[8]研究认为叶片内泡状细胞的肿胀减弱也可能引起叶片卷曲.
水稻中存在丰富的可稳定遗传的卷叶种质资源.如Khush等[9]发现了6个水稻卷叶突变体,其中,rl1、rl2、rl3 突变体内卷成圆柱状,而 rl4、rl5、rl6(t)突变体内卷成半圆柱状,这6个基因分别定位在水稻1、4、12、1、3 和 7号染色体上.近年来,由于不同突变体库的创建,又获得了一些水稻卷叶突变体资源.如沈革志等[10]利用T-DNA插入法获得了1个叶片向近轴面卷曲的突变体Rl-A2,遗传分析表明该突变体受1个显性单基因控制;Zhang等[11]用EMS诱变处理获得卷叶突变体sll1,并把该基因定位在水稻第9号染色体的长臂.有些卷叶突变体的性状在不同发育时期有所变化,如Luo等[12]发现了1个卷叶突变体在苗期叶片卷曲为圆柱状,而到抽穗期则变为微卷状态,遗传分析表明其受1个隐性基因控制.有些卷叶突变体仅向单侧卷曲,如余东等[13]用γ射线诱变方法获得1个叶片近轴面单侧右向卷曲突变体url1(t),并把该突变体基因定位在水稻1号染色体上.丛云飞等[14]用化学诱变方法获得1个单侧叶片向近轴面卷曲的突变体url2(t).最近,王德仲等[15]从EMS突变体库中发现1个水稻多突变性状卷叶突变体nrl2(t),该突变体叶片细长且卷曲,茎杆细,并且突变体早抽穗,遗传分析表明该突变体受1对隐性基因控制,并将该基因定位于水稻第3染色体上.另外,关于水稻叶片卷曲的分子机理,近年来也有一些研究[16-17].
该文对水稻Ac/Ds转座子插入突变体库中的2个叶片反向卷曲突变体的表型及组织形态进行了研究,以此揭示水稻叶片卷曲的形态建成.
1 材料与方法
1.1 材料
野生型日本晴(Oryza sativa L.ssp.Japonica cv.Nipponbare),用WT表示;外卷突变体是叶片向叶远轴面(abaxial axis),即背向茎的一面卷曲的突变体,用Ab-M表示;内卷突变体是叶片向叶近轴面(adaxial axis),即面向茎的一面卷曲的突变体,用Ad-M表示.内卷和外卷突变体均来源于水稻Ac/Ds转座子插入突变体库,所有材料种植于天津市农业科学研究院水稻研究所试验田.
1.2 石蜡切片
取野生型及内卷和外卷突变体处于相同生长时期植株的新鲜、健壮剑叶,用刀片切成小段后,首先经FAA固定液固定2h以上,用体积分数为70%的酒精水溶液浸洗1~2次后,用梯度浓度酒精逐级脱水.之后,用梯度浓度的二甲苯酒精溶液进一步透明处理直至材料透明,完成后将其进行浸蜡和包埋,待石蜡凝固后用旋转切片机进行切片.将切好的蜡片粘在载玻片上,展平,用甲苯胺蓝对平展的蜡片进行染色.染色完成后再将切片放入二甲苯中处理5~8min,封片后置于光学显微镜下观察照相.
1.3 纤维素含量测定
纤维素的提取参照文献[18].取适量纤维素称重后加入质量分数为67%的H2SO4,室温混匀1h.加入预冷的质量分数为0.2%的蒽酮试剂,混匀后620nm下进行吸光度值的测定.
1.4 数据处理
采用SPSS软件进行统计分析,以p≤0.05为差异具有统计学意义.
2 结果与分析
2.1 卷叶突变体的表型分析
野生型和2个卷叶突变体植株的表型特征如图1所示.
与野生型植株相比,外卷突变体植株呈半矮杆状,株高约为野生型的3/4,如图1(a)所示,但穗长没有变短且略长于野生型,如图1(d)所示;外卷突变体的全株叶片较窄且直立,叶片与茎杆间的角度较小,剑叶与倒二叶的叶宽约为野生型的3/4,如图1(a)和(e)所示;另外,外卷突变体一个很明显的表型是叶片向叶远轴面卷曲成半圆柱状且叶脉呈白色,木质化程度高,尤其主脉更为明显,如图1(a)和(c)所示.内卷突变体株高约是野生型的1/2,如图1(a)和(d)所示,全株叶片变窄,约为野生型的的1/2,但茎与叶之间的角度增大,呈散开状,如图1(a)和(e)所示;内卷突变体叶片最明显的特点是叶片向叶近轴面卷曲成半圆柱状,同外卷突变体相比卷曲程度更大,基本接近圆柱状,如图 1(a)和(b)所示.与外卷突变体相比,除了叶片卷曲的方向和程度不一样外,其花器官畸形,因此结实率和穗长大大下降,如图 1(a)和(d)所示.

图1 野生型和2个卷叶突变体的表型Fig.1 Phenotype of wild type and 2rolled leaf mutants
2.2 卷叶突变体叶片组织结构的变化
水稻的野生型和2个卷叶突变体叶片的维管束如图2所示.
水稻叶片的中脉结构比较复杂,由多个维管束和一些薄壁组织组成,大维管束与小维管束相间而生,中间由薄壁组织分隔.叶片主脉中央部分有大的分隔开的通气腔.在野生型的平展型叶片和外卷突变体叶片中,主脉中薄壁组织较多,薄壁细胞多而密,排列紧实(图2A、B),而薄壁细胞崩裂分隔形成的2个通气腔面积较小;在内卷突变体叶片中,薄壁细胞少,排列较为松散,薄壁细胞崩裂分隔形成的通气腔所占面积较大(图2C).水稻叶片主脉两侧有对称分布的次脉,在野生型平展叶片中维管束较大,并伴有较多的薄壁细胞(图2D);外卷突变体叶片次脉的维管束略小于野生型,也伴有较多的薄壁细胞(图2E);而在内卷突变体叶片次脉中维管束较小,薄壁细胞的数量也很少(图2F).

图2 野生型及卷叶突变体叶片的显微结构Fig.2 Microstructure of leaflet of wild type and rolled leaf mutants
一般情况下,泡状细胞在失水或缺水胁迫下会因失去膨压而收缩进而导致叶片卷曲,解除失水或缺水胁迫后,叶片又恢复原状,这属于不可遗传的叶片卷曲性状.本实验中的叶片卷曲是由基因突变造成的,不受环境影响.对野生型及2个卷叶突变体泡状细胞的数目统计结果显示,野生型叶片中泡状细胞数目平均为6个(图2G);内卷突变体和外卷突变体叶片中平均为4个(图2H、I).这一结果说明2个卷叶突变体叶片的卷曲与泡状细胞数目的减少有密切关系.
2.3 野生型与2个卷叶突变体叶片纤维素含量的比较
纤维素是植物细胞壁的主要组成成分,与细胞壁的构建密切相关.本文就野生型和2个卷叶突变体植株的叶片及茎中的纤维素含量进行分析.结果表明,野生型与外卷突变体植株的叶片和茎中的纤维素含量没有显著差异,而内卷突变体叶片及茎中的纤维素含量显著减少,如图3所示.这些结果说明内卷突变体和外卷突变体可能由不同的基因控制.
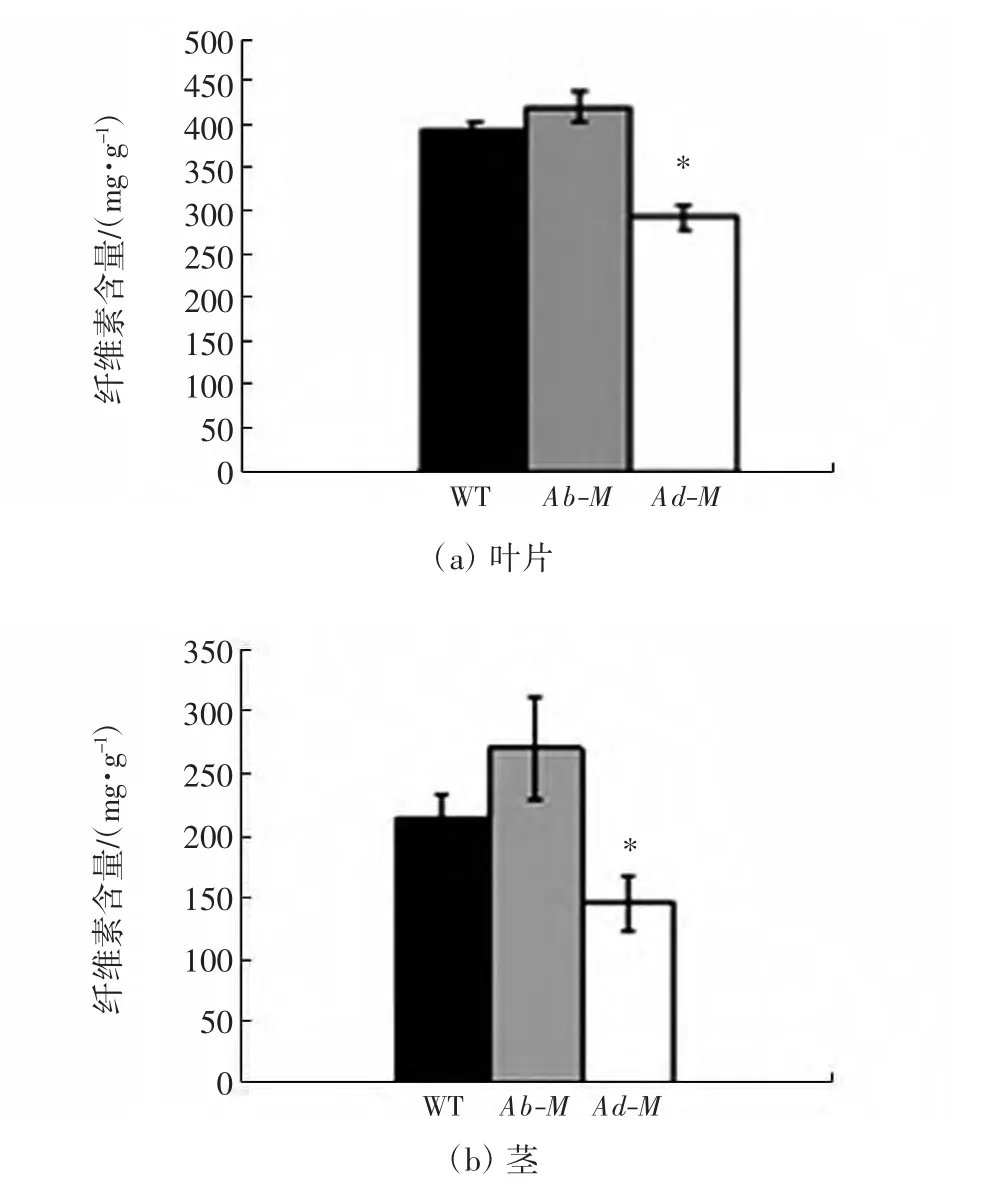
图3 野生型与突变体的纤维素含量Fig.3 Cellulose content of wild type and 2mutants
2.4 卷叶突变体的遗传学分析
为了揭示卷叶突变体的遗传规律,分别以这2个卷叶突变体为母本与野生型配制杂交组合.F1植株均表现出野生型性状,收取F1植株种子播种,在F2代中均出现了性状分离,分离出了预期的突变表型的植株,说明2个卷叶突变体均可以稳定遗传,并且是由隐性基因控制的.统计F2群体中突变体与野生型植株的个数,结果如表1所示.外卷突变体F2中,31株F2单株中有5株表现为突变体性状,χ2(3∶1)检验表明该卷叶性状符合3∶1分离;内卷突变体F2中,53株F2单株中有14株表现突变体性状,χ2(3∶1)检验表明该卷叶性状也符合3∶1分离.这些结果说明2个卷叶突变体的性状均由隐性单基因控制.

表1 2个卷叶突变性状的遗传规律分析Tab.1 Genetic analysis of 2rolled leaf mutants
3 讨论
水稻中叶片的适度卷曲有利于改善水稻基部的受光条件,提高植株的光能利用率;但叶片过度卷曲会产生许多不利影响,如有效叶面积指数较小、光合有效辐射和有效利用率偏低等.本研究通过对2种卷叶突变体的表型分析,发现二者在表型及细胞学结构上存在一定差异,与野生型相比,突变体叶片中泡状细胞的数量也发生了变化.王晓等[19]通过对1个DS转座子插入的卷叶突变体进行细胞学观察,发现其泡状细胞数目与野生型相比有明显差异;Zhang等[11]对sll1突变体的研究也证实了叶片的卷曲与泡状细胞的数目有关.
目前,在水稻中已经鉴别并克隆出一系列卷叶基因,绝大多数是由隐性单基因控制的,也有研究发现了部分不受隐性单基因控制的基因[20-21].本文配制的F2分离群体可能由于籼粳杂交育性受到影响,获得的F2种子数量较少,但遗传分析发现,统计群体中二者的突变性状都符合3∶1的分离比,这表明2个卷叶突变体都由隐性单基因控制.目前课题组已经定位并克隆了内卷突变体的基因,发现其编码1个细胞壁纤维素合成酶(另文发表).结合2.3结果,说明内卷突变体由于纤维素合成酶基因的突变造成了合成途径受阻,从而造成纤维素含量减少.但外卷突变体的纤维素含量正常,说明外卷突变体与内卷突变体可能由不同基因控制.课题组已经扩大了外卷突变体的F2群体,并通过基因定位进一步克隆控制叶片外卷的基因,以揭示叶片不同方向卷曲的分子机理.
植物叶片的发育包括叶原基的形成和叶极性的建立,后者对叶的形态有重要影响[22].近年来在拟南芥(Arabidop sithaliana)和金鱼草(Antirrhinum majus)中研究发现,控制叶片近轴-远轴发育的基因发生突变会引起叶片卷曲,如 PHAN[23],YABBY[24]、KANADI基因[25]和HD-ZIPⅢ基因家族中的 PHB、PHV、REV、ATHB15[26].玉米显性突变体kn1(knotted1)基因造成叶片发育的基-顶轴破坏,植株叶鞘组织沿侧生叶脉向上伸出进入叶片,从而使叶基部的表皮和叶肉细胞具有叶鞘的特点[27].在水稻中,已经克隆得到的RL9基因可以编码GARP结构域蛋白,并且与拟南芥中的KANADI基因是同源基因[28].Luo等[12]预测的在籼稻Ⅱ-32B中的动态卷叶突变体基因是一个编码类似Myb的转录因子,与拟南芥中的KANADI基因同源[15].此外,研究发现植物叶片的发育还与生长素有关,在拟南芥和矮牵牛(Petunia hybrida)中发现的基因YUCCA和FLOOZY的突变,会引起内源吲哚乙酸含量变化,从而使叶片卷曲[29-30].在水稻中也发现了类似基因,如NAL7与YUCCA同源,编码一种黄素单加氧酶,该基因突变会引起IAA含量的变化,导致叶片卷曲[31].因此叶片卷曲涉及较为复杂的生理过程及调控网络,要精确了解叶片卷曲的分子机理,必需研究多基因相互作用及调控网络,以更好利用卷叶资源.
[1] 松岛省三,杨春和.理想水稻栽培技术概要[J].北方水稻,1978(1):43-47.
[2]SAKAGAMI Y,YOSHIDA M,ISOGAI A,et al.Peptidal sex hormones inducing conjugation tube formation in compatible mating-type cells of Tremella mesenterica[J].Science,1981,212(4502):1525-1527.
[3] 沈年伟,钱前,张光恒.水稻卷叶性状的研究进展及在育种中的应用[J].分子植物育种,2009,7(5):852-860.
[4] 袁隆平.我国两系法杂交水稻研究的形势、任务和发展前景[J].农业现代化研究,1997,18(1):1-3.
[5]陈忠祥.宁夏南部回族社区生态环境建设若干重要问题的探讨[J].干旱区地理,2001,24(4):338-341.
[6]HSIAOW L,GATTONI-CELLI S,WEINSTEIN I B.Oncogene-induced transformation of C3H 10T1/2cells is enhanced by tumor promotors[J].Science,1984,226(4674):552-555.
[7]POMMERRENIG B,PAPINI-TERZI F S,SAUER N.Differential regulation of sorbitol and sucrose loading into the phloem of Plantago major in response to salt stress[J].Plant Physiology,2007,144(2):1029-1038.
[8]PRICE D L,SISODIA S S,BORCHELT D R.Genetic neurodegenerative diseases:the human illness and transgenic models[J].Science,1998,282(5391):1079-1083.
[9]KHUSH G S,KINOSHITA T.Rice karyotype,marker genes and linkage groups[C]//KHUSH G S,TORENNIESSEN G H.Rice Biotechnology.Wallingford:CAB International,1991:83-108.
[10]沈革志,王新其,殷丽青,等.T-DNA插入水稻群体中卷叶突变体R1-A2的遗传分析[J].实验生物学报,2003,36(6):459-464.
[11]ZHANG G H,XU Q,ZHU X D,et al.SHALLOT-LIKE1is a KANADI transcription factor that modulates rice leaf rolling by regulating leaf abaxial cell development[J].Plant Cell,2009,21(3):719-735.
[12]LUO Z K,YANG Z L,ZHONG B Q,et al.Genetic analysis and fine mapping of a dynamic rolled leaf gene,RL10(t),in rice(Oryza sativa L.)[J].Genome,2007,50(9):811-817.
[13]余东,吴海滨,杨文韬,等.水稻单侧卷叶突变体B157遗传分析及基因初步定位[J].分子植物育种,2008,6(2):220-226.
[14]丛云飞,方立魁,赵芳明,等.水稻单侧卷叶突变体url2(t)的鉴定与遗传分析[J].西南大学学报:自然科学版,2010,32(4):22-25.
[15]王德仲,桑贤春,游小庆,等.水稻细卷叶突变体nrl2_(t)的遗传分析和基因定位[J].作物学报,2011,37(7):1159-1166.
[16]XIANG J J,ZHANG G H,QIAN Q,et al.Semi-rolled leaf1encodes a putative glycosylphosphatidylinositol-anchored protein and modulates rice leaf rolling by regulating the formation of bulliform cells[J].Plant Physiology,2012,159(4):1488-1500.
[17]FANG L,ZHAO F,CONG Y,et al.Rolling-leaf 14is a 2OG-Fe(II)oxygenase family protein that modulates rice leaf rolling by affecting secondary cell wall formation in leaves[J].Plant Biotechnol J,2012,5(10):524-532.
[18]UPDEGRAFF D M.Semimicro determination of cellulose in biological materials[J].Ana Biochem,1969,32(3):420-424.
[19]王晓,顾福根,孙丙耀.一个有Ds插入引起的泡状细胞异常水稻卷叶突变体[J].苏州大学学报:自然科学版,2012,28(2):89-94.
[20]李仕贵,马玉清,何平,等.一个未知的卷叶基因的识别和定位[J].四川农业大学学报,1998,16(4):391-393.
[21]邵元健,潘存红,陈宗祥,等.水稻不完全隐性卷叶主基因rl(t)的精细定位[J].科学通报,2005,50(19):2107-2113.
[22]施勇烽,陈洁,刘文强,等.一个新的水稻卷叶突变体的遗传分析与基因定位[J].中国科学,2009,39(4):407-412.
[23]WAITES R,HUDSON A,PHANTASTICA.A gene required for dorsoventrality of leaves in Antirrhinum majus[J].Development,1995,121(7):2143-2154.
[24]SIEGFRIED K R,ESHED Y,BAUM S F,et al.Members of the YABBY gene family specify abaxial cell fate in Arabidopsis[J].Development,1999,126(18):4117-4128.
[25]KERSTETTER R A,BOLLMAN K,TAYLOR R A,et al.KANADI regulates organ polarity in Arabidopsis[J].Nature,1999,411(6838):706-709.
[26]EMERY J F,FLOYD S K,ALVAREZ J,et al.Radial patterning of Arabidopsis shoots by classⅢHD-ZIP and KANADI genes[J].Current Biology,2003,13(20):1768-1774.
[27]JACKSON D,VEIT B,HAKE S.Expression of maize KNOTTED1related homeobox genes in the shoot apical meristem predicts patterns of morphogenesis in the vegetative shoot[J].Development,1994,120(2):405-413.
[28]YAN S,YAN C J,ZENG X H,et al.Rolled leaf 9,encoding a GARP protein,regulates the leaf abaxial cell fate in rice[J].Plant Mol Biol,2008,68(3):239-250.
[29]ZHAO Y,CHRISTENSEN S K,FANKHAUSER C,et al.A role for flavin monooxygenase-like enzymes in auxin biosynthesis[J].Science,2001,291(5502):306-309.
[30]TOBENA-SANTAMARIA R,BLIEK M,LJUNG K,et al.FLOOZY of petunia is a flavin monooxygenase-like protein required for the specification of leaf and flower architecture[J].Genes Dev,2002,16(6):753-763.
[31]FUJINO K,MATSUDA Y,OZAWA K,et al.Narrow leaf 7controls leaf shape mediated by auxin in rice[J].Mol Genet Genomics,2008,279(5):499-507.
