纯钛表面激光熔覆处理的进一步实验研究
2014-02-15屠姗姗吴先友
屠姗姗,夏 荣,吴先友
纯钛表面激光熔覆处理的进一步实验研究
屠姗姗1,夏 荣1,吴先友2
目的探讨激光熔覆后钛表面多孔形貌对细胞黏附、增殖和分化的影响。方法在氩气保护环境中应用脉冲式掺钕钇铝石榴石晶体(Nd:YAG)对45 μm钛粉颗粒在钛片表面进行激光熔覆,采用场发射扫描电镜(SEM)观察钛片表面微观形貌,能量弥散X射线谱(EDS)检测钛片表面成分;采用小鼠骨髓基质干细胞BMSCs体外培养评价喷砂酸蚀组(A组)和激光熔覆组(B组)的生物相容性。SEM观察BMSCs在钛表面的黏附状况,细胞计数试剂盒(CCK-8)检测法和碱性磷酸酶(AKP)活性检测评价钛片对BMSCs增殖和分化的影响。结果与A组比较,B组互相连通的多孔钛表面更有利于BMSCs的黏附,也有利于BMSCs细胞的增殖和分化。结论激光熔覆处理钛片表面可促进BMSCs黏附、增殖及分化,有望成为一种有效有前景的钛表面处理方法。
纯钛;激光熔覆;骨髓基质干细胞;表面处理
种植体成功在很大程度上取决于植入后最初材料的机械稳定性,以及随后其与骨组织间强大的活性界面。钛是目前最常见的种植体材料,拥有足够的机械强度,满足材料的稳定性,且给骨组织生长提供临时的支撑,另一方面其具有良好的人体生物相容性,可与骨组织形成牢固的骨结合。种植牙是一种以植入骨组织内的下部结构为基础来支持、固定上部牙修复体的缺牙修复方式,其安全性高、损伤小,应用广泛。为了提高种植的成功率,各种表面处理研究越来越多。表面处理是指用机械和化学等方法使种植体表面疏松、粗糙化,从而具有更好的生物黏附力和骨组织亲和性,加快骨结合。相对于传统表面处理方式,激光熔覆具有机械化的精确、高效等优点,其为加法制作原理,较减法制作节省材料,已涉及人体内研究[1]。该研究利用激光熔覆技术构建钛片表面微纳米级多孔形貌,与传统酸蚀喷砂技术进行比较,探讨钛表面多孔形貌对小鼠骨髓基质干细胞(bone marrow stem cells,BMSCs)黏附、增殖和分化的影响。
1 材料与方法
1.1 材料
1.1.1 主要材料和试剂 45 μm钛粉(纯度达为99.9%),直径为10 mm、厚度为2 mm的纯钛片由陕西省宝鸡锐诚钛业有限公司提供;400 μm大颗粒氧化铝粉由广州莫秦有限公司提供;小鼠骨髓基质干细胞、胎牛血清、细胞培养液由上海创始实业有限公司提供;细胞计数试剂盒(CCK-8)由上海BestBio公司提供;碱性磷酸酶(AKP)检测试剂盒由南京建成生物工程研究所提供。
1.1.2 主要仪器和设备 中国科学院安徽光学精密机械研究所提供Nd:YAG脉冲激光器;中国科学院材料物理重点实验室提供场发射扫描电镜(美国FEI公司sirion 200);安徽医科大学基础医学院实验室提供CO2培养箱(德国heraeus)、倒置显微镜(OLYMPUS CKX41)、酶标仪(美国BioTek公司,ELx800)。
1.2 方法
1.2.1 实验分组 1000#砂纸将直径为10 mm、厚度为2 mm的钛片表面抛光,依次用丙酮、无水乙醇、超纯水超声分别清洗30 min,45℃烤箱中烘干。
A组:喷砂酸蚀组,垂直光滑钛片表面用400 μm大颗粒氧化铝喷砂10 s,清洗后置于67%HCl/H2SO4(1∶1)中,在80℃下酸蚀10 min,再置于蒸馏水防氧化。
B组:激光熔覆组,选择九水硅酸钠做为粘结剂,将45 μm钛粉均匀涂于干燥的钛片上烘干,选择电流110 A,峰值功率2.2 KW对上述预涂层钛片进行激光熔覆处理。将两组钛片依次用丙酮、无水乙醇、超纯水超声分别清洗30 min,烘干。
1.2.2 表面形态和成分 场发射扫描电镜(sacnning electron microscopy,SEM)观察钛片表面微观结构,能量弥散X射线谱(energy dispersion spectros-
copy,EDS)检测表面成分。
1.2.3 细胞黏附观察 将两组钛片采用高压蒸汽(200℃)灭菌后置于24孔培养板中,用胰酶消化第8代小鼠BMSCs,配制细胞悬液,以每孔4×104个细胞接种至24孔培养板,倒置显微镜观察细胞生长状况。每组9个钛片,于24、48、72 h各取出3个,2.5%戊二醛固定2 h,PBS反复冲洗,自然风干,喷金,SEM观察钛片表面细胞黏附、生长情况。
1.2.4 细胞增殖检测 同1.2.3法接种细胞培养。每组16个钛片,第1、3、5、7天时每组取出4个,置入24孔培养板,每孔加入CCK-8试剂,培养箱中孵育4 h,酶标仪在450 nm波长下检测吸光度(OD)值。
1.2.5 细胞分化检测 同1.2.3法接种细胞培养。每组12个钛片,第3、5、7天时每组取出4个,置入24孔培养板,每孔加入0.1%的Triton X-100,培养箱中孵育1 h,滴加AKP检测试剂,37℃恒温水浴15 min后加入显色剂,酶标仪在450 nm波长下检测吸光度(OD)值。
1.3 统计学处理采用SPSS 15.0软件进行分析,统计学方法采用单因素方差分析,检验水准α=0.05。
2 结果
2.1 钛表面观察电镜查看钛表面形态,A组表面孔径大小为0.5~3 μm,B组表面相互连通的三维孔洞直径大小为100 nm~20 μm。见图1。
2.2 表面成分分析EDS分析钛表面成分,两组表面除主要成分为钛外,A组还含有喷金后存在的金(Au)元素,B组含少量硅和碳元素。见图2。

图1 两组钛表面形貌 SEM×5 000
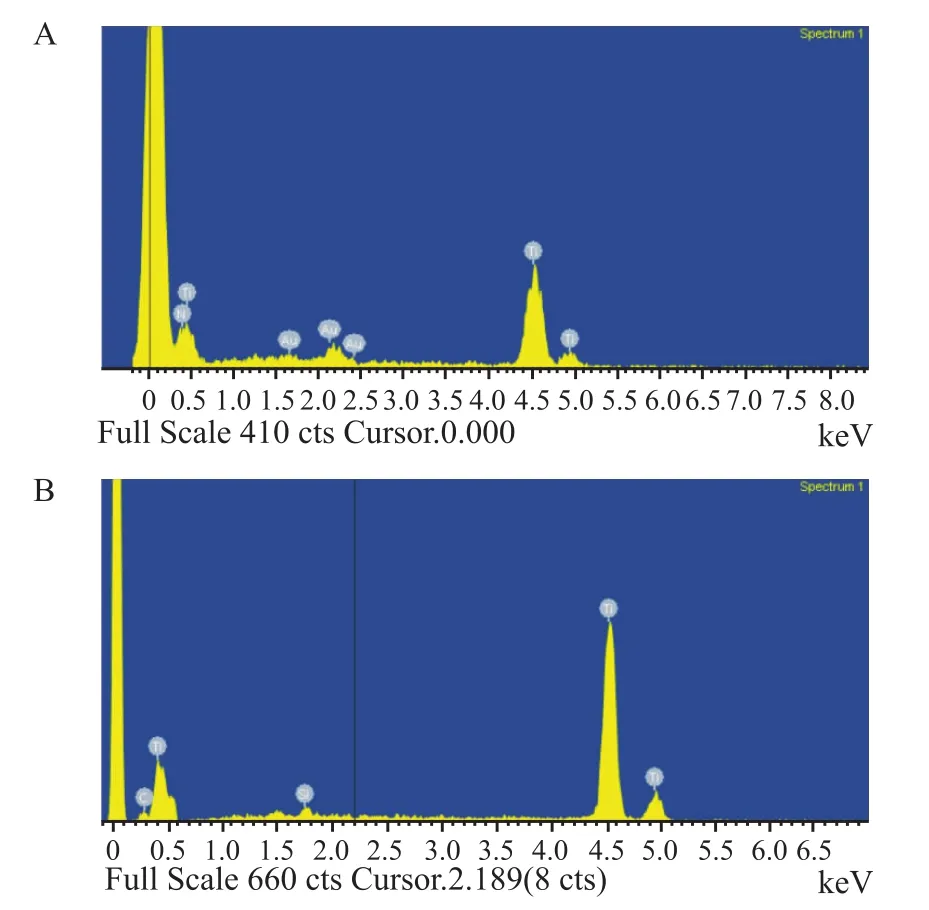
图2 两组钛表面能谱
2.3 细胞黏附观察BMSCs生长24、72 h喷金后钛片表面电镜形貌,A组:粗糙表面细胞沿表面浅窝生长;B组:细胞沿表面孔洞生长,三维孔洞内出现纤维蛋白网状结构。见图3、4。图4 B1、B2中箭头所示可见纤维网状结构。

图3 BMSCs生长24 h后钛片表面电镜

图4 BMSCs生长72 h后钛片表面电镜
2.4 细胞增殖检测与A组比较,B组在第5、7天时OD值升高,差异有统计学意义(P<0.01),见图5。
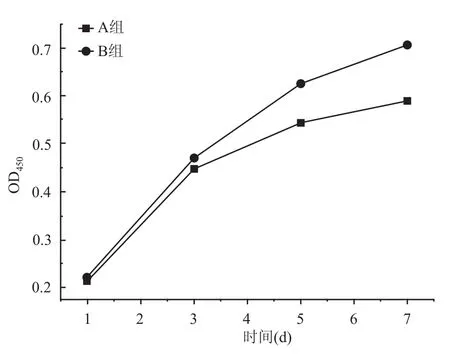
图5 两组钛片细胞培养1、3、5、7 d时细胞增殖曲线
2.5 细胞分化检测与A组比较,B组在第5、7天时OD值升高,差异有统计学意义(P<0.01)。见图6。
3 讨论
牙种植体,最终的目标是获得种植体和天然周围骨之间的固定、结合和稳定,此过程源自自身间充质干细胞可以迁移到植入部位,增殖并分化为成熟的成骨细胞,并分泌胞外基质形成骨结合。此过程与种植体表面形态有一定关系,诸多研究[2-3]显示,机械光滑钛表面细胞为平层结构,主要为二维形态,而粗糙钛表面细胞为多边形态,三维形态的粗糙表面有更大的接触面积,促进细胞黏附、增殖、扩散和分化,从而能促进成骨细胞合成骨组织。

图6 两组钛片细胞培养3、5、7 d时细胞分化能力曲线
牙种植体成功与种植材料表面积大小直接相关,因此为了提高种植体成功率,增加骨结合率,产生了多种多样的表面处理方式。经典的处理方法是喷砂酸蚀,可构造蜂窝状结构的粗糙表面,瑞士Stratmmnn公司推出的ITI牙种植体系统即是喷砂酸蚀表面处理,粗糙表面微孔直径约2 μm,喷砂酸蚀种植体有可能存在残余喷砂颗粒,对种植体有一定影响,另一方面钛表面在喷砂过程中或喷砂酸蚀表面暴露于空气中大于24 h,易被碳氢化合物污染,碳氢化合物封锁了种植体表面活性羟基,降低了表面亲水性,是影响钛生物活性的一个因素,亲水改性的粗糙钛表面促进牙种植体周围骨结合[4-5]。本实验中,将喷砂酸蚀处理的钛片保存在蒸馏水中可以防止喷砂酸蚀表面进一步被污染[6],而激光熔覆处理的钛表面则稳定性好,无需特殊保存。
瑞士ITI牙种植体与市场上销售的巴西表面双酸蚀刻种植体[7]构造蜂窝状结构的粗糙表面有利于骨结合形成,而本实验钛表面激光熔覆处理也构造出相互连通的粗糙表面,三维孔洞直径大小为100 nm~20 μm,直接设定各项激光参数还可调控三维孔洞直径大小范围,且不会形成表面杂质[8]。
激光熔覆技术利用高能密度的激光束在原料粉末和金属表面快速形成熔池又快速凝固,此过程增加了涂层与基体之间的结合强度,通过激光熔覆技术对钛表面进行改性,可以改善钛表面的性能并增强其生物活性。激光快速成形技术将激光熔覆技术和快速成形技术结合起来,在很多领域,特别是口腔医学领域将得到广泛的应用。其原理是将计算机辅助设计的三维模型转换为按一定厚度分层的二维轮
廓信息,再利用激光熔覆方法将金属粉末逐层堆积,最终得到三维实体成品。
激光熔覆处理形成的微观钛表面为相互连通的开放多孔结构,相对于酸蚀表面,可以为成骨细胞附着提供更积极的诱导作用。钛表面增加了表面粗糙度,可能有助于集中更多的蛋白质[9],从而提高黏接强度;钛表面的多孔结构呈开放性,有利于引导成骨细胞向内生长和附着,也容易引导血管长入,形成血管网又可为细胞提供更多营养;钛表面的多孔结构相互连通,不仅增加了表面接触面积及后期成骨的机械锁结力,还起到桥梁的作用,促进细胞定位和体液传输;钛表面孔洞结构还易形成交错的纤维蛋白网,纤维蛋白网可为细胞生长提供更多的引导和支撑,从而加快加强骨结合[10]。而酸蚀喷砂形成的孔洞非相互连通,孔洞深度有限。
牙种植体骨结合成功后还得承担咀嚼力的传导,激光熔覆产生的互连开放的多孔结构有助于减少植入体表面的密度,从而减少应力集中,实现长期协调稳定[11],该设计从机械的角度来看,孔隙率和孔的几何形状影响支架的机械性能和应力疲劳,表面结构的弹性模量,应该是既有足够的强度,以维持生理负荷,又不应超过材料的刚度,防植入体的折裂。
[1] Palmquist A,Grandfield K,Norlindh B,et al.Bone-titanium oxide interface in humans revealed by transmission electron microscopy and electron tomography[J].J R Soc Interface,2012,9(67):396-400.
[2] Alves S F,Wassall T.In vitro evaluation of osteoblastic cell adhesion on machined osseointegrated implants[J].Braz Oral Res,2009,23(2):131-6.
[3] Ramaglia L,Postiglione L,Di Spigna G,et al.Sandblasted-acidetched titanium surface influences in vitro the biological behavior of SaOS-2 human osteoblast-like cells[J].Dent Mater,2011,30(2):183-92.
[4] Mardas N,Schwarz F,Petrie A,et al.The effect of SLActive surface in guided bone formation in osteoporotic-like conditions[J].Clin Oral Implants Res,2011,22(4):406-15.
[5] Zhang E W,Wang Y B,Shuai K G,et al.In vitro and in vivo evaluation of SLA titanium surfaces with further alkali or hydrogen peroxide and heat treatment[J].Biomed Mater,2011,6(2):1-7.
[6] Li S,Ni L,Zhang X,et al.Surface characteristics and biocompatibility of sandblasted and acid-etched titanium surface modified by ultraviolet irradiation:An in vitro study[J].Biomater,2012,100(6):1587-98.
[7] Souza F A,Queiroz T P,Guastaldi A C,et al.Comparative in vivo study of commercially pure Ti implants with surfaces modified by laser with and without silicate deposition:Biomechanical and scanning electron microscopy analysis[J].Biomater,2013,101(1):76-84.
[8] Kurt M,Külünk T,Ural C,et al.The effect of different surface treatments on cement-retained implant-supported restorations[J].Oral Implantol,2013,39(1):44-51.
[9] Gao Y,Hu J,Guan T H,et al.Physical properties and cellular responses to calcium phosphate coating produced by laser rapid forming on titanium[J].Lasers Med Sci,2014,29(1):9-17.
[10]屠姗姗,夏 荣,吴先友,等.纯钛表面激光熔覆处理的实验研究[J].安徽医科大学学报,2013,10(1):1209-13.
[11]Mangano C,De Rosa A,Desiderio V,et al.The osteoblastic differentiation of dental pulp stem cells and bone formation on different titanium surface textures[J].Biomaterials,2010,31(13):3543-51.
Study of titanium surface modified by laser cladding
Tu Shanshan1,Xia Rong1,Wu Xianyou2
(1Dept of Stomatology,The Second Affiliated Hospital of Anhui Medical University,Hefei 230601;2Center of Medical Physics and Technology,Hefei Institutes of Physical Science,Chinese Academy of Sciences,Hefei 230031)
ObjectivThis work focuses on the titanium surface with porous structure obtained by laser cladding and evaluation of cell adhesion,proliferation and differentiation.MethodsThe specimens were prepared by a pulsed Nd:YAG laser cladding of titanium powder with a particle size of 45 μm on it in an argon atmosphere.The microstructure and chemical composition analyses were performed by sacnning electron microscopy(SEM)and energy dispersion spectroscopy(EDS).SEM,CCK-8 method and alkaline phosphatase activity assay were taken to evaluate the effect of the adhesion,proliferation and differentiation of mice bone marrow stem cells.ResultsThe titanium surface microstructure of multilevel and interconnected holes was proved of good cell biocompatibility.ConclusionLaser cladding proves to be an efficient means of surface modification of dental implants and the modified surface has a significant effect on the adhesion,proliferation and differentiation of BMSCs.
pure titanium;laser cladding;bone marrow stem cells;surface modification
R 783.1;TN 249;R 329.24
A
1000-1492(2014)11-1566-04
2014-06-27 接收
安徽省教育厅自然科学研究项目(编号:KJ2009A037Z);安徽省科技厅年度重点科研项目(编号:12070403070);安徽省学术和技术带头人科研活动经费资助(编号:2014H030)
1安徽医科大学第二附属医院口腔科,合肥 230601
2中国科学院医学物理与技术中心,合肥 230031
屠姗姗,女,硕士研究生;
夏 荣,男,主任医师,硕士生导师,责任作者,E-mail:xiarongqh@aliyun.com
