N-乙酰半胱氨酸对模拟失重肺炎大鼠的保护性研究
2014-02-15王小辉朱敏立李月越徐冰心周金莲
王小辉,王 萍,朱敏立,李月越,徐冰心,周金莲,易 勇
N-乙酰半胱氨酸对模拟失重肺炎大鼠的保护性研究
王小辉1,王 萍1,朱敏立1,李月越1,徐冰心2,周金莲3,易 勇4
目的探讨在模拟失重(微重力)状态下,N-乙酰半胱氨酸(NAC)对呼吸系统感染肺炎链球菌时的保护作用。方法将32只清洁级Wistar大鼠随机均分为4组:尾吊灌药注菌组(A组)、尾吊灌药未注菌组(B组)、尾吊未灌药注菌组(C组)、尾吊未灌药未注菌组(D组)。从实验第1天开始A、B组灌胃给予NAC 300 mg/kg,C、D组予以等量无菌注射用水灌胃。第2天采用国际通用的持续尾吊法建立模拟失重模型,A、C组于第4天通过气管注入0.4 ml肺炎链球菌稀释液。B、D组注入等量无菌生理盐水。尾吊7 d后处死大鼠取材,测定血常规、中性粒细胞表面CD11b/c、中性粒细胞活性氧浓度、白介素-10(IL-10)、白介素-6(IL-6)含量。病理切片观察肺组织结构变化。结果C组显微镜下明显可见肺泡大小不等,肺泡间隔增宽增厚,间质内大量中性粒细胞、淋巴细胞浸润,肺泡腔内可见大量泡沫细胞。A组也可见上述病理变化,但较C组减轻,D组次之,B组病变最轻,炎症反应不明显。A、C组白细胞总数、中性粒细胞总数、中性粒细胞百分比高于B、D组,差异有统计学意义(P<0.05,P<0.01)。A组与C组,B组与D组比较差异无统计学意义。各组间CD11b/c、中性粒细胞活性氧浓度、IL-10、IL-6含量差异有统计学意义(P<0.01,P<0.05)。结论N-乙酰半胱氨酸能够减轻模拟失重状态下大鼠肺炎链球菌肺炎的炎症反应和肺组织破坏,其抗氧化应激作用可能对呼吸系统感染有一定保护作用。
失重模拟;大鼠;N-乙酰半胱氨酸;肺炎链球菌;肺部感染
随着人类航天活动的增加,在轨飞行时间逐渐延长,失重状态对人体各系统的影响逐渐引起重视。失重条件下,机体免疫功能下降。人类呼吸道常有多种微生物菌群寄居,在生存环境急剧变化或病理状态下,如失重时下肢血液涌入低阻力、高顺应性、高流量的肺循环,使肺组织淤血,呼吸道与外界相通,各种致病菌、甚至条件致病菌可能繁殖,导致宿主更容易发生呼吸道感染性疾病。该研究旨在建立失重环境下肺炎链球菌肺炎的动物模型,并给与N-乙酰半胱氨酸(N-acetylcysteine,NAC)抗氧化、应激干预,观察其对失重时肺感染是否有保护作用,为未来航天医学研究提供实验依据。
1 材料与方法
1.1 实验动物及分组健康清洁级雄性Wistar大鼠32只由北京华阜康生物科技股份有限公司提供,体重(270±20)g,按照随机数字表法分为注药组:尾吊灌药注菌组(A组,n=8)、尾吊灌药未注菌组(B组,n=8)、尾吊未灌药注菌组(C组,n=8)、尾吊未灌药未注菌组(D组,n=8)。
1.2 尾吊大鼠肺部感染模型的建立实验第1天称重,A、B组每天给予NAC 300 mg/(kg·d)灌胃[1],C、D组每天注射用无菌用水1 ml等量灌胃。实验第2天按照文献[2]方法建立尾吊大鼠模型:每个鼠笼内尾吊1只大鼠,使大鼠前肢踏于笼底,尾部悬于笼顶,后肢悬空完全解除负荷,身体纵轴与水平面约成30°。实验环境为室温(22℃),昼夜周期均为12 h,实验过程中所有大鼠可以自由进食、饮水。A、C组于实验第5天开始采用张均田[3]的气管插管法经气管注入0.4 ml菌悬液(细菌浓度为9.0× 108CFU/ml)[4],具体方法:用2%戊巴比妥钠按60 mg/kg腹腔内注射麻醉,麻醉后将大鼠仰卧固定于实验台,并使实验台(大鼠头部)与水平面保持约30°,用自制开口器将大鼠口腔撑开,充分暴露咽喉部,采用自制直径约1 mm的金属钝针管经口缓慢插入气管后,用微量注射器缓慢注入菌液0.4 ml,立即将实验台垂直竖立保持1 min,使气管内菌液由于重力作用流入大鼠的支气管和肺泡内;B、D组在同一时间、同样方法注入等量的生理盐水。第8天处死实验大鼠,并进行取材、病理检查及细菌学鉴定,确定肺炎模型制备成功。
1.3 主要材料与试剂肺炎链球菌(ATCC6303,上海市米宝莱科技有限公司),按照说明书将细菌复苏后配成所需浓度待用。Anti-Rat CD11b/c PE、抗大鼠粒细胞抗体(anti-rat granulocyte marker FITC,
美国eBioscience公司),大鼠白介素-10(interleukin-10,IL-10)、白介素-6(interleukin-6,IL-6)ELISA试剂盒(美国eBioscience公司)。大鼠中性粒细胞分离液试剂盒(天津灏洋生物制品科技有限公司)。活性氧检测试剂盒(北京普利莱基因技术有限公司),流式细胞仪(美国BD公司)。
1.4 方法
1.4.1 血常规、中性粒细胞及全血标本的处理 尾吊第8天时取材,上述方法麻醉后经腹中动脉取血,6 h内上机检测血常规。取2 ml全血于生化管中,3 500 r/min离心5 min,取血清于-80℃冰箱保存,统一测定IL-10、IL-6含量。
1.4.2 中性粒细胞CD11b/c流式细胞仪检测 大鼠外周血中性粒细胞的分离:参照大鼠中性粒细胞分离液说明书,取大鼠新鲜抗凝血1 ml,与全血及组织稀释液1∶1混匀后小心加于1 ml分离液之液面上,以2 000 r/min(半径15 cm水平转子)离心30 min,此时离心管中由上至下细胞分为4层。第1层:血浆层;第2层:单核细胞层;第3层:富集一定中性粒细胞的分离液层;第4层:红细胞层(含有一定中性粒细胞)。收集第3层和第4层,放入盛有2 ml细胞洗涤液的试管中,充分混匀后,以2 000 r/min离心30 min,弃去上清液,加入6~10倍细胞体积的红细胞裂解液,轻轻吹打混匀,裂解1~2 min,以2 000 r/min离心5 min,弃去红色上清液,加入适量PBS溶液,重悬沉淀,2 000 r/min离心5 min,重复1次。分离率为80%以上。1 ml PBS溶液配成中性粒细胞悬液,取500 μl的中性粒细胞悬液,加入1 μl抗大鼠粒细胞抗体,5 μl anti-rat CD11b/c PE充分混匀,室温避光20 min,于中性粒细胞段开窗,测定CD11b/c荧光强度(meanfluorescence intensity,MFI)。同时对各标本作阴性对照,除以等量同IgGFITC抗体代替CD11b/c-FITC抗体,每个样本检测10 000个细胞。
1.4.3 中性粒细胞活性氧(ROS)的检测 采用双乙酰基二氯荧光素(DCFH-DA),DCFH-DA没有荧光,进入细胞后被酯酶水解为DCFH。在ROS存在时,DCFH被氧化为不能透过细胞膜的强绿色荧光物质(DCF),其荧光在激发波长502 nm、发射波长530 nm附近有最大波峰,强度与细胞内活性氧水平成正比。首先将DCFH-DA工作浓度调整为20 μmol/L备用。取剩余500 μl的中性粒细胞悬液室温2 000 r/min离心5 min,弃去上清液,加入1 ml配好的DCFH-DA避光37℃水浴40 min。室温2 000 r/min离心5 min,弃去上清液,用PBS洗涤2次后重悬,配成500 μl的细胞悬液,将流式细胞仪按激发波长502 nm,发射波长530 nm调好后进行检测。
1.4.4 肺组织病理学检查 尾吊第8天取材,每组均取右肺上叶组织,4%多聚甲醛固定,切片行HE染色,光学显微镜观察。
1.5 统计学处理采用SPSS 17.0统计软件进行处理,所有数据以±s表示,各组之间对比采用单因素方差分析,分析前均进行正态性和方差齐性检验,符合正态性和方差齐性则选择方差分析。若不符合,则行log转化数据后进行正态性和方差齐性检验,符合正态性和方差齐性行方差分析。
2 结果
2.1 肺组织病理结构改变C组病变最严重,显微镜下可见肺泡大小不一致,肺泡间隔增宽增厚,大量中性粒细胞、淋巴细胞浸润,肺泡腔内可见大量泡沫细胞。A组次之,显微镜下可见肺泡大小不一致,肺泡间隔增宽增厚,间质内较多中性粒细胞、淋巴细胞浸润,局部肺泡腔满泡沫细胞。B组显微镜下可见肺泡大小较一致,肺泡间隔增厚,间质内可见少量中性粒细胞、淋巴细胞浸润。D组肺泡大小不一致,肺泡间隔增宽,间质内少量淋巴细胞、中性粒细胞浸润,肺淤血为著。见图1。
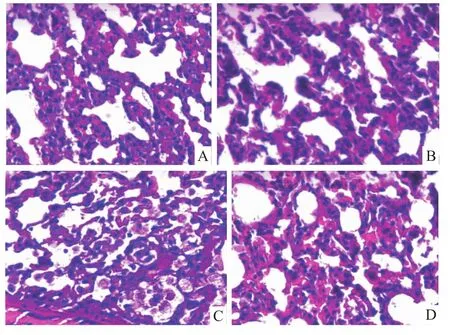
图1 各组肺组织病理学结果HE×200
2.2 流式细胞仪测定中性粒细胞CD11b/c取已配好的500 μl中性粒细胞悬液行流式细胞仪检测,设粒细胞门见图2、3;于中性粒细胞段开窗,测定CD11b/c荧光强度见图4。
图2 中性粒细胞前向角/侧向角散点图
图3 加入抗大鼠粒细胞抗体散点图
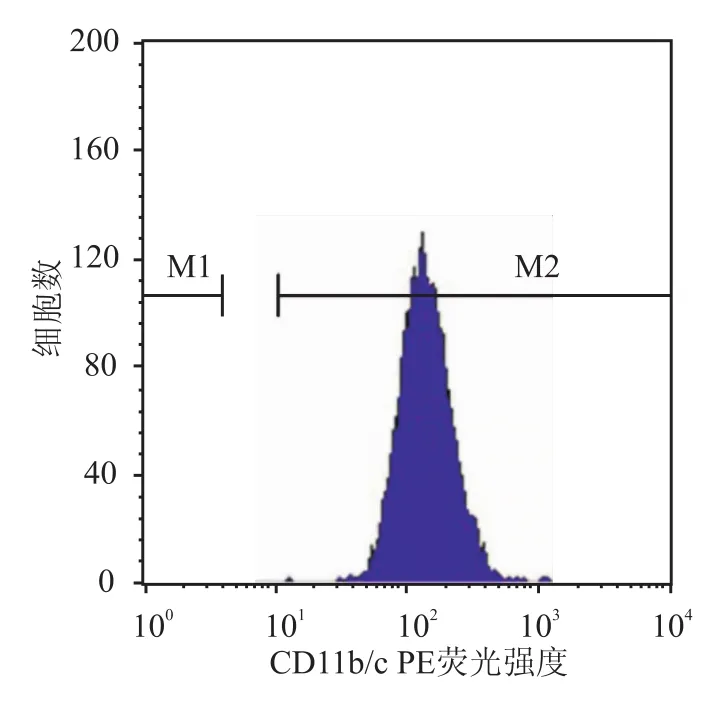
图4 中性粒细胞CD11b/c荧光强度图
图5 中性粒细胞前向角/侧向角散点图
图6 中性粒细胞内ROS荧光强度图
2.3 流式细胞仪测定中性粒细胞ROS荧光强度已配好的500 μl中性粒细胞悬液行流式细胞仪检测设粒细胞门见图5,将流式细胞仪按激发波长502 nm,发射波长530 nm调好后,进行检测粒细胞内ROS荧光强度见图6。
2.4 血常规指标变化A、C组白细胞总数、中性粒细胞总数、中性粒细胞百分比高于B、D组,差异有统计学意义(F=13.80、95.41、36.55,P<0.01)。A组与C组、B组与D组比较,差异无统计学意义。见表1。
表1 外周血白细胞及中性粒细胞总数的比较(n=8,±s)
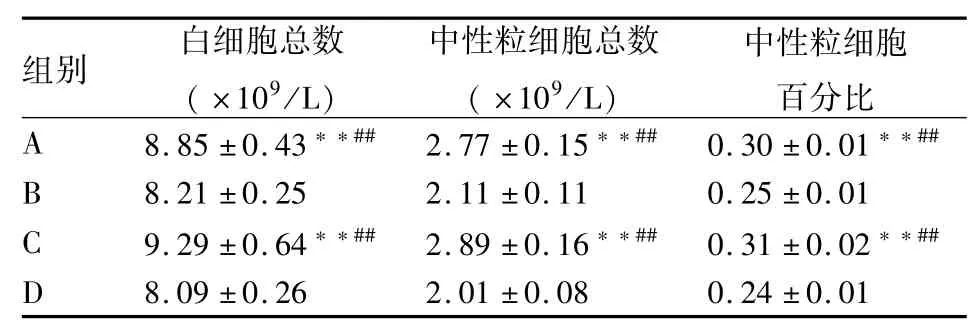
表1 外周血白细胞及中性粒细胞总数的比较(n=8,±s)
与B组比较:**P<0.01;与D组比较:##P<0.01
组别白细胞总数(×109/L)中性粒细胞总数(×109/L)中性粒细胞百分比A8.85±0.43**##2.77±0.15**##0.30±0.01**##B8.21±0.252.11±0.110.25±0.01 C9.29±0.64**##2.89±0.16**##0.31±0.02**##D8.09±0.262.01±0.080.24±0.01
2.5 血中性粒细胞CD11b/c、ROS的变化各组间CD11b/c、ROS比较,差异有统计学意义(F=246.69、136.98,P<0.01)。见表2。
2.6 IL-10、IL-6的变化各组间IL-10、IL-6比较,差异有统计学意义(F=114.51、486.25,P<0.05)。见表3。
表2 大鼠中性粒细胞CD11b/c、ROS量的变化(n=8,±s)

表2 大鼠中性粒细胞CD11b/c、ROS量的变化(n=8,±s)
项目A组B组C组D组P值CD11b/c137.06±4.45128.54±2.52160.94±4.49113.11±2.34<0.01 ROS1 609.46±140.421 044.40±55.982 114.04±179.271 155.04±93.38<0.01
表3 大鼠血清IL-10、IL-6指标变化(n=8,pg/ml,±s)
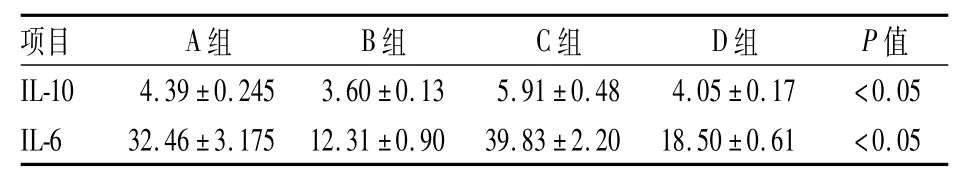
表3 大鼠血清IL-10、IL-6指标变化(n=8,pg/ml,±s)
项目A组B组C组D组P值IL-104.39±0.2453.60±0.135.91±0.484.05±0.17<0.05 IL-632.46±3.17512.31±0.9039.83±2.2018.50±0.61<0.05
3 讨论
呼吸系统与外界直接相通,人类上呼吸道寄生着大量细菌,由于人体免疫系统的调控,寄生菌和人体处于“和平相处”状态[5]。研究[6]证明在失重或微重力状态时,机体的免疫系统功能降低;而细菌毒力增加,耐药性增强[7],这种平衡被打破,机体易于发生呼吸道感染。感染时中性粒细胞募集于肺部,在参与杀死细菌的同时,由于过量募集也会导致放大炎症反应和加重组织损伤。本课题组前期研究[4]显示,模拟失重状态下,机体的炎症反应增强、组织损伤较对照组明显。NAC为谷胱甘肽(GSH)的前体物质,研究[8-10]证实它具有较强的还原性,能够有效减少活性氧,抑制炎症反应,保护细胞免受损伤,并能减少肺炎链球菌在口咽部上皮细胞的黏附[11]。肺炎链球菌是最常见社区获得性呼吸道感染的致病菌,本研究选用NAC的抗氧化、应激作用干预失重叠加肺炎链球菌感染动物模型,结果显示,失重并注菌组与对照组比较,肺组织损伤严重,间质内大量中性粒细胞浸润。注药组的肺组织损伤有所减轻,间质内中性粒细胞明显减少。提示NAC可能减少中性粒细胞在肺脏的募集,有效减轻炎症反应,降低组织伤害。
成熟粒细胞的CD11b主要储存在胞质内,当受到炎症刺激时,CD11b表达上调并转移到细胞膜表面,介导粒细胞向炎症部位趋化,释放有害物质,导致组织损害[12]。本研究结果显示,NAC干预组CD11b较对照组降低,证实NAC能减少CD11b在中性粒细胞表面的表达,从而减少粒细胞在肺内募集,减轻炎症反应和肺损伤。
研究[13]表明中性粒细胞激活时产生的活性氧,能杀灭细菌,但过量时可造成正常组织的损害。本研究中C组ROS荧光强度高于其他组,表明中性粒细胞呼吸氧爆发产生过量ROS,炎症反应更严重,与肺组织病理结构变化一致。而A组ROS荧光强度明显降低,说明NAC能降低中性粒细胞内ROS浓度,减轻了ROS炎症反应对肺组织的损害。同时观察到B、D组ROS荧光强度也降低,提示NAC对失重状态下的肺组织也具有保护作用。
IL-10是由Th2等细胞分泌的,是一种具有多种生物学功能的抑制炎症因子,与炎症程度呈正相关[14]。本研究显示,A组IL-10水平较C组低,提示IL-10可能参与NAC对肺组织的保护机制。IL-6是一种主要来源于受刺激的单核巨噬细胞的促炎因子[15]。本研究结果显示C组IL-6水平高于A组,病理证实该组肺部炎症最重,支持NAC有减轻炎症反应,保护肺组织的作用。
综上所述,NAC能够减轻微重力状态下肺炎链球菌肺炎的炎症反应,提高机体抗感染能力,有效保护肺组织。为航天医疗保障提供了科学实验数据,为呼吸系统炎症损伤及感染的防护和治疗提供参考依据。
[1] Högen T,Demel C,Giese A,et al.Adjunctive N-acetyl-l-cysteine in treatment of murine pneumococcal meningitis[J].Antimicrobial Agents Chemother,2013,57(10):4825-30.
[2] 陈 杰,马 进,丁兆平,等.一种模拟长期失重影响的大鼠尾部悬吊模型[J].空间科学学报,1993,13(2):159-62.
[3] 张均田.现代药理实验方法学[M].北京:北京医科大学,中国协和医科大学联合出版社,1998:981.
[4] 裴士杰,朱敏立,易 勇,等.模拟失重状态下大鼠抗肺炎链球菌感染能力的变化[J].中华结核和呼吸杂志,2012,35(7):515-9.
[5] Mulholland K.Strategies for the control of pneumococcal diseases[J].Vaccine,1999,17:S79-84.
[6] 张 华,贾秀志,张凤蕴.太空及微重力环境对免疫系统影响的研究进展[J].国际免疫学杂志,2004,70(5):2567-76.
[7] 王雅娟,刘长庭.微重力对细菌致病性的影响[J].解放军医学杂志,2013,38(1):73-7.
[8] Soltan-Sharifi M S,Mojtahedzadeh M,Najafi A,et al.Improvement by N-acetylcysteine of acute respiratory distress syndrome through increasing intracellular glutathione,and extracellular thiol molecules and anti-oxidant power:evidence for underlying toxicological mechanisms[J].Human Exp Tox,2007,26(9):697-
703.
[9] Rota C,Bergamini S,Daneri F,et al.N-acetylcysteine negatively modulates nitric oxide production in endotoxin-treated rats through inhibition of NF-κB activation[J].Antioxid Redox Signal,2002,4(1):221-6.
[10]张胜权,罗 欣,陈 兵,等.N-乙酰半胱氨酸体外下调IL-8,IL-6及TNFα在PBMC中的表达[J].安徽医科大学学报,2005,40(1):4-6.
[11]Riise G C,Qvarfordt I,Larsson S,et al.Inhibitory effect of N-acetylcysteine on adherence of Streptococcus pneumoniae and Haemophilus influenzae to human oropharyngeal epithelial cells in vitro[J].Respiration,2000,67(5):552-8.
[12]Schymeinsky J,Mócsai A,Walzog B.Neutrophil activation via beta~2 integrins(CD11/CD18):Molecular mechanisms and clinical implications[J].Thromb Haemost,2007,98(2):262-73.
[13]Bulger E M,Garcia I,Maier R V.Intracellular antioxidant activity is necessary to modulate the macrophage response to endotoxin[J].Shock,2002,18(1):58-63.
[14]Couper K N,Blount D G,Riley E M.IL-10:the master regulator of immunity to infection[J].J Immunol,2008,180(9):5771-7.
[15]Jones S A.Directing transition from innate to acquired immunity:defining a role for IL-6[J].J Immunol,2005,175(6):3463-8.
The protective effect of N-acetylcysteine onstreptococcus pneumonia model of simulated weightlessness rats
Wang Xiaohui,Wang Ping,Zhu Minli,et al
(Dept of Respiratory and Critical Care Medicine,The 306th Hospital of PLA,Anhui Medical University,Beijing 100000)
ObjectivTo explore the ability of resistance to the infection of Streptococcus pneumoniae of the body during simulated weightlessness,which was set up through tail suspension.Besides this,the protective role of N-acetylcysteine was also observed.MethodsThe simulated microgravity and infected animal model:Healthy clean male Wistar rats(n=32),weight(270±20)g,randomly divided into 4 groups:Group A(tail suspension,infection and NAC group),Group B(tail suspension,NAC and no infection group),Group C(tail suspension,infection and no NAC group),Group D(tail suspension,no infection and no NAC group).NAC[300 mg(kg· d)]were fed by intragastric administration on the first day,while the same amount of distilled water were fed in control group.On the second day,the models of simulated weightlessness were duplicated by tail suspension method(Each rat was hung by its tail in a cage,and 30 degrees with the horizontal).The rats were intratracheal instilled with 0.4 ml suspension of streptococcus pneumoniae after tail-suspension for 3 days.At the same time,noinfection groups were intratracheal instilled with 0.4 ml sterile saline.At the end of experiment,the rats were killed.The leukocytes and neutrophils,CD11b and DCFH-DA in the blood were studied.Results①The pathological changes of rat lung:in Group C,obvious congestion of the lung tissue could be observed.Some of alveolus got fusion,alveolar septum got sick,lung’s small veins and capillaries dilated and congestion.Large number of neutrophils and lymphocytes infiltrated in the interstitial,foam cells flooded in the alveolar space.Some changes like these could be found in Group A,but less severe than Group C.A few of the same changes but less severe could be observed in Group D.②Compared with Group A and Group C,the percentage of neutrophile was significantly higher than that in Group B and Group D.And the same trend could be observed in leukocyte count and neutrophile count.There was a statistically significant difference of the mean value of CD11b among four groups,and the value was the highest in Group C.The same trend was observed in DCFH-DA,IL-10 and IL-6.ConclusionOnce the lung was insulted by bacterial during weightlessness,the inflammatory response was significantly higher,the pathological changes were much more severe.NAC would alleviate these changes.The antioxidation effect of NAC may play a role in protection of lung infection while in weightlessness.
simulated weightlessness;rat;N-acetylcysteine;Streptococcus pneumoniae;pulmonary infection
R 332
A
1000-1492(2014)11-1544-05
2014-08-11 接收
全军医学科学技术研究“十二五”重点项目(编号:BWS11J051)
安徽医科大学解放军第306医院临床学院1呼吸与重症医学科、2特种病科、3病理科、4微生物室,北京 100000
王小辉,男,硕士研究生;
王 萍,女,教授,硕士生导师,责任作者,E-mail:pingwang306hpbj@163.com
