间充质干细胞在哮喘大鼠气道炎症及气道重塑中的作用
2014-02-15莫碧文毛雨红李劳东王志霞牛坤汀王昌明曾锦荣韦江红黄剑伟
李 洁,莫碧文,毛雨红,李劳东,王志霞,牛坤汀,王昌明,曾锦荣,韦江红,黄剑伟
间充质干细胞在哮喘大鼠气道炎症及气道重塑中的作用
李 洁1,莫碧文1,毛雨红2,李劳东3,王志霞1,牛坤汀1,王昌明1,曾锦荣1,韦江红1,黄剑伟1
目的探讨间充质干细胞(MSCs)在哮喘大鼠慢性气道炎症及气道重塑中的作用。方法将18只SD雌性大鼠随机分为:正常对照组、哮喘4周组和哮喘8周组,每组6只。卵清蛋白(OVA)致敏后,雾化吸入OVA制作哮喘模型。哮喘模型成功后,测定气道压力;通过HE染色、Image-Pro Plus图像分析软件分析大鼠气道平滑肌的嗜酸性粒细胞(ESO)浸润情况,测定支气管管腔的内周长、管壁面积,支气管平滑肌面积、平滑肌细胞核数;采用密度梯度离心法分离外周血单个核细胞,通过流式细胞仪检测各组MSCs的含量,并分析其与哮喘气道炎症及气道重塑的关系。结果哮喘4周组、哮喘8周组大鼠的气道反应性、气道壁EOS计数、支气管管壁面积、支气管平滑肌面积、平滑肌细胞核数目、外周血中MSCs比例均较正常对照组显著增加(P<0.01,P<0.05);哮喘两组间上述指标差异均有统计学意义(P<0.01);Pearson线性相关显示:各组大鼠外周血单个核细胞中MSCs的含量与气道反应性、EOS浸润数、支气管壁面积、支气管平滑肌厚度及支气管平滑肌细胞核数均呈正相关(P<0.01)。结论MSCs在哮喘状态下含量增加,可能参与了哮喘的慢性气道炎症及气道重塑。
间充质干细胞;支气管哮喘;气道炎症;气道重塑
支气管哮喘(简称哮喘)是全球性的严重威胁人类健康的重要疾病之一,其发病机制复杂。间充质干细胞(mesenchymal stem cells,MSCs)是一类具有多向分化功能的非造血干细胞,已有研究[1-2]显示MSCs可能在哮喘的发生发展中起着较为重要的作用。目前国内外关于MSCs在哮喘中的研究,大多局限于其治疗作用,而关于其是否参与哮喘致病过程的研究甚少。因此,该研究将建立哮喘模型,检测慢性哮喘大鼠和正常大鼠外周血中MSCs含量,观察其含量与哮喘气道炎症和气道重塑的关系,初步探讨MSCs与哮喘致病过程之间是否可能存在联系。
1 材料与方法
1.1 实验动物SPF级雌性SD大鼠18只,6~8周龄,200~250 g,由桂林医学院SPF级实验动物中心提供。
1.2 主要试剂及仪器氢氧化铝凝胶、卵清白蛋白(OVA)、多聚甲醛均购自美国Sigma公司;灭活百日咳杆菌购自北京生物研究所;402AI型超声雾化器购自鱼跃医疗设备有限公司;Percoll分离液购自美国GE公司;小鼠抗大鼠FITC-CD44、PE-CD45及同型对照抗体均购自美国Biolegend公司;流式细胞仪购自美国BD公司。
1.3 方法
1.3.1 实验动物分组 SD大鼠随机均分成3组。正常对照组:雾化吸入磷酸盐缓冲液(PBS),每日1次,共8周;哮喘4周组:每日雾化吸入2%OVA激发哮喘1次,共4周;哮喘8周组:每日雾化吸入2% OVA激发哮喘1次,共8周。
1.3.2 哮喘模型建立 每只大鼠于第1、8天皮下注射10 mg OVA和200 mg氢氧化铝凝胶,同时腹腔注射5×109个灭活百日咳杆菌。于第15天将大鼠置于密闭玻璃容器内,予2%OVA·PBS 50 ml雾化吸入30 min激发哮喘,以大鼠出现烦躁、咳嗽、呼吸困难等哮喘发作的典型表现为激发成功;正常对照组则以PBS代替致敏原致敏并雾化吸入。
1.3.3 气道压力测定 各组哮喘大鼠模型建立成功后,予10%水合氯醛麻醉,气管切开插管,连接动物呼吸机,潮气量10 ml/kg,频率60次/min,气管插管的侧孔连接呼吸机测压管道,直接测得气道压力数值。用PBS将盐酸组胺配成浓度为1.28 g/L的混合液,然后稀释至0.01 g/L。首先向气管插管内雾化喷入PBS,记录气管内压(airway pressure,Paw),然后从低浓度开始,喷入含盐酸组胺的磷酸盐缓冲液,1 min后开始测压。若Paw升高未达到PBS对照的20%,则间隔10 min再喷入下一浓度,直至Paw升高20%为止。此时,所需雾化吸入的组
胺浓度以PC20表示。
1.3.4 实验标本制作 上述各组大鼠测完气道压力后,左心室采血,并反复混匀抗凝,用于密度梯度离心分离外周血单个核细胞;迅速剥离肺组织,向肺内注入适量4%多聚甲醛灌注固定,置4%多聚甲醛中保存,石蜡包埋切片作常规HE染色,光镜下观察各组气道炎症及气道壁结构。
1.3.5 气道重塑情况 取3~4级完整支气管,通过图像分析软件测定支气管管腔的内周长(perimeter inner,Pi)、管壁面积(wall area,W)、支气管平滑肌面积(smooth muscle area,S)、平滑肌细胞核数(number of smooth muscle cells,N),将测得的值用管腔的Pi进行标准化,分别以W/Pi、S/Pi、N/Pi表示。
1.3.6 流式细胞仪检测MSCs的含量 将动物左心室采取的血液与PBS以1∶1的比例充分混匀,用滴管沿离心管壁缓慢滴加于等量Percoll分离液液面上,水平离心1 500 r/min,30 min。离心后管内分三层,上层与中层之间有一以单个核细胞为主的呈云雾状的狭窄层。小心吸取单个核细胞至另一离心管中,加入适量PBS,1 500 r/min离心5 min,洗涤细胞沉淀3次。收集细胞后,用800 μl预冷PBS重悬,充分吹打混匀后,以每管100 μl分装,依据抗体说明书向各管加入适量FITC-CD44、PE-CD45,且每管设立同型对照。避光4℃孵育30 min,1 500 r/min离心5 min,弃上清液,预冷PBS洗涤细胞沉淀2次,各管取400 μl PBS重悬细胞,滤网过滤后上流式细胞仪检测并分析。
1.4 统计学处理采用SPSS 16.0统计软件进行分析,数据以±s表示,组间比较采用单因素方差分析,MSCs的含量与各指标间的关系采用Pearson线性相关分析,以P<0.05作为差异有统计学意义的标准。
2 结果
2.1 各组大鼠气道反应性的比较哮喘4周组与哮喘8周组的PC20值均较正常对照组显著降低(P<0.01),且哮喘8周组的气道反应性较哮喘4周组显著增高(F=158.75,P<0.01),见表1。
表1 各组大鼠气道反应性EOS浸润情况比较(n=6,±s)

表1 各组大鼠气道反应性EOS浸润情况比较(n=6,±s)
与正常对照组比较:**P<0.01;与哮喘4周组比较:##P<0.01
组别PC20值(mg/ml)EOS数(N/HP)正常对照0.37±0.044.43±0.76哮喘4周0.13±0.04**60.32±0.55**哮喘8周0.03±0.06**##72.64±0.54**##
2.2 HE染色及嗜酸性粒细胞(eosinophils,EOS)浸润情况正常对照组大鼠肺组织结构完整,无明显炎症反应,病理变化不明显;哮喘组大鼠的肺组织HE染色可见肺泡腔、肺泡间隔、支气管及血管周围有大量炎症细胞浸润,支气管腔内有不同程度的渗出,支气管平滑肌层增厚,纤毛上皮细胞脱落,基底膜增厚,黏膜肿胀充血形成皱襞,见图1。哮喘4周组和8周组大鼠气道壁浸润的EOS数目较正常对照组显著增多(P<0.01),且哮喘8周组亦较4周组显著增多(F=20 169.61,P<0.01),见表1。

图1 大鼠肺组织病理切片HE×200
2.3 支气管管壁面积、支气管平滑肌厚度及支气管平滑肌细胞核数目的比较哮喘组大鼠HE染色肺组织标准化后的W/Pi、S/Pi、N/Pi均较正常对照组显著增加(P<0.01);与哮喘4周组相比,哮喘8周组大鼠的W/Pi、S/Pi、N/Pi均显著增加(F=426.47、648.80、133.98,P<0.01),见表2。
表2 各组大鼠W/Pi、S/Pi及N/Pi的比较(n=6,±s)

表2 各组大鼠W/Pi、S/Pi及N/Pi的比较(n=6,±s)
与正常对照组比较:**P<0.01;与哮喘4周组比较:##P<0.01
组别W/Pi(μm2/μm)S/Pi(μm2/μm)N/Pi(n/μm)正常对照5.96±0.372.89±0.230.012±0.001哮喘4周9.94±0.30**6.00±0.15**0.019±0.002**哮喘8周11.17±0.30**##8.34±0.36**##0.029±0.002**##
2.4 流式细胞仪检测各组大鼠MSCs含量的差异
流式细胞仪检测结果显示:哮喘4周组[(3.35± 0.59)%]与8周组[(5.60±0.42)%]大鼠外周血中MSCs的含量显著高于正常对照组[(2.26± 0.81)%](P<0.05,P<0.01),哮喘8周组亦显著高于哮喘4周组(F=52.17,P<0.01),见图2。
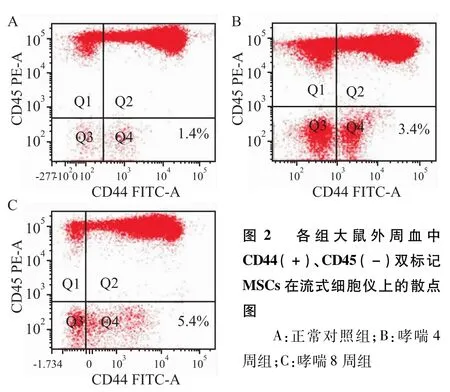
图2 各组大鼠外周血中CD44(+)、CD45(-)双标记MSCs在流式细胞仪上的散点图
2.5 各组大鼠外周血中MSCs含量与哮喘气道炎症及气道重塑的相关性Pearson线性相关分析显示:各组大鼠外周血中MSCs含量与PC20呈负相关;而其含量与EOS浸润数、支气管壁面积、支气管平滑肌厚度及支气管平滑肌细胞核数呈正相关(r值分别为-0.833、0.819、0.849、0.903、0.873,均P<0.01)。
3 讨论
MSCs是来源于中胚层的具有高度自我更新能力和多向分化潜能的成体干细胞,这类细胞在适当的微环境和影响因子的作用下可以向肺、骨、脂肪、肌肉等多种组织细胞分化[3]。研究[4]显示,MSCs高表达CD44,低表达CD45,本实验采用密度梯度离心法分离获得外周血单个核细胞,通过流式细胞仪检测哮喘大鼠模型外周血中CD44(+)CD45(-)MSCs的含量,探讨MSCs与哮喘致病过程之间的关系。结果证实:哮喘4周组和8周组大鼠的外周血中MSCs的含量显著高于正常对照组,且随着哮喘状态的延长,哮喘大鼠外周血中MSCs的含量逐渐增加,推测MSCs可能参与哮喘的发生发展。
支气管哮喘是一种常见的慢性呼吸系统疾病,其基本病理特征包括:气道炎症和气道重塑[5-6]。气道炎症主要表现为支气管黏膜下、支气管周围及肺泡腔大量炎症细胞浸润。炎性细胞可通过合成和释放多种细胞因子和炎症介质诱发支气管哮喘的发作,其在哮喘发病过程中起着重要作用。本研究病理结果显示:哮喘大鼠可见肺泡腔、支气管及血管周围有大量炎症细胞浸润,伴有不同程度的渗出,纤毛上皮细胞脱落,黏膜肿胀充血,且气道壁浸润的EOS数目较正常对照组显著增多,与文献[7]报道一致。此外,本实验还显示各组大鼠外周血中MSCs含量与气道壁EOS浸润情况呈正相关,提示MSCs可能参与了哮喘慢性气道炎症。研究[8-9]表明,MSCs在一定条件下可分化为血管内皮细胞、骨骼肌细胞、神经元及星形胶质细胞等,具有高度分化能力。由此,推测MSCs参与哮喘慢性气道炎症的机制可能是哮喘病理状态下产生的大量细胞因子通过不同的方式诱导MSCs分化为EOS、淋巴细胞、中性粒细胞等多种炎症细胞,趋化迁移至气道壁及其周围,从而促进气道炎症反应。
气道重塑是支气管哮喘的核心病理改变之一,即便是轻度的哮喘患者也存在哮喘气道重塑的现象。哮喘气道重塑是导致气道高反应性的重要病理基础,主要以上皮下纤维化、气道平滑肌细胞增殖、黏液腺及杯状细胞增生为主要特征[10-11]。Saunders et al[12]发现MSCs来源的成纤维细胞迁移至气道壁,从而使哮喘气道中肌成纤维细胞增多。近期研究[13-14]也提示,除了细胞分裂增加、凋亡减少外,气道平滑肌细胞的增殖可能与MSCs迁移至平滑肌束的细胞数目增加有关。本研究显示:哮喘4周组和8周组大鼠气道反应性与W/Pi、S/Pi、N/Pi均显著高于正常对照组,且随着与抗原接触时间的延长,气道重塑程度逐渐加重,与既往研究[10]结果相符。此外,各组大鼠外周血中MSCs含量与哮喘气道重塑临床病理指标的关系显示:各组大鼠外周血中MSCs含量与PC20值呈负相关,与W/Pi、S/Pi、N/Pi呈正相关,提示MSCs与哮喘气道重塑密切相关,可能通过趋化迁移至气道壁并分化为成纤维细胞或气道平滑肌细胞参与哮喘气道重塑,但其具体机制尚不清楚。
[1] Inamdar A C,Inamdar A A.Mesenchymal stem cell therapy in lung disorders:pathogenesis of lung diseases and mechanism of action of mesenchymal stem cell[J].Exp Lung Res,2013,39(8):315-27.
[2] Li J G,Zhuan-sun Y X,Wen B,et al.Human mesenchymal stem cells elevate CD4+CD25+CD127low/-regulatory T cells of asthmatic patients via heme oxygenase-1[J].Iran J Allergy Asthma Immunol,2013,12(3):228-35.
[3] Bakhtina A,Tohfafarosh M,Lichtler A,et al.Characterization and differentiation potential of rabbit mesenchymal stem cells for translational regenerative medicine[J].In Vitro Cell Dev Biol Anim,2014,50(3):251-60.
[4] Martin-Rendon E,Sweeney D,Lu F,et al.5-azacytidine-treated human mesenchymal stem/progenitor cells derived from umbilical
cord,cord blood and bone marrow do not generate cardiomyocytes in vitro at high frequencies[J].Vox Sang,2008,95(2):137-48.
[5] Manuyakorn W,Howarth P H,Holgate S T.Airway remodelling in asthma and novel therapy[J].Asian Pac J Allergy Immunol,2013,31(1):3-10.
[6] Park S J,Lee K S,Lee S J,et al.L-2-oxothiazolidine-4-carboxylic acid or alpha-lipoic acid attenuates airway remodeling:involvement of nuclear factor-kappaB(NF-kappaB),nuclear factor erythroid 2p45-related factor-2(Nrf2),and hypoxia-inducible factor(HIF)[J].Int J Mol Sci,2012,13(7):7915-37.
[7] Ronzani C,Casset A,Pons F.Exposure to multi-walled carbon nanotubes results in aggravation of airway inflammation and remodeling and in increased production of epithelium-derived innate cytokines in a mouse model of asthma[J].Arch Toxicol,2014,88(2):489-99.
[8] Tokcaer-Keskin Z,Akar A R,Ayaloglu-Butun F,et al.Timing of induction of cardiomyocyte differentiation for in vitro cultured mesenchymal stem cells:a perspective for emergencies[J].Can J Physiol Pharmacol,2009,87(2):143-50.
[9] Jori F P,Napolitano M A,Melone M A,et al.Molecular pathways involved in neural in vitro differentiation of marrow stromal stem cells[J].J Cell Biochem,2005,94(4):645-55.
[10]莫碧文,苏海英,韦江红,等.TLR4/PI3K信号相关分子在气道上皮细胞诱导的哮喘气道平滑肌细胞迁移功能中的作用[J].中华微生物学和免疫学杂志,2011,31(11):994-9.
[11]Maarsingh H,Dekkers B G,Zuidhof A B,et al.Increased arginase activity contributes to airway remodeling in chronic allergic asthma[J].Eur Respir J,2011,38(2):318-28.
[12]Saunders R,Siddiqui S,Kaur D,et al.Brightling C E:Fibrocyte localization to the airway smooth muscle is a feature of asthma[J].J Allergy Clin Immunol,2009,123(2):376-84.
[13]Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-6.
[14]Berair R,Saunders R,Brightling C E.Origins of increased airway smooth muscle mass in asthma[J].BMC Med,2013,11:145.
The role of mesenchymal stem cells on airway inflammation and airway remodeling in asthma
Li Jie1,Mo Biwen1,Mao Yuhong2,et al
(1Dept of Respiratory Medicine,The Affiliated Hospital of Guilin Medical College,Guilin 541001;
2Dept of Respiratory Medicine,The First People′s Hospital of Hengyang,Hengyang 421001)
ObjectivTo explore the effect of mesenchymal stem cells on chronic airway inflammation and airway remodeling in a rat asthma model.MethodsEighteen SD female rats were randomly divided into 3 groups(n=6):control group,asthmatic 4 weeks group and asthmatic 8 weeks group.The rats were sensitized and inhaled with ovalbumin(OVA)to make asthmatic model.After successfully establishing model of asthma,the airway pressure had to be measured.The methods of HE staining and Image-Pro Plus image analysis software were used to detect the changes of eosinophils granulocytes(EOS),the perimeter inner of the bronchial lumen,the wall area,the area of bronchial smooth muscle and the number of smooth muscle cells.Density gradient centrifugation was used to isolate mesenchymal stem cells in peripheral blood,while the content of mesenchymal stem cells could be detected by the flow cytometry.The Role of mesenchymal stem cells on airway inflammation and airway remodeling in asthma was able to be analyzed from the above data.ResultsThe airway responsiveness,the count of EOS,the area of bronchial wall,the area of bronchial smooth muscle,the number of smooth muscle cells and the proportion of mesenchymal stem cells in the peripheral blood in the asthmatic 4 weeks group and asthmatic 8 weeks group was significantly higher than those in the control group(P<0.01,P<0.05).Significant difference between two asthmatic groups was observed in the above indexes(P<0.01).Pearson linear correlation demonstrated that the content of mesenchymal stem cells was significantly positively correlated with the airway responsiveness,the number of EOS,the area of bronchial wall,the area of bronchial smooth muscle and the number of bronchial smooth muscle cells(P<0.01).ConclusionThe mesenchymal stem cells increase in the state of asthma,which may be involved in chronic airway inflammation and airway remodeling of asthma.
mesenchymal stem cells;bronchial asthma;airway inflammation;airway remodeling
R 562.2;R 322.34;R 322.35
A
1000-1492(2014)11-1549-04
2014-05-19 接收
国家自然科学基金(编号:81260009);广西自然科学基金重点课题(编号:2012GXNSFDA053020)
1桂林医学院附属医院呼吸内科,桂林 541001
2衡阳市第一人民医院呼吸内科,衡阳 421001
3柳州市工人医院呼吸内科,柳州 545005
李 洁,女,硕士研究生;
莫碧文,女,教授,主任医师,硕士生导师,责任作者,E-mail:mobiwen2002@sohu.com
