天麻素改变大鼠窦房结细胞和心房肌细胞的电生理活动
2014-02-12王烈成孔德虎胡金兰
王 飞,位 凯,沈 兵,王烈成,孔德虎,胡金兰
天麻素改变大鼠窦房结细胞和心房肌细胞的电生理活动
王 飞,位 凯,沈 兵,王烈成,孔德虎,胡金兰
目的记录大鼠心肌细胞生物电活动并观察天麻素对大鼠心肌细胞生物电活动的影响。方法选用健康SD大鼠,应用心肌细胞内生物电记录的方法,了解正常窦房结及心房肌细胞的生物电活动情况,观察并分析天麻素对大鼠窦房结和心房肌细胞生物电活动的影响。结果在目前实验条件下,能真实记录到窦房结和心房肌细胞电活动,在此基础上观察到天麻素能加快大鼠窦房结细胞Vmax 4,缩短心房肌细胞APD90,其余的电生理参数变化不明显。结论记录离体心肌细胞生物电活动的实验条件相对成熟;天麻素能影响离体心肌细胞生物电活动,可能与天麻素增强TCa2+通道通透性,促进KATP的开放有关。
天麻素;心房肌细胞;窦房结细胞;动作电位
天麻作为我国常用的名贵中药有着巨大的药用价值,天麻素是其有效成分之一,化学结构为4-羟甲基苯甲醇-β-D吡喃葡萄糖苷。研究[1-2]表明,天麻素具有镇静、催眠,对脑细胞损伤有保护作用;对于循环系统,天麻素能降低外周血管阻力、降低血压和增加动脉血管顺应性[3],尤其可以增加外周及冠状动脉血流量,对心脏具有一定的保护作用[4]。实验室前期研究[5]表明天麻素预处理对大鼠心肌缺血再灌注损伤具有保护作用,能加快大鼠心率,降低在体大鼠心肌缺血再灌注损伤时心律失常的发生。因此该研究拟从电生理学的角度,探索天麻素对大鼠离体心肌细胞电活动的影响,进而了解天麻素对心肌细胞的离子作用机制,这也将成为研究天麻素降低心律失常发生的必要前提。
1 材料与方法
1.1 实验动物选用健康成年SPF级SD大鼠(安徽省实验动物中心提供),雌雄不拘,体重(230± 10)g,动物置于聚丙乙烯塑料大鼠笼内,所有大鼠自由进食饮水,自然采光,室温维持在(24±1)℃。在实验过程中,其中有5只大鼠记录不到窦房结细胞动作电位而舍弃。部分细胞可以记录到动作电位,但由于不稳定,不能给药用作药物灌流前后数据的分析。
1.2 方法
1.2.1 大鼠离体心肌组织的制备 将大鼠击昏,颈部放血,四肢固定,迅速开胸取右心房连同上下腔静脉,置于4℃的充氧Krebs’液[118×10-3mol/L NaCl,4.7×10-3mol/L KCl,2.5×10-3mol/L CaCl2,1.2×10-3mol/L KH2PO4,1.2×10-3mol/L MgSO4(7 H2O),25.2×10-3mol/L NaHCO3,11.1 ×10-3mol/L glucose]中,按心脏跳动节律轻挤压以排除心房内的积血。切取部分上下腔静脉连同部分心房肌,用不锈钢针将标本固定在容积为4 ml标本槽中,固定标本过程中注意不能损伤窦房结,并以心肌标本的自然长度固定在光滑的琼脂表面。用正常Krebs’液灌流[(36±0.5)℃,95%O2、5%CO2的混合气),恒速灌流(5×10-3L/min)。适应灌流30 min后,记录窦房结及心房肌细胞生物电各参数。
1.2.2 主要试剂及记录装置 天麻素(C13H18O7,批号:20100801,纯度:99.2%,江苏宝泽堂医药科技有限公司),其它试剂均为分析纯。适应灌流30 min后(LEAD-2蠕动泵,保定兰格恒流泵有限公司),在显微镜下用微操纵仪将玻璃微电极(玻璃微电极由P-97微电极拉制仪(美国Sutter公司)拉制,尖端充以3 mol/L KCl,电极尖端电阻:10~40 MΩ)推进至心肌细胞表面,再改用步进式微电极推进器(MO-81,日本Narishiger科学仪器公司)以每步1 μm的步速将微电极刺入细胞。一旦刺入细胞,膜电位会突然下降,同时记录到生物电信号。生物电信号经过Intra 767型微电极放大器(日本Narishiger科学仪器公司)放大后,输入计算机信号采集分析系统(Powerlab/4sp,澳大利亚ADInstruments公司)来记录和分析窦房结及心房肌细胞生物电的变化[6]。
1.2.3 观察指标 先记录正常的细胞电活动,包括窦房结细胞动作电位的自发频率(APF)、阈电位(TP)、最大复极化电位(MDP)、静息膜电位(RP)、动作电位幅度(APA)、0期去极化速度(Vmax 0)、4期自动去极化速度(Vmax 4)以及心房肌细胞的APF、RP、APA、Vmax 0和动作电位时程(APD50、APD90)。然后予以天麻素(2×10-5mol/L)[7]持续灌流10 min后,观察窦房结和心房肌细胞的上述生物电指标的变化;冲洗后,再继续记录生物电信号并观察上述指标的变化。通过窦房结细胞的生物电变化观察天麻素对自律细胞的影响;通过心房肌细胞的生物电变化观察天麻素对工作细胞的影响。
1.3 统计学处理采用SPSS 17.0软件进行分析,实验数据以±s表示,药物干预前后的比较采用配对样本t检验。
2 结果
2.1 正常大鼠窦房结细胞生物电活动将玻璃微电极推进至上腔静脉与右心房交界处,并把微电极的探头电位调至零电位水平,通过步进式微电极推进器将微电极逐步刺入细胞,一旦入胞内即可引出窦房结细胞动作电位。见图1中的Pre-Gastrodin。实验中所记录到的窦房结细胞生物电活动的各指标为APF:(256.64±32.97)bpm;TP:(-46.49± 7.32)mV;MDP:(-54.09±2.14)mV;APA:(52.34±11.14)mV;Vmax 0:(2 008.25± 1 056.77)mV/s;Vmax 4:(99.27±37.36)mV/s,n=113个窦房结细胞。
2.2 正常大鼠心房肌细胞生物电活动将玻璃微电极推进至心房肌表面,以上述同样方法引出心房肌细胞动作电位。如图2中的Pre-Gastrodin。实验中所记录到的心房肌细胞生物电活动的各指标为APF:(241.35±39.68)bpm;RP:(-67.60±7.77)mV;APA:(74.68±8.90)mV;Vmax:(17 349.41± 3 740.14)mV/s;APD50:(0.172±0.006 8)s;APD90:(0.547±0.016 4)s,n=291个心房肌细胞。
2.3 天麻素对窦房结细胞生物电活动的影响找到窦房结细胞后稳定5 min,记录窦房结细胞正常电活动,然后予以天麻素(2×10-5mol/L)持续灌流10 min后,观察并记录窦房结细胞生物电的变化,冲洗后再记录相应指标(实验结果在同一细胞上获得)。与天麻素灌流前比较,天麻素灌流后,大鼠窦房结细胞AP发放频率明显加快(t=-8.371),心动周期缩短,Vmax 4明显加快(t=-6.161),差异均有统计学意义(P<0.05),冲洗后上述参数均恢复,APA、Vmax 0及其余参数变化不明显,结果表明天麻素可以提高窦房结细胞的自律性,见图1、表1。
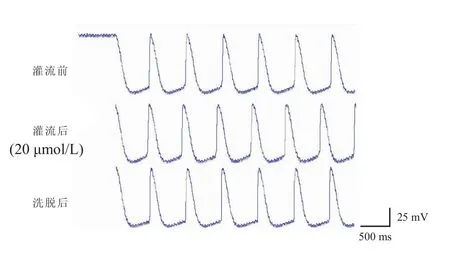
图1 天麻素对窦房结细胞生物电活动的影响
表1 天麻素对大鼠窦房结细胞AP各参数的影响(±s)
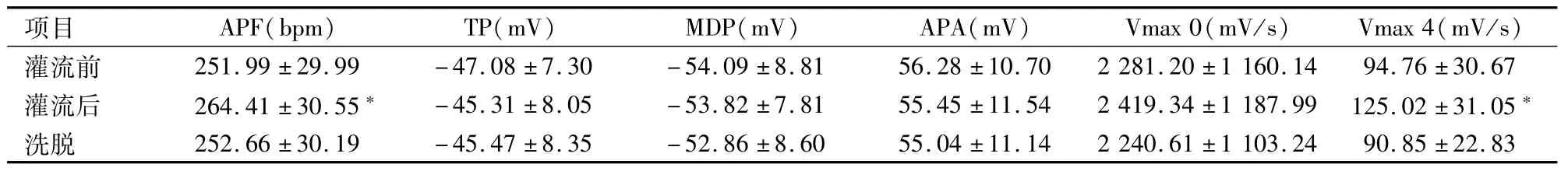
表1 天麻素对大鼠窦房结细胞AP各参数的影响(±s)
与灌流前比较:*P<0.05
项目APF(bpm)TP(mV)MDP(mV)APA(mV)Vmax 0(mV/s)Vmax 4(mV/s)灌流前251.99±29.99-47.08±7.30-54.09±8.8156.28±10.702 281.20±1 160.1494.76±30.67灌流后264.41±30.55*-45.31±8.05-53.82±7.8155.45±11.542 419.34±1 187.99125.02±31.05*洗脱252.66±30.19-45.47±8.35-52.86±8.6055.04±11.142 240.61±1 103.2490.85±22.83
表2 天麻素对大鼠心房肌细胞AP各参数的影响(±s)

表2 天麻素对大鼠心房肌细胞AP各参数的影响(±s)
与灌流前比较:*P<0.05
项目APF(bpm)RP(mV)APA(mV)Vmax 0(mV/s)APD50(s)APD90(s)灌流前258.87±47.96-67.89±6.9877.81±7.0019 451.79±1 751.190.184±0.010.588±0.02灌流后273.21±41.49*-66.67±8.2377.96±5.5918 508.33±2 332.690.176±0.010.543±0.02*洗脱262.40±49.04-64.93±7.7676.96±6.2119 239.58±1 551.300.173±0.010.544±0.01
2.4 天麻素对心房肌细胞生物电活动的影响记录心房肌细胞生物电活动,观察用天麻素灌流前,灌流后及冲洗后的生物电变化,(实验结果在同一细胞上获得)。与天麻素灌流前比较,天麻素灌流后,APF加快(t=-4.101),心房肌细胞APD90明显缩短(t=2.916),差异均有统计学意义(P<0.05),冲洗后上述参数均恢复,APD50及其余参数变化不明显,结果提示天麻素能缩短心房肌细胞动作电位时程,尤其是APD90,这可能与天麻素促进心房肌细胞3期K+外流有关,见图2、表2。
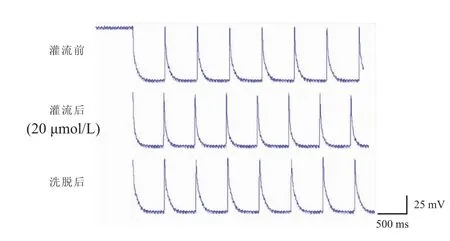
图2 天麻素对心房肌细胞生物电活动的影响
3 讨论
心律失常多由于心肌细胞膜离子活动的异常活动所致,本课题组前期研究[5]表明天麻素预处理可以减少在体大鼠心肌缺血再灌注损伤时心律失常的发生,加快大鼠心率,因此考虑天麻素可能会对心肌细胞膜离子通道活动有影响并能影响窦房结细胞的自律性。那么天麻素是否能直接影响心肌细胞生物电活动,国内外尚无这方面的报道,因此本课题组应用细胞内生物电记录技术,在现有的实验条件下,客观真实地记录到了窦房结细胞和心房肌细胞电活动,包括APF、RP、APA、Vmax和APD等,并通过灌流天麻素了解到天麻素对离体心肌细胞生物电活动的影响。离体细胞的记录可以排除神经及体液因素对心肌细胞活动的影响,使对其离子机制的分析更加简单直接。
本研究表明天麻素可以明显加快离体窦房结细胞4期自动去极化速度,从而提高窦房结细胞的自律性,这与在体实验下天麻素使大鼠心率加快的结果是一致的。
窦房结自律性的高低主要与4期自动去极化速度、MDA水平有关,窦房结4期自动去极化的离子机制包括外向电流的减弱和内向电流的增强[8],其中IK是窦房结4期自动去极化的最重要的离子基础,其次If离子流和T-Ca2+通道开放引起的Ca2+内流也是4期自动去极化必不可少的离子基础。而实验所测的天麻素对大鼠窦房结MDP无影响,因此初步认为天麻素抑制窦房结细胞K+外流的可能性不大,若要明确需进一步通过膜片钳技术来证明;If离子流是一种超极化激活的内向离子流[9],If通道的最大激活电位为-100 mV左右,而实验所测的大鼠窦房结MDP在-50 mV左右,因此考虑If在大鼠4期自动去极化过程中所起的作用不大;ICa-T参与起搏的机制是通过触发肌浆网钙释放从而增加钠钙交换电流,由此产生的内向电流驱使细胞膜进一步去极至阈电位水平[10]。当4期自动去极化至-50 mV时,ICa-T被激活,综合以上考虑天麻素增加窦房结4期自动去极化速度可能与增强T-Ca2+通道通透性有关,这一假设还将通过应用T-Ca2+通道拮抗剂Miberfradi来进一步研究。研究同时发现天麻素对窦房结细胞0期去极化速度及APA影响不大,推测天麻素可能不影响L-Ca2+通道。
本研究显示天麻素可以从而对抗心肌缺血引起的心肌细胞动作电位时程的延长,对心肌细胞起到保护作用。另外,天麻素对心房肌细胞0期去极化速度及APA的影响不大,提示天麻素对电压门控式Na+通道无影响,但是天麻素可以明显缩短心房肌细胞动作电位时程,尤其是APD90,但不影响APD50,该结果提示天麻素能加快心房肌细胞3期K+的外流,这可能与促进KATP的开放有关,从而对抗心肌缺血时APD的延长[11],对心肌细胞起到保护作用。这点也与本课题组的在体研究[5]结果相一致。至于是否促进KATP的开放还需在后期的研究中通过应用KATP拮抗剂来进一步证实。
综上所述,本实验室在现有条件下记录离体心肌细胞生物电活动的技术已相对成熟。在此基础上研究天麻素对离体心肌细胞的作用,发现天麻素能加快窦房结细胞4期自动去极化速度,并缩短心房肌细胞动作电位时程,这可能与天麻素增强T-Ca2+通道通透性,促进KATP的开放有关。
[1] 邹 宁,吕剑涛,薛仁余,等.天麻素对小鼠的镇静催眠作用[J].时珍国医国药,2011,22(4):807-9.
[2] 聂 晶,杜 亮,黄 燮,等.天麻素对大鼠脑缺血再灌注损伤的保护作用[J].华西药学杂志,2010,25(4):423-5.
[3] 张 勤,杨云梅,余国友.天麻素注射液对老年难治性高血压患者血压和血管活性物质影响的随机对照研究[J].中西医结合学报,2008,6(7):695-9.
[4] 黄文珍.关于中药天麻的鉴定与药理作用[J].中国医药指南,2013,11(15):289-90.
[5] 王 飞,位 凯,胡金兰,等.天麻素预处理对大鼠心肌缺血再灌注损伤的保护作用[J].中国药学杂志,2012,47(23):1905-10.
[6] 范一菲,陈志武,胡金兰,等.豚鼠离体心肌缺血再灌注的电生理模型[J].安徽医药,2007,11(2):141-3.
[7] 周 敏,陆永利,郑世玲,等.天麻素抗大鼠离体心肌缺血/再灌注损伤的作用[J].辽宁中医药大学学报,2009,11(12):180-2.
[8] 邓松柏.窦房结自动除极相关离子通道的研究进展[J].心血管病学进展,2008,29(5):736-9.
[9] 汪艳丽.窦房结细胞自律性与超极化激活起搏电流关系的研究进展[J].医学综述,2011,17(12):1778-80.
[10]李 东,王迪生.窦房结细胞电生理研究进展[J].中西医结合心脑血管杂志,2008,6(12):1443-5.
[11]Jia D.The Protective effect of mitochondrial ATP-sensitive K+channel opener,nicorandil,combined with Na+/Ca2+exchange blocker KB-R7943 on myocardial ischemia-reperfusion injury in rat[J].Cell Biochem Biophys,2011,60(3):219-24.
Changes of electrophysiological profiles of rat myocardial cells after perfusing with Gastrodin
Wang Fei,Wei Kai,Shen Bing,et al
(Dept of Physiology,School of Basic Medical Science of Anhui Medical University,Hefei 230032)
ObjectiveTo record the myocardial cell bioelectric activities and explore electrophysiological profiles of Gastrodin on rat myocardial cells.MethodsSinoatrial node cells and atrial myocytes isolated from 50 SD rats were used in this study to characterize the effect of Gastrodin on their electrophysiological profiles with intracellular recording approaches.ResultsIn the present experimental conditions,the bioelectric activities of sinoatrial node and atrial myocytes were truly recorded and we found that Gastrodin significantly accelerated AP frequency and Vmax 4 of sinoatrial node cells and shortened APD90of atrial myocytes.ConclusionThe experimental conditions of recording the bioelectric activities of myocardial cells in vitro are relatively mature.Gastrodin can affect the electrical activity of myocardial cells in vitro and the effects of Gastrodin may be related to inhance the permeability of T-Ca2+channels and promote the opening of KATP.
Gastrodin;atrial myocytes;sinoatrial node cells;action potential
R 33-33;R 932
A
1000-1492(2014)03-0287-04
2013-08-26接收
安徽省教育厅科研课题(编号:2006KJ362b);校级优秀青年教师后备人选基金资助(编号:2009A028)
安徽医科大学基础医学院生理学教研室,合肥 230032
王 飞,女,硕士研究生;胡金兰,女,副教授,硕士生导师,责任作者,E-mail:hjlan1872@163.com
