淀粉酶活性常量与微量测定方法比较
2014-02-10雷晓冬
李 兰,雷晓冬
(河南科技学院 生物工程系,河南 新乡 453003)
淀粉酶活性常量与微量测定方法比较
李 兰,雷晓冬
(河南科技学院 生物工程系,河南 新乡 453003)
以实验室保存的淀粉酶产生菌枯草芽孢杆菌为出发菌株,经过平板分离、点种、碘熏蒸,筛选出产淀粉酶活力较高的菌株。本实验重点采用常量测定法和微量测定法对酶活性进行测定,并对所得数据进行比较分析,结果显示,两种方法测定的酶活性差异不明显,说明微量测定法是可以代替常量测定法的。
枯草芽孢杆菌;淀粉酶;DNS;常量测定;微量测定
淀粉酶是水解淀粉和糖原酶类的统称,能够水解淀粉分子,生成包括糊精在内的不同水解产物,并逐步生成由葡萄糖单位组成的聚合物。微生物的许多种类都能产生淀粉酶,枯草芽孢杆菌是其中主要生产菌种之一。淀粉酶是最早实现工业化生产,迄今为止用途最广、产量最大的酶制剂品种。特别是20世纪60年代以来,由于酶法生产葡萄糖以及用葡萄糖生产异构糖浆的大规模工业化,淀粉酶的需要量越来越大,几乎占到整个酶制剂总产量的50%。目前淀粉酶被广泛应用于多个领域,因此,做好淀粉酶活性测定工作具有重要意义。
测定α-淀粉酶活性的方法有分光光度法、应交扩散法、3,5-二硝基水杨酸法、黏度计法和降落值法。目前,3,5-二硝基水杨酸法是最常用的方法。在大多数测定淀粉酶的实验和标准中,都是采用常规的方法和步骤,试剂用量较大,且操作过程不够简便。本实验选用的产淀粉酶菌株是实验室保存的枯草芽孢杆菌,经过平板分离、点种、碘熏蒸,筛选出淀粉产酶活性较高的菌株;通过常量和微量两种方法分别测定淀粉酶活性,并对测定结果进行比较分析,希望可以提供一种能够代替常量测定的经济、有效、简便的方法。
1 材料与方法
1.1 材料
1.1.1 出发菌株
实验室试管保存的枯草芽孢杆菌。
1.1.2 试剂
柠檬酸缓冲液(pH 6.0),0.4 mol/L氢氧化钠溶液,1%淀粉溶液,3,5-二硝基水杨酸(DNS),标准葡萄糖溶液(1 g/L)。
1.1.3 培养基
斜面培养基:可溶性淀粉1%,牛肉膏1%,蛋白胨1%,酵母膏0.2%,氯化钠0.5%,琼脂2%,pH 6.5。
种子培养基:葡萄糖5%,牛肉膏1%,蛋白胨1.5%,酵母膏0.2%,氯化钠0.5%,pH 6.5。
发酵培养基:可溶性淀粉5%,牛肉膏1%,蛋白胨1.5%,酵母膏0.2%,氯化钠0.5%,氯化钙1%,pH 6.5。
1.1.4 仪器
722N可见分光光度计,101A-2电热鼓风干燥箱,恒温水浴锅,电热恒温培养箱,YPW-Ⅰ型迴转式恒温调速摇瓶柜,80-1离心沉淀器,净化工作台,JA5002电子天平,蒸汽消毒器,电炉,电磁炉等实验室常用仪器。
1.2 实验方法
1.2.1 菌种的筛选及保存
1.2.1.1 菌种的筛选
将试管保存的制备枯草芽孢杆菌成菌悬液,分别稀释10-1、10-2、10-3、10-4、10-5、10-6、10-7倍,
各取1 mL涂布于平面上,分别置于37℃恒温箱中培养。在浓度适当的培养基上选取15个菌株,分别编号,转接于试管斜面,于37℃下培养24 h,置冰箱保存。然后用接种针分别蘸取每个菌落点种在已经灭过菌的平板上,37℃下培养24 h。用碘熏蒸培养皿,在菌落周围出现水解圈,测量水解圈直径与菌落直径并计算其比值(HC比值),作为筛选指标。
1.2.1.2 菌种的保存
选取酶活性较高的菌株,将冰箱中保存的相应菌株接种于20支试管斜面上,37℃下培养24 h,然后保存在4℃冰箱中。
1.2.2 淀粉酶活性的常量、微量测定
1.2.2.1 粗酶液制备
从冰箱中取出保存的菌株,转接试管斜面活化,37℃下恒温培养24 h。将菌种挑取三环接种到30/250 mL种子培养基中,37℃,160 r/min,培养12 h。用移液管吸取3 mL接种到30/250 mL发酵培养基中,37℃,160 r/min,培养48 h。
发酵液3500 r/min离心10min,去上清液,即为粗酶液。
1.2.2.2 酶促反应
每一个样品4支试管,一个做对照,其他用于测定样品(3个平行样);每管加入酶液1 mL,向各管中加入柠檬酸缓冲液(pH 6.0)1 mL,然后再向对照管中加入0.4 mol/L氢氧化钠溶液,以终止其中的酶促反应,各管均是在60℃水浴15 min;分别向各试管中加入60℃水浴预热15 min的1%淀粉溶液,摇匀,立即放回水浴中,准确保温10 min;迅速向各测定管中加入0.4 mol/L氢氧化钠溶液,以终止酶促反应。每一步加入试剂的用量见表1。
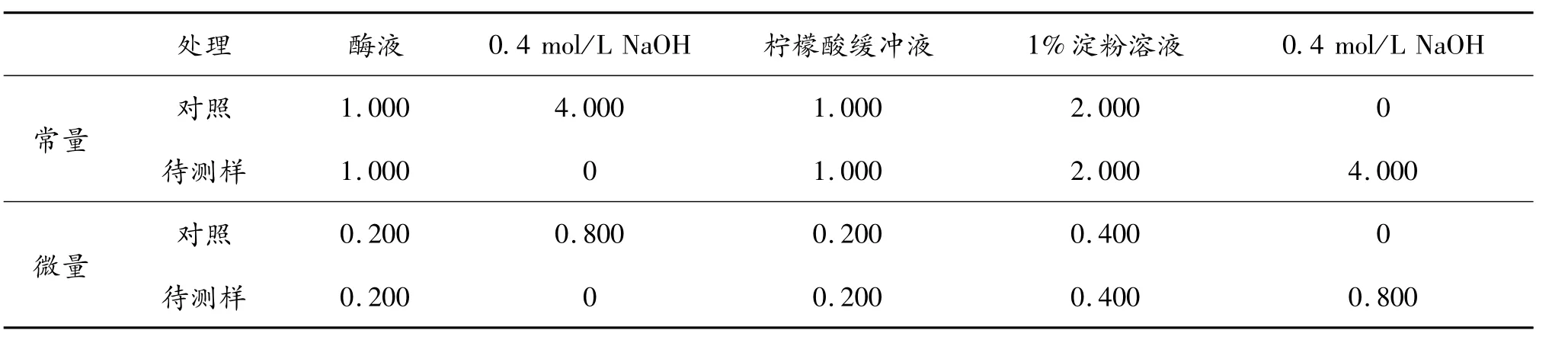
表1 常量和微量酶促反应的试剂用量对比
1.2.2.3 显色反应
待测样:取上述酶促反应液于试管中,加入3,5-二硝基水杨酸,沸水浴5 min。取出冷却,蒸馏水稀释。利用可见分光光度计测定520 nm下的吸光度。其中,常量试剂中,酶促反应液和DNS各2.0 mL,稀释至24 mL;微量试验中,2种试液分别加入0.5 mL,稀释至6 mL;标准液:取7支试管,分别加入葡萄糖标准液(1 g·L-1),再向各试管中加水定容。然后加入3,5-二硝基水杨酸,沸水浴5 min。取出冷却,蒸馏水稀释。利用紫外可见分光光度计测定520 nm下的吸光度。标准样常量和微量显色反应的实际用量见表2。

表2 标准样常量和微量显色反应的实际用量对比
1.2.2.4 样品中葡萄糖含量的计算
以标准样中葡萄糖含量为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程。将待测样的吸光度代入方程,求得待测样的葡萄糖含量,折算成1 mL粗酶液中葡萄糖的含量及酶活力。淀粉酶活力=浓度×体积×1000×稀释倍数/时间。其中,浓度单位为g/L,酶活力单位为μg/min。
2 结果与分析
2.1 枯草芽孢杆菌的筛选结果
筛选了5株产酶活性较高的菌株,分别为枯草6,枯草8,枯草11,枯草13,枯草14,其水解圈直径(H)与菌落直径(C)比值见表3。

表3 5株枯草芽孢杆菌菌落水解圈直径与菌落直径比值
由表3可以看出,枯草13菌株形成的比值最大,产酶活力较高,因此选定枯草13作为筛选结果。
2.2 淀粉酶活性常量和微量测定结果
2.2.1 标准曲线在常量和微量方法中的对比
以葡萄糖为标准样进行显色反应,常量测定法和微量测定法所测的吸光值及标准曲线的回归方程和相关系数见表4。
标准曲线试验方法规定,R2相关系数达到0.99的回归方程才可使用。从表4可以看出,采用常量和微量试验方法建立的标准曲线,其相关系数均在0.99以上。说明采用微量法获得的标准曲线是可以利用的。
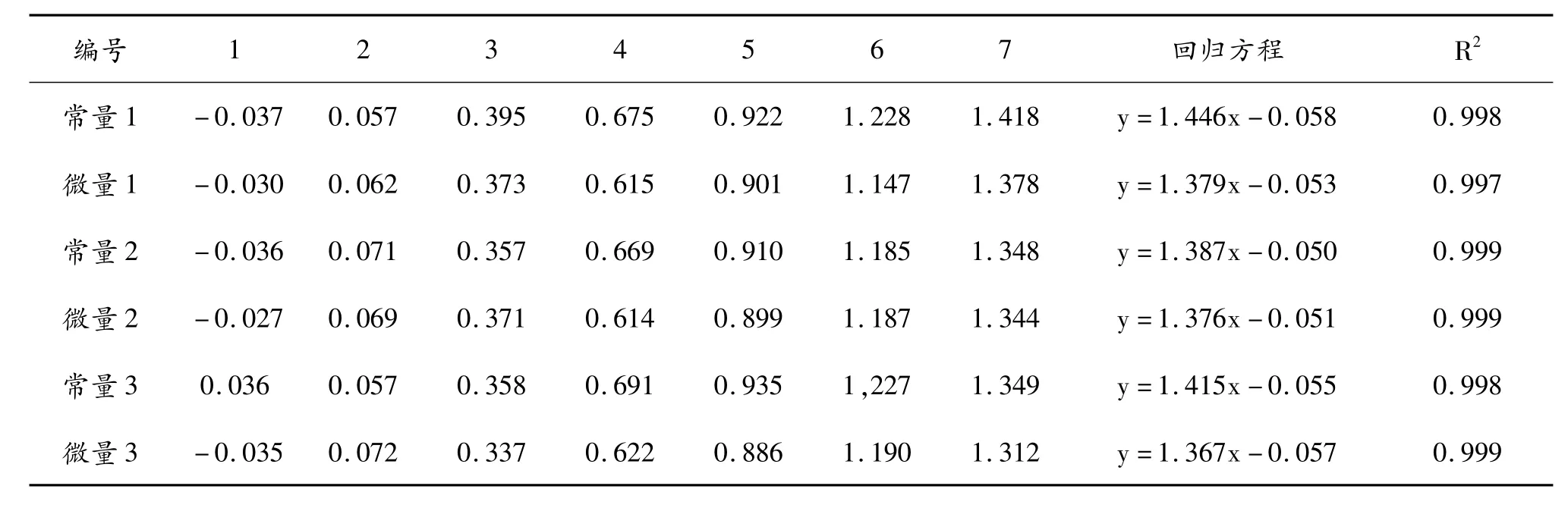
表4 标准曲线的常量和微量对比
2.2.2 采用常量和微量法测定待测样品结果对比
常量标准曲线回归方程:
y=1.416x-0.054(R2相关系数为0.999)
微量标准曲线回归方程:
y=1.374x-0.054(R2相关系数为0.999)
以每个样品3次重复为样品,做3个平行。对其进行淀粉酶活性测定。具体实验结果见表5和表6。
常量、微量法测定的酶活力比较见表7。
由表7无法确定测定方法的差异,因此对两种方法所测酶活力进行方差分析,见表8。
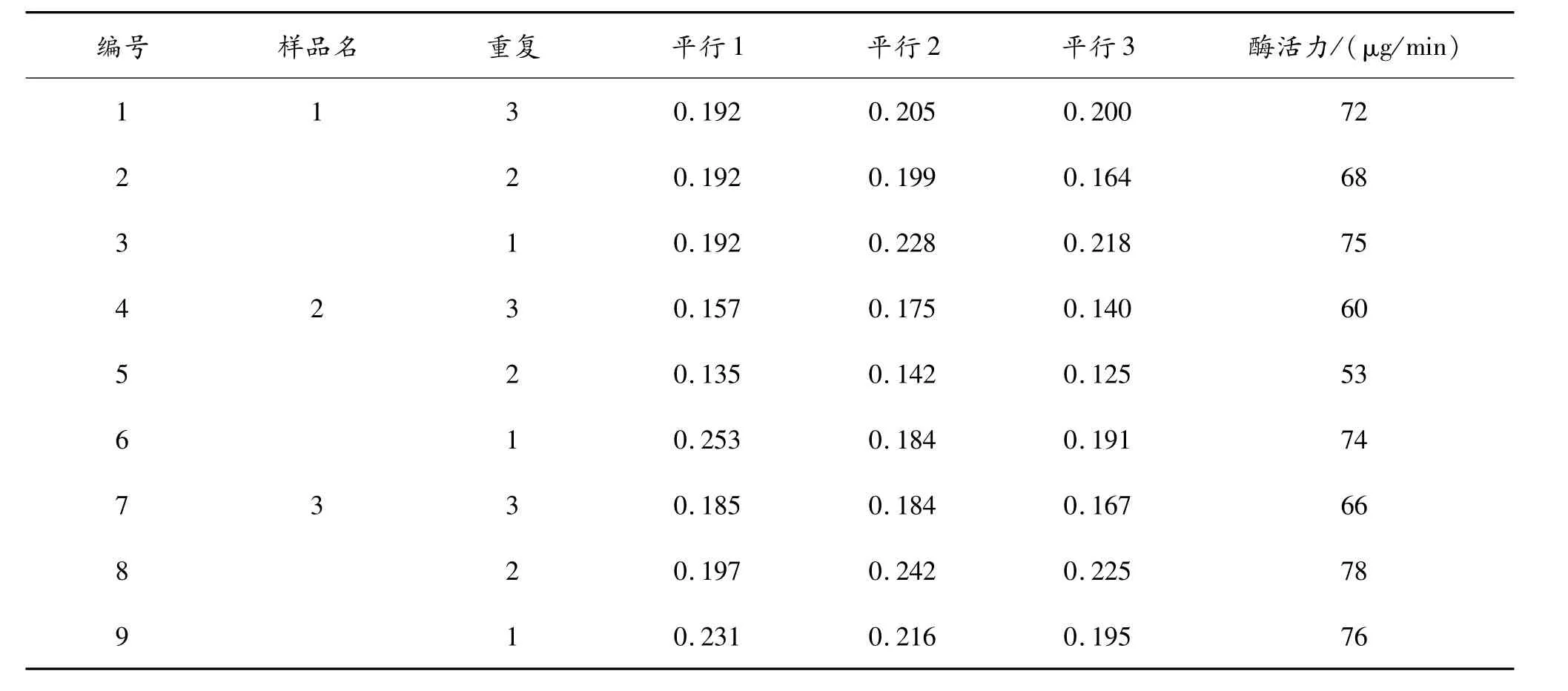
表5 待测样在常量试验中的数据分析
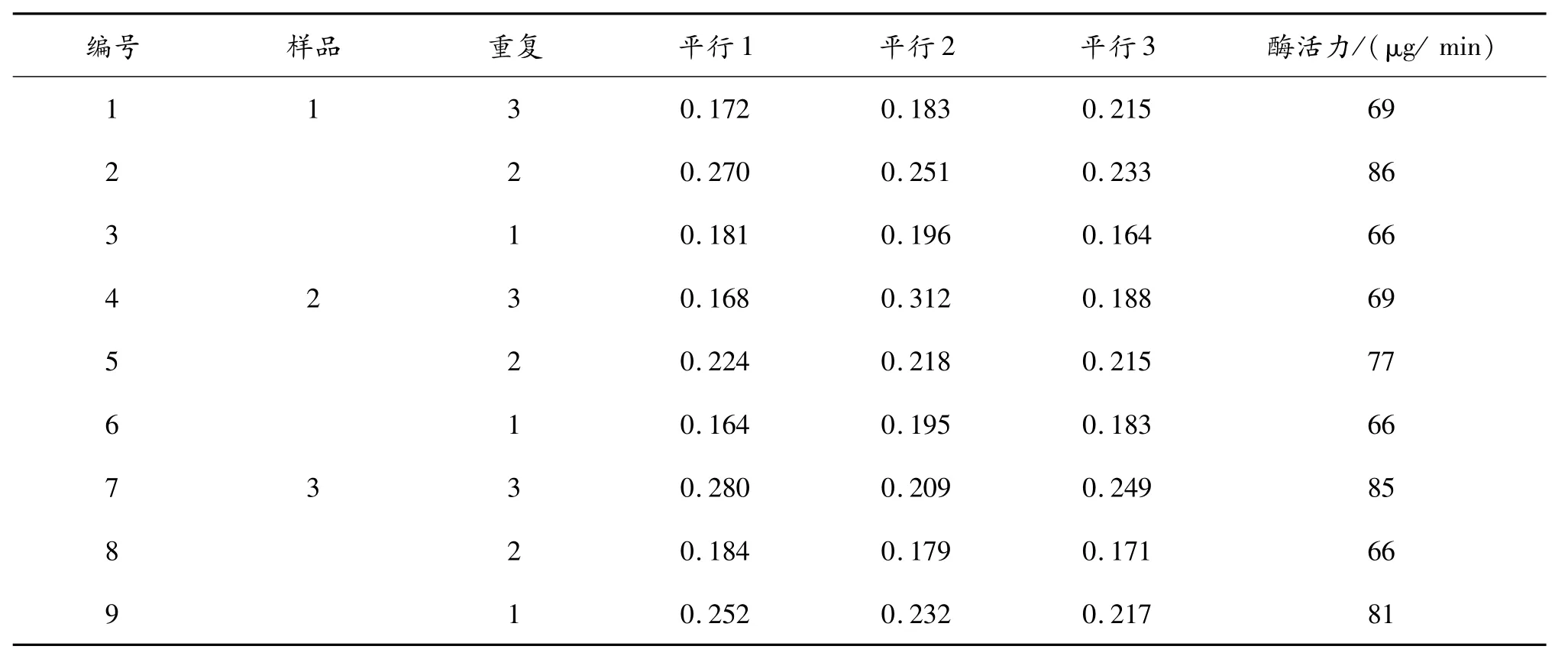
表6 待测样在微量试验中的数据分析
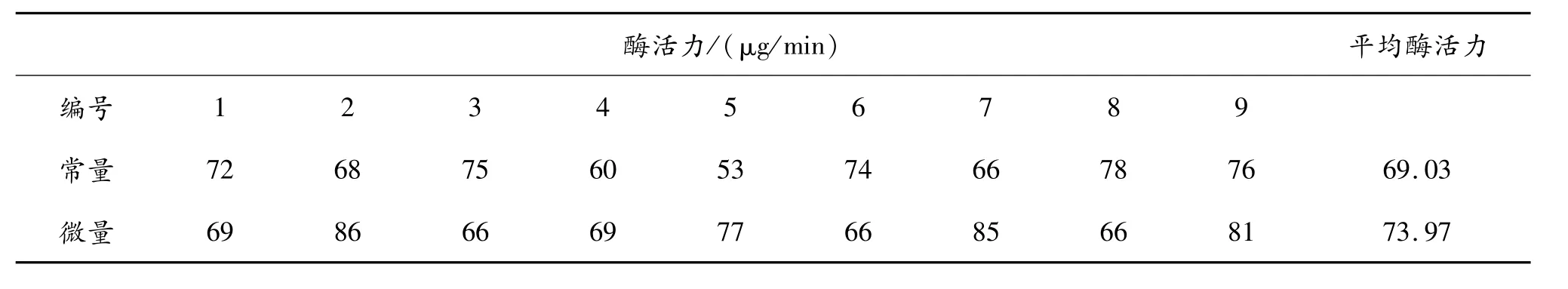
表7 常量、微量法测定酶活力的比较

表8 常量、微量法测定酶活力结果方差分析
由表8可以看出,F=0.77<F0.05=4.49,说明两种测定方法之间不存在明显差异,同时也可以判定这种差异是由实验误差引起的,不存在本质差异。因此,微量方法是可以代替常量方法进行淀粉酶活力测定的。
3 小结
从测定结果来看,微量测定法和常量测定法存在差异,但是差异不显著,因此可以用微量测定法代替常量测定法对淀粉酶活性进行测定,从而节约药品用量,降低测定成本。
[1]权淑静,马焕,解复红,等.淀粉酶高产菌株的筛选及发酵条件优化研究[J].河南科学,2011,29(10):1185-1189.
[2]柳辉,杨江科,闫云君.产α-淀粉酶菌株的分离、鉴定及酶学性质研究[J].生物技术,2007,17(2):34-37.
[3]张龙翔,张挺芳,李令媛.生化实验方法和技术[M].2版.北京:高等教育出版社,1997:463.
[4]王俊丽,聂国兴,曹香林,等.不同DNS试剂测定木糖含量的研究[J].食品研究与开发,2010,31(7):1-4.
[5]崔秀珍.试验统计与分析[M].北京:中国农业科学技术出版社,2009.
[6]管斌,谢来苏,丁友芳,等.枯草芽孢杆菌α-淀粉酶高产菌株的选育[J].浙江农业大学学报,1997,23(5):88-92.
[责任编辑:邓 渝]
Com parison between the M ethods for Constant M easurement and M icro Determ ination of Am ylase Activity
LILan,LEIXiao-dong
(Department of Bioengineering,Henan Institute of Science and Technology,Xinxiang 453003,Henan,China)
The bacterium bacillus subtiliswhich was produced from amylase and kept in the laboratory was treated as the starting strain.The strain with higher production of amylase was screened through the flat panel separation,dibbling and iodide fumigation.This experiment used the constants determination and the micro determination to determine the amylase activity and the data was analyzed by comparative analysis.The result showed that the difference of two methods for the determination of enzyme activity was not apparent,which proved that micro determination method could replaced the constant determination method.
bacillus subtilis;amylase;DNS;constantmeasurement;micro determination
Q946.5
A
1006-8481(2014)04-0033-05
2014-05-06
李兰(1972—),女,河南科技学院生物工程系高级实验师。
