六胜肽的固相合成
2014-02-09宋乃建郝迪娜
宋乃建,郝迪娜
(渭南师范学院化学与生命科学学院,陕西渭南714000)
六胜肽的固相合成
宋乃建,郝迪娜
(渭南师范学院化学与生命科学学院,陕西渭南714000)
采用多肽固相合成方法,全程在无水环境中,以Fmoc-保护基保护的α-氨基酸和氨基树脂为原料,经N-二异丙基乙胺(DIEA)、六氟磷酸苯骈三唑-1-基-氟基三吡咯烷基(PyBop)、1-氧-3-双二甲胺羰基苯骈三氮唑四氟化硼盐(TBTU)缩合,再用切割试剂把粗品从氨基树脂上切下来,得到目标粗肽,最后经纯化分离得到纯度在95%以上的目标肽。
六胜肽;多肽固相合成;Fmoc-氨基酸
随着人们对多肽类物质作用的研究,多肽的人工合成日益引起人们的广泛关注。1963年,美国著名生物化学家Bruce Merrifield发明了多肽固相合成法,自此之后,这一方法被广泛的应用于多肽和蛋白质的研究领域,尤其是短肽的合成。固相法合成多肽是多肽合成领域一个重大的突破,对化学、生化、医药、免疫分子微生物学等领域都起到了巨大的推动作用[1]。
六胜肽是由6个氨基酸组成的多肽,由于它能够减缓肌肉收缩的力量,让肌肉放松,减少动态纹的发生与消除细纹,因此,该多肽在化妆品行业有广阔的应用前景。芴甲氧羰基(Fmoc)方法是一种多肽固相合成的新方法,该方法是以Fmoc作为α氨基的保护基,Fmoc对酸稳定,易与碱作用,可以应用碱性化合物作脱保护剂[2],与本文的实验合成方法相符。本文采用Fmoc作为氨基酸的保护基,将目的肽的第一个氨基的羧基以共价键的形式与固体载体氨基树脂(Rink Amide MBHA Resin)相连,以形成产物Fmoc-Arg(pbf)-Rink Amide MBHA Resin为多肽合成的起点,在载体树脂上使要合成的多肽进行逐个延伸缩合接肽反应,最终合成ER-6-NH2肽链,将其酸解脱去树脂可得到目标产物的粗品,然后再对粗品进行鉴定和纯化可得到最终产品。
1 实验部分
1.1 主要原料和试剂
Fmoc-Arg(pbf)-OH(精氨酸)、Fmoc-Gln(trt)-OH(谷氨酰胺)、Fmoc-Met-OH(甲硫氨酸)、Fmoc-Glu(OtBu)-OH(谷氨酸)、AC(乙酸酐:吡啶=2∶1)(A.R.吉尔生化(上海)有限公司);DIEA(N-二异丙基乙胺)、PyBop(六氟磷酸苯骈三唑-1-基-氟基三吡咯烷基)、TBTU(1-氧-3-双二甲胺羰基苯骈三氮唑四氟化硼盐)、TFA(三氟乙酸)(A.R.吉尔生化(上海)有限公司);DCM(二氟甲烷)、乙醚、乙腈、乙酸乙酯(A.R.国内市售);DMF(N,N-二甲基甲酰胺)(上海巴斯夫);茚三酮、吡啶、DBLK(六氢吡啶)(中国医药集团上海化学试剂公司);苯酚(重庆北培精细化工厂);EDT(1,2-乙二硫醇)(美国Aldrich公司)。
1.2 主要仪器
SHK-循环水式多用真空泵(郑州科泰实验设备有限公司),TP-213电子天平C=10d(丹佛仪器(北京)有限公司),DHG-9070A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);工业氮(上海申中工业气体有限公司松氧充装站);GL-150B干式恒温器(江苏海门市其林贝尔仪器制造有限公司);LCMS ZQ2000 Waters液质联用仪(日本);RJ-TDL-40C台式低速大容量离心机(无锡市瑞江仪器分析有限公司);WH-866旋涡混合器(常州诺基有限公司);超声波清洗器(上海易净超声波清洗机厂);Delta600型液相色谱纯化系统(美国Waters公司)。
1.3 试验方法
1.3.1 合成路线这是反应的第一步,即氨基树脂与第一个氨基酸发生了脱水缩合反应,后面几个氨基的反应与此相同。
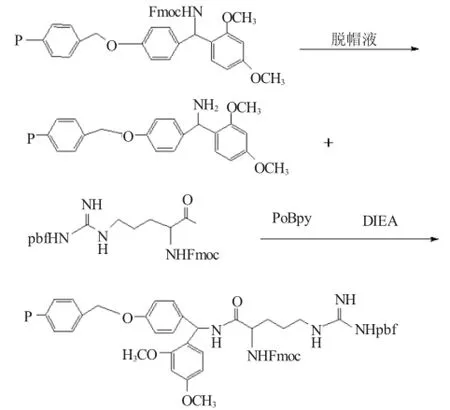
1.3.2 树脂的活化称取氨基树脂0.3g(合成目的肽为0.1mmol,所用的氨基树脂的活度为0.33mmol ·g-1,则所要称取的树脂量为0.1/0.33=0.3g)放入反应柱里面,然后在反应柱里面加入树脂高度3倍的DCM,用DCM将树脂溶胀30min,以活化待用。
1.3.3 去保护由于所用的树脂采用的是Fmoc合成机制,所以必须去保护(Fmoc)使α位上的氨基裸露出来,以便和下一个氨基酸上的羧基进行缩合反应。先用SHK-循环水式多用真空泵把反应柱中的DCM抽掉,然后加入DMF洗涤反应3遍,去除干净DCM,将洗涤液抽干净,加入去保护液(含20% DBLK的DMF溶液)高出树脂面1cm,鼓入N2反应5min,抽掉去保护液溶液,用DMF洗涤反应1遍,再加入去保护液反应10min,抽掉,用DMF洗6遍(保证DBLK完全清洗掉)。
1.3.4 固相上的接肽反应此实验方法的合成方向是羧基端(C)→氨基端(N),成肽所用的缩合剂为TBTU、DIEA或PyBop、DIEA的混合液,(投料是按3倍投的,即0.1mmol的树脂,投氨基酸的量为0. 1mmol×3=0.3mmol再乘以所要接氨基酸的相对分子质量除以1000),反应30min(反应时尽量不要使树脂漂浮在反应液表面)。接上第一个氨基酸Fmoc-Arg(pbf)-OH,去保护,然后以此方法依次接氨基酸Fmoc-Arg(pbf)-OH、Fmoc-Gln(trt)-OH、Fmoc-Met-OH、Fmoc-Glu(Otbu)-OH、Fmoc-Glu(Otbu)-OH。
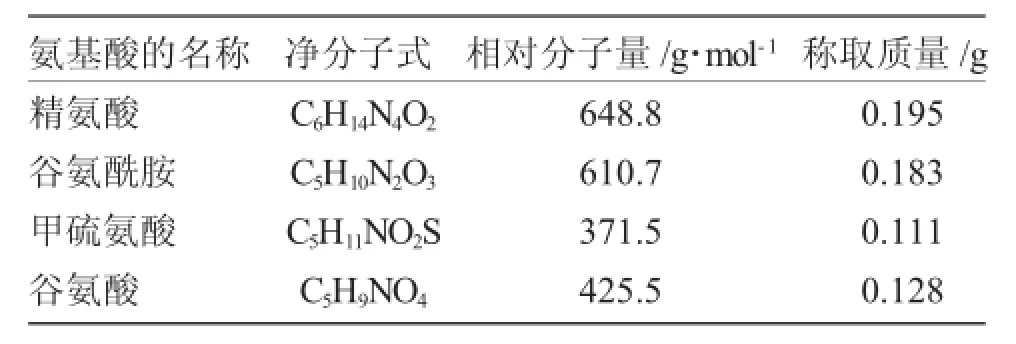
表1 实验中所用到氨基酸的情况Tab.1 Conditions of amino acid
1.3.5 AC的反应和肽的收缩AC是此条肽链的最后一个成份,在反应柱中加入乙酸酐2mL,吡啶1mL,此次反应只加入液体缩合剂DIEA,反应30min。AC接上后,整条肽的反应就完成了,进入最后的收缩阶段,AC没有Fmoc保护,所以不进行去保护。肽的收缩即:DMF洗涤反应3遍,DCM洗涤反应3遍,甲醇洗涤反应3遍,抽干肽树脂。
1.3.6 偶联时的检测用滴管取反应树脂少许(只要检测可辨别即可)与小试管中,加少许DMF洗净,倒掉(不可将树脂倒掉),再分别滴加茚三酮3D,50%苯酚3D,吡啶3D后,放入恒温箱(PV126℃SV127℃)中加热2.5min,取出观察溶液及树脂是否变色。
1.3.7 ER-6-NH2中树脂的切割经上述方法合成的六胜肽ER-6-NH2最终需要从树脂上切割下来。切割方法:往50mL圆底烧瓶中倒入5mL切割液(86%TFA+4%苯甲硫醚+5%EDT+3%蒸馏水+2%苯酚)溶液为暗黄色液体,封住烧瓶口放入恒温(30℃)振荡器中摇2h。将烧瓶中的液体倒入50mL离心管中,缓慢倒入乙醚,此时有发烟现象,封住离心管的口放入RJ-TDL-40C台式低速大容量离心机(2800r·min-1)中离心2min,倒掉上方浑浊液体。下方为白色固体。再加满乙醚封口,用旋涡混合器将50mL离心管内白色固体振散。放入RJ-TDL-40C台式低速大容量离心机(2800r·min-1)离心2min。此操作重复2次。用2mm毛细玻璃管取少量液体,移入5mL离心管,用胶头滴管滴入1D乙腈和1D水,放入超声波清洗器振荡5s(为了让其充分溶解)。再放入小型台式离心机离心2min。转速设定为1200r· min-1。用LCMSZQ-2000 Waters液质联用仪,进行检测。再将所合成的ER-6-NH2肽粗品半封口状态,放入干燥器干燥。
1.3.8 ER-6的鉴定合成的多肽粗品需要质谱进行鉴定是否含有所需的目标产物。本文采用LCMS ZQ-2000 Waters液质联用仪,进行检测鉴定,通过质谱图上所得的分子量与理论值的比较来确定产物。
2 结果与讨论
2.1 树脂的活化
载体树脂上有足够的位点,能使氨基酸以共价键的形式连在这些位点上。而树脂的保存是以干态保存的,反应时要用有机溶剂溶胀使其成为湿态,使这些位点成为网状结构,即树脂的活化,以便反应的充分进行。树脂的活化程度是根据其体积的变化来判断的,称取的干态树脂是粉末状的,在有机溶剂中随着时间的增加树脂的体积逐渐增大,开始渐渐漂浮在有机溶剂的表面,30min后体积基本不再变化,即树脂已经活化完全。在固相多肽合成过程中固相载体树脂的溶胀状况对缩合试剂及羧基组分的自由扩散,对肽链之间的聚集等与缩合反应有关的因素有明显的影响[5],树脂的溶胀越大,反应体系越接近于液相反应状态,有利于反应进行。
2.2 多肽链的延伸缩合
肽键的合成缩合剂有TBTU、PoByp、DIEA,它们有缩合效率高,反应速度快,不易发生消旋化反应,且不受氨基酸种类限制的优点[3,4]。对同种氨基酸加入不同的缩合剂进行反应,可得到的检测结果见表2。
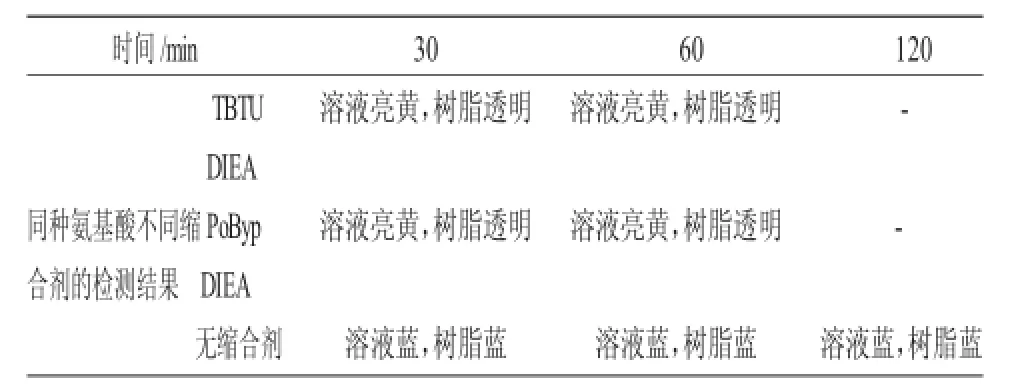
表2 不同缩合剂对同种氨基酸反应的影响Tab.2 Effect of different condensation agent on same amino acid
从表2可以看出,使用缩合剂明显缩短了反应的时间,这样有利于此肽的工业生产。
2.3 自由氨基的检测
在氨基酸每步合成后需要对氨基酸的缩合程度进行检测,保证多肽有较高的合成效率,每次检测中,如果结果是溶液亮黄,树脂透明,说明已经基本上没有自由氨基的存在,缩合反应完全,可进行下个氨基酸的反应。
如果结果是溶液暗、蓝或者杂,树脂呈蓝色、黑色、红色或者杂,则说明仍有自由氨基的存在,缩合不完全,且颜色越深说明自由基存在的越多。此时可能的原因:(1)反应时忘记加液体缩合剂或者缩合剂加少了,给反应柱里面加入液体缩合剂,延长反应时间15min再次检测,直到检测溶液亮黄,树脂透明;(2)是浮在溶液表面,导致氨基酸和树脂不能充分接触,用搅拌棒轻轻搅拌,搅拌时搅拌棒不能碰到反应柱的底部,使漂浮在有机溶剂表面的树脂融入反应液中,保证树脂与氨基酸的充分接触,延长反应时间直到检测溶液亮黄,树脂透明;(3)反应时间过短,反应进行的不完全,此时可以再反应段时间检测直到检测溶液亮黄,树脂透明;原因四是检测时滴加检测液不规范,检测时滴加每种3D要尽量准确,过多过少都会影响颜色的判断,再重新取树脂进行检测。如果以上原因都不是导致缩合反应不完全的原因,可以抽掉,用DMF洗3遍,换种固体缩合剂重新投料。
2.3.1 时间对多肽反应的影响反应时间是一个反应的重要部分,它直接影响着一个反应的成败。表3为本实验中时间对反应影响的探讨。

表3 反应时间对反应的影响Tab.3 Effect of reaction time on reaction
由表3可以看出,反应在进行30min后,时间对检测结果已经基本没有影响,说明已基本不存在自由基,可以看作反应已经进行完成。
2.4 接第一个氨基酸Fmoc-Arg(pbf)-OH的反应
本实验在接第一个氨基酸Fmoc-Arg(pbf)-OH时,用的是固体缩合剂TBTU和液体缩合剂DIEA,反应后检测出溶液亮黄,树脂红。分析原因认为液体激活剂加的少了,然后再加入1mmol的DIEA延长反应15min后检测,现象同上,这个原因可以排除。还有原因可能是氨基树脂接的第一个氨基酸不适合用固体缩合剂TBTU,然后抽掉,用DMF洗涤3次,复投用固体缩合剂PoByp和液体缩合剂DIEA进行反应,检测结果为溶液亮黄,树脂透明,接完第一个氨基酸后,后面的都用缩合剂TBTU和PoByp,反应正常完成。
2.5 质谱鉴定分析
合成的多肽用质谱法进行鉴定,它可以得到合成的多肽的实际分子量。分析条件是进行完切割后,直接对其进行分析。分析所得的质谱图1。
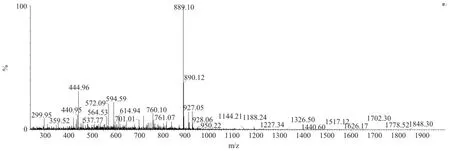
图1 质谱分析鉴定图Fig.1 Mass chromatogram
由图1可得到合成多肽的实际分子量为889.10,此条多肽的理论分子量为889.99,当实际分子量与理论分子量相差在正负1之间时,就认为所合成的肽为正确的,即两个相一致,说明合成的即为目的肽的粗品。
2.6 HPLC分析
本文采用Delta600型液相色谱纯化系统,色谱分析条件:C18,反相,4.6mm×250mm梯度洗脱梯度从5%A+95%B到30%A+70%B时间是30min,流速为1.0mL·min-1。紫外检测波长为220nm,流动相A为0.1%三氟乙酸在100%乙腈,流动相B为0.1%三氟乙酸在100%水。得到见图2。
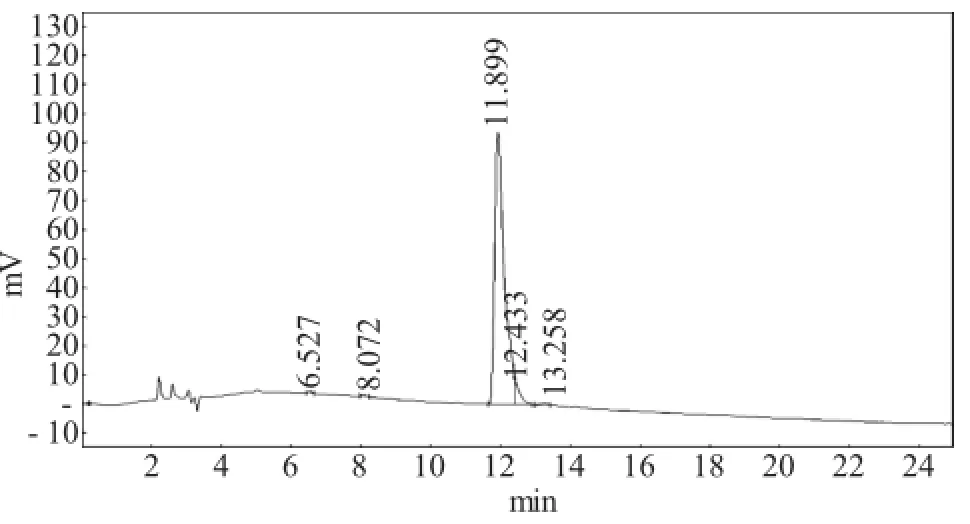
图2 纯化多肽的液相色谱图Fig.2 Liquid chromatogram of purified polypeptide
产物经反相高效液相纯化后,经分析确定最高峰为面积最大峰,即此处为产物可达到的纯度,从图2可看出,此条肽的纯度可达到95.23%以上。
3 结论
本实验中氨基酸的缩合剂为TBTU、DIEA或PyBop、DIEA的混合,有效的提高了缩合效率。合成完全后,切割试剂可有效切除与多肽相连的树脂和氨基侧链的保护基,保证了目的肽的得到。切割后得到目标肽的粗品,经反相高效液相纯化后产物的最终纯度可达到95.23%以上,与最初的合成目标相符,说明此次的合成是有效的。
[1]韩香,顾军.固相法在多肽合成领域的应用[J].药学进展,2002, 28(1):10-13.
[2]陈心,罗素兰,张本,等.多肽固相合成的研究进展[J].生物技术, 2006,16(1):81-82.
[3]白泉,葛小娟,耿信,等.反相液相色谱对多肽的分离、纯化与制备[J].分析化学研究简报,2002,30(9):1126-1129.
[4]LI PENG,XU JIE-CHENG.Studies of Novel and Highly Efficient Peptide Coupling.Reagents[J].Journal ofthe Graduated School of the Chinese AcademyofScience,2004,7(32):927-929.
[5]Pugh K.C.York E.J.Stewart J.M.,Int.J.Peptide Protein Res.[J].1992,40(3-4),208-213.
Synthesis of acetyl hexapeptide-3 with the solid phase method
SONG Nai-jian,HAO Di-na
(College of Chemistry and Life Science,Weinan Normal University,Weinan 714000,China)
Acetyl Hexapeptide-3 was synthesized with alpha amino acids and amino resin protected by fmocbased group,which condensed with DIEA,PyBop,TBTU successivelywith the solid phase peptide synthesis method in whole anhydrous environment.The crude product was cleaved from the amino resin by cleavage agent, then was purified to obtain the target peptide with the purity of 95%.
acetyl hexapeptide-3;solid phase peptide synthesis;Fmoc-amino acid
TQ658
A
1002-1124(2014)10-0073-04
2014-09-11
宋乃建(1979-),男,河南商丘人,硕士研究生,讲师,研究方向:化工生产及过程控制。
