电针对坐骨神经损伤大鼠神经生长导向因子Slit1的影响❋
2014-02-09王瑞辉王孟林张晓芹
杜 旭,王瑞辉,王孟林,张晓芹,胥 冰,胡 薇
(陕西中医学院,陕西 咸阳 712046)
周围神经损伤是指周围神经干或其分支受到外界直接或间接力量作用而发生的损伤,属中医“痿证”范畴,临床上已属于针灸病谱中神经系统的第三大疾病[1]。显微外科修复手术、细胞移植等技术,激素、神经生长因子等药物的应用,均不能使本病的神经功能恢复达到理想状态[2]。而大量研究表明,电针疗效显著,能明显提高本病患者患肢肌力,促进功能恢复,减轻后遗症[3~7],其机理尚未完全阐明。周围神经损伤后的修复再生是一个极其复杂的过程,其关键是轴突的再生修复,而损伤的轴突须赖神经生长导向因子的引导,向正确的方向和途径延伸,才能准确伸入相应靶器官,最终完成再生修复。本文将观察其中一种导向因子-Slit1在电针治疗下的动态变化,以期为电针治疗周围神经损伤提供科学的实验依据。
1 材料与方法
1.1 动物与分组
实验动物采用SD大鼠72只,雌雄各半,每天体质量200±20g,由西安交通大学实验动物中心提供。按随机数字表法分成正常组、模型组和治疗组各24只。
1.2 仪器与试剂
兔抗鼠Slit-1多克隆一抗(Santa Cruz Biotechnology)、SP免疫组化试剂盒(北京博奥森生物技术有限公司)、RT-PCR试剂盒(大连宝生物工程有限公司)、G6805- C型电针机(上海华谊医用仪器有限公司)。
1.3 模型制作
动物用10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉。行右后肢背侧纵切口,无菌条件下暴露并游离坐骨神经,于梨状肌下10 mm处将其锐性横断,两断端用10~0显微缝合丝线端对端缝合外膜3针,保持吻合口无张力,最后分层缝合肌肉和皮肤。
1.4 处理方法
治疗组动物造模后第2天,取“环跳”(后肢髋关节后上缘)、“足三里”(膝关节后外侧,腓骨小头下约5 mm),0.19 mm×10 mm针灸针进针0.5 mm后进行电针治疗(疏密波,5 Hz,强度以肌肉出现轻微抽动为度),每天1次,每次15 min,7 d为1个疗程,共治疗3个疗程;模型组不做治疗,但与治疗组同样进行动物抓取;正常组不做任何处理。
1.5 标本制备
分别于第1~3疗程结束后当天,将各组中8只大鼠用过量水合氯醛经腹腔注射深度麻醉,开胸从左心室插管至升主动脉,先快速灌注生理盐水约100 ml,随后灌注含4%多聚甲醛的磷酸缓冲液300 ml,持续30 min。快速切开,暴露坐骨神经损伤区和相应节段脊柱区,严格无菌操作下取出坐骨神经(缝合处近、远端各约1 cm,共约2 cm)和相应节段脊髓(L4-L6段,约2 cm)组织。
1.6 免疫组化检测
将所取组织置于4%多聚甲醛磷酸缓冲液内固定24 h,常规石蜡包埋,连续纵(坐骨神经)、横(脊髓)切片(片厚5 μm)。采用SP法常规染色。每组8例,每例检测3张切片,采用Zeiss ImergerA1显微镜和DXM1200F CCD图像采集系统观察并照相,光镜下Slit1阳性反应物为突出背景的棕黄色颗粒,用图像分析系统 Image-Pro Plus5.1 测定其积分光密度。
1.7 RT-PCR检测
将所取组织用冰冻生理盐水冲洗后迅速置于液氮中,后转至-80 ℃冰箱保存。登录http://www.ncbi.nlm.nih.gov获得Slit1全序列,Primer5设计相应特异性引物,由北京奥科鼎盛生物科技有限公司合成。slit1上游引物序列:5’- TGTGAAGCACGACTGTGTCA -3’;下游引物序列:5’- TAGCCCTCAGCACAGAGACA -3’,扩增长度312bp。内参β-actin上游引物序列:5’- TCAGGTCATCACTATCGGCAAT -3’;下游引物序列:5’- AAAGAAAGGGTGTAAAACGCA-3’,扩增长度432bp。首先用Trizol抽提总mRNA,以逆转录(RT法)先合成cDNA,然后再进行PCR扩增,反应条件:94 ℃先变性5 min,然后94 ℃30 s,60 ℃45 s,72 ℃40 s,30个循环,最后72 ℃10 min。RT-PCR产物电泳后用JS-680C全自动凝胶成像系统(上海培清)分析扫描,经SensiAnsys凝胶图像分析软件对每个电泳条带进行光密度值测定,将测定的光密度值与相应内参光密度值比较,所得比值作为Slit1mRNA相对表达水平的参数。
1.8 统计学方法
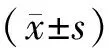
2 结果
2.1 免疫组化检测结果
模型组与正常组比较,大鼠损伤坐骨神经和相应脊髓段(L4-L6)中Slit1蛋白积分光密度在第1疗程后达到高峰之后逐渐降低,但仍高于正常组,差异有统计学意义(P<0.01),说明坐骨神经损伤后坐骨神经和相应脊髓段中Slit1 蛋白表达增加,高于正常水平。治疗组与模型组比较,除第3疗程后脊髓相应段中的差异有统计学意义外(P<0.05),有同样的趋势,说明电针治疗能明显增强损伤坐骨神经和相应脊髓段中Slit1蛋白的表达(见表1、图1、图2)。
2.2 RT-PCR检测结果
模型组与空白组比较,大鼠损伤的坐骨神经和相应脊髓段(L4-L6)中Slit1 mRNA /β-actin mRNA光密度比值在第1疗程后达到高峰之后逐渐降低,但仍高于空白组,差异有统计学意义(P<0.01),说明坐骨神经损伤后坐骨神经和相应脊髓段(L4-L6)中Slit1mRNA表达增加,高于正常水平。电针组与模型组比较,有同样的趋势,说明治疗能明显增强损伤的坐骨神经中Slit1mRNA的表达(见表2、图3、图4)。
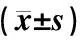
表1 各组大鼠各时间点坐骨神经和脊髓(L4-L6)Slit1蛋白积分光密度(IOD)比较
注:与正常组比较:▲▲P<0.01;与模型组比较:★P<0.05,★★P<0.01
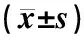
表2 各组大鼠各时间点坐骨神经和脊髓(L4-L6)Slit1/β-actin mRNA光密度(OD)比值比较
注:与正常组比较:▲▲P<0.01;与模型组比较:★★P<0.01

图1 各组坐骨神经Slit1蛋白的表达(免疫组化)
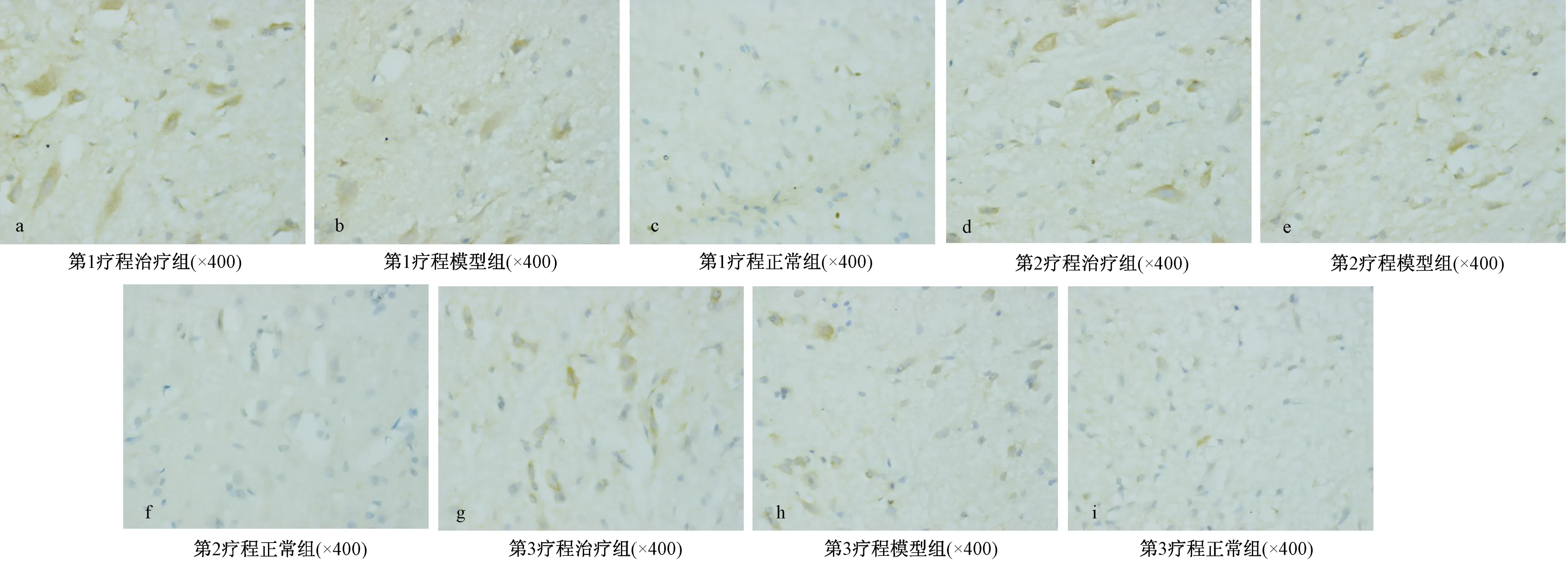
图2 各组脊髓(L4-L6)Slit1蛋白的表达(免疫组化)

图3 各组坐骨神经Slit1mRNA的表达(RT-PCR)注:A.第1疗程结束后;B.第2疗程结束后;C.第3疗程结束后;1.正常组;2.模型组;3.治疗组
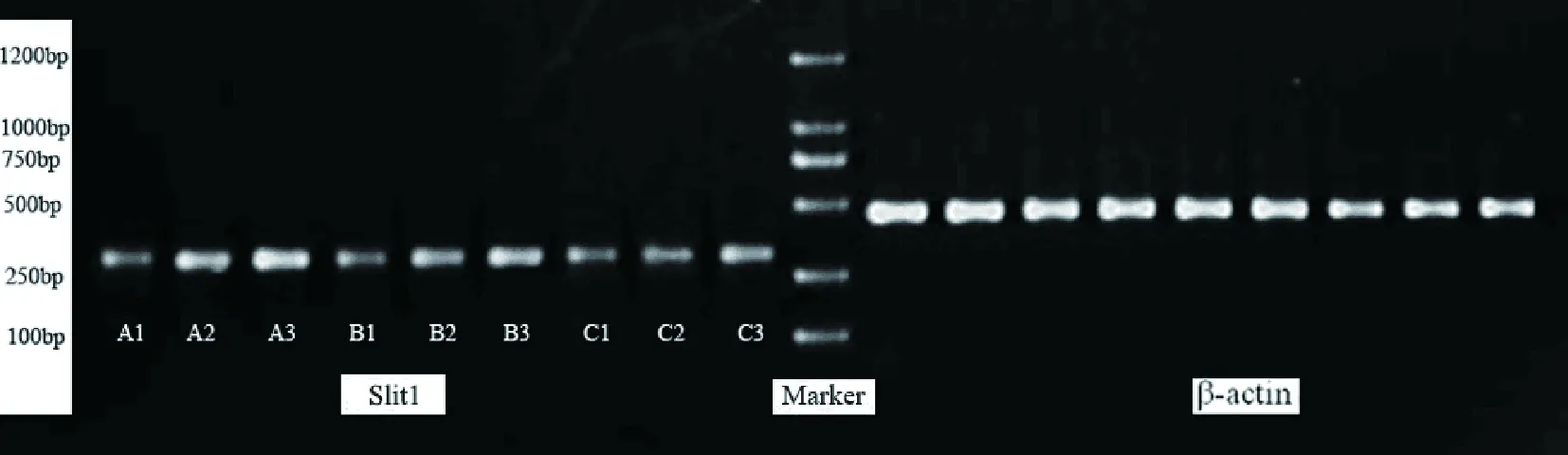
图4 各组脊髓(L4-L6)Slit1mRNA的表达(RT-PCR)注:A.第1疗程结束后;B.第2疗程结束后;C第3疗程结束后;1.正常组;2.模型组;3.治疗组
3 讨论
自1928年Cajal就提出“神经趋向性”(neurotropism)概念直至上世纪90年代中后期。现已证实,有4种重要的轴突生长导向分子家族,即Netrins、Slits、Semaphorins和Ephrins[8],可分为吸引性因子和排斥性因子两类。它们通过接触吸引、接触排斥和化学吸引、化学排斥来调节轴突靶向生长,最终导致轴突内细胞骨架的重排,实现对生长锥延伸的精确引导,即轴突引导(axon guidance)[9]。Slits为代表性的排斥性因子,分子量170~190 KD,主要由胚胎脊髓联合纤维发育期中枢中线底板处星形胶质细胞分泌[10]。在哺乳动物中,Slit1、Slit2在神经系统中表达广泛,Slit3则存在于海马,其受体Roundabou(Robo)在神经元轴突上表达。Slit蛋白具有排斥运动神经元轴突和促进感觉神经纤维分支和延伸的双重作用,性质取决于其本身和受体[11]。Slit可以和表达于轴突表面即原生质胞膜上的Robo结合,引起一系列信号传导,最终导致细胞骨架的重排,引导生长锥延伸至正确的方向[12~15]。已有学者认为,Slit对感觉神经元周围突起的作用比中枢突更为敏感[16]。可见,生长锥的导向就是神经再生和发育最为关键和精细的环节之一,高度敏感的生长锥是神经再生的真正前沿。迄今为止,未见PubMed及国内有电针治疗周围神经损伤是否影响Slit表达的论文发表。
本证属于中医学“痿证/病”范畴,病机主要以气血不足、营卫不调为主,临床治疗以“治痿独取阳明”为原则。故本实验选足少阳胆经的“环跳”和足阳明胃经的“足三里”穴,因为“环跳”是足少阳胆经与足太阳膀胱经的交会穴,是治疗下肢痿痹的要穴;“足三里”是胃经合穴、下合穴,也是治疗下肢痿痹、半身不遂等经络痹阻病症的要穴,即“治痿独取阳明”。研究表明,针刺治疗坐骨神经痛使用频次最高的为环跳,足三里频次也极高[17];电针“环跳”和“委中”能有效减少神经病理性痛大鼠脊髓相应节段脊髓兴奋性氨基酸递质的释放,促进抑制性氨基酸递质的释放[18];电针能明显改善结扎坐骨神经造成慢性压迫性损伤大鼠的痛敏状态,显著降低损伤侧脊髓背角胶质纤维酸性蛋白(GFAP)活性和促炎性细胞因子肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)mRNA的表达[19]。因此,本实验选取此两穴配合使用,以疏调经络之气、活血止痛,促进周围神经损伤再生与修复并探究其可能的机制。
本实验结果表明,SD大鼠坐骨神经切断即刻外膜端对端缝合后应用电针治疗,在3个疗程(7 d、14 d、21 d)结束后,损伤的坐骨神经和相应脊髓段(L4-L6)中Slit1 蛋白及其mRNA表达,除第3疗程后脊髓相应段中外,其他差异均有统计学意义。说明电针治疗可能就是通过增强损伤坐骨神经和相应脊髓段中Slit1蛋白及其mRNA的表达来实现临床治疗作用。但如何影响Slit1蛋白及其mRNA的表达则是一个非常复杂的问题,应与其受体Robo有关,可能还牵涉到其他神经营养因子等影响轴突、神经修复再生的众多因素及复杂的相互关系,还缺乏全面、综合的研究。最新研究表明,大鼠坐骨神经横断伤(SNT)后Robo1、Robo2mRNA和Robo1在背根神经节中第3天表达开始增强,高峰在第7天至第14天之间,第21天后回归低水平,这提示Robo1 通过在SNT后的上调来调节生长锥迁移,促进轴突生长和神经纤维的延伸[20]。这与本实验结果基本一致,而电针对Robo1、Robo2mRNA是否有影响就值得进一步探究。总之,电针能促进Slit1蛋白及其mRNA的表达,可能是其促进周围神经损伤修复再生的一个方面,其具体机制则需进一步的研究,最终将为全面揭示电针治疗周围神经损伤提供新的科学依据。
[1] 杜元灏.现代针灸病谱[M].北京:人民卫生出版社,2009:82.
[2] Shai Luria MD, Thana pong Waitayawinyu MD, James Conniff BA, et al. Glatiramer acetate immune system augmentation for peripheral nerve regeneration in rat crushed sciatic nerve model [J].J bone Joint Surg Am,2010,92:396-403.
[3] 王雪冰,蒋拥军,陈佳旭,等. 电针配合康复训练治疗上肢周围神经损伤疗效观察[J].上海针灸杂志,2011,30(9):604-606.
[4] 李海燕.电针为主综合治疗周围神经损伤19例[J].山东中医杂志,2010,29(2):105.
[5] Gordon T, Chan KM, Sulaiman OA, et al. Accelerating axon growth to overcome limitations in functional recovery after peripheral nerve injury[J]. Neurosurgery,2009,65(4 Suppl):A132-144.
[6] 袁广宇.电针加康复治疗周围神经损伤临床观察[J].上海针灸杂志,2008,27(9):9-10.
[7] 袁广宇,苗小军,王培霞.针加康复治疗膝总神经损伤86例疗效观察[J].中国实用神经疾病杂志,2008,21(8):35-36.
[8] Dickson BJ, Senti KA. Axon guidance: growth cones make an unexpected turn[J].CurrBiol,2002,12:218-220.
[9] Li HS,Chen JH, Wu W et al. Vertebrate Slit, a secreted ligand for the transmembrane protein roundabout,is a repellent for olfactory bulb axons[J].Cell,1999,96:807-818.
[10] Brose K, Bland K, Wang KH, et al. Slit proteins bind robo receptors and have an evolution- aryly conserved role in repulsive axon guidance.[J].Cell,1999,96:795-806.
[11] Mambetisaeva ET, Andrews W, et al. Robo family of proteins exhibit differential expression in mouse spinal cord and Robo-Slit interaction is required for midline crossing in vertebrate spinal cord[J].Dev Dyn,2005,233(1):41-51.
[12] Wu W, Wong K, Chen JH, et al. Directional guidance of neuronal migration in the olfactory system by the protein slit[J].Nature,1999,400:331-336.
[13] Wang KH, Brose K, Arnott D, et al. Biochemical purification of a mammalian slit protein as a positive regulator of sensory axon elongation and branching[J].Cell,1999:771-784.
[14] Seita Hagino, Ken Iseki, Tetsuji Mori, et al. Slit and glypican-1 mRNAs are coexpressed in the reactive astrocytes of the injured adult brain[J].Glia,2003,42:130-138.
[15] Keleman K,Rajagopalan S,Cleppien D, et al. Comm sorts Robo to control axon guidance at the Drosophila midline[J]. Cell,2002,110:415-427.
[16] Nguyen-Ba-Chvaret KT,Chedoatl A. Role of Slit Proteins in the vertebrate barin [J]. Physiolog-Paris,2002,96(l-2):91-98.
[17] 赵玲,陈少宗.针灸治疗坐骨神经痛的取穴处方决策与经验统计[J].针灸临床杂志,2011,27(10):46-48.
[18] 闫丽萍,吴辛甜,殷忠勇,等.电针对坐骨神经慢性压迫性损伤大鼠脊髓氨基酸类递质水平的影响[J].针刺研究,2011,36(5):353-357.
[19] 孙涛,崔承斌,罗建刚,等.电针对神经病理性疼痛大鼠脊髓胶质纤维酸性蛋白活性及肿瘤坏死因子-α和白介素-1β表达的影响[J].针刺研究,2010,35(1):12-16.
[20] Zheng L F, Zheng S J, Ma Z J, et al. Up-regulation of Robo1 in dorsal root ganglia after sciatic nerve transection in rats[J]. African Journal of Biotechnology,2012,11(2):483-489.
