耳甲部电针刺激对肥胖大鼠摄食和脂肪代谢的影响❋
2014-02-09冉红星唐青青王茵萍
冉红星 ,唐青青 ,王茵萍
(南京医科大学第一附属医院针灸科,南京 210029)
肥胖是许多疾病的发病基础,也是肿瘤的危险因素,已被世界卫生组织定义为1种疾病[1]。肥胖的发生是由于机体热量的摄入大于消耗,造成体内脂肪堆积过多。对于肥胖的治疗措施,基本上从控制能量的摄入(摄食调节)和增加能量的消耗(脂肪代谢)两方面进行研究。治疗肥胖的非手术治疗如锻炼、节食、应用各种减肥药物等长期效果不理想且存在反弹。手术因其严格的适应症和并发症限制了临床上的广泛应用,因此迫切需要微创或者无创手段来解决肥胖问题。迷走神经刺激疗法(vagal nerves stimulation,VNS)可以改变摄食行为,减轻体质量[2]。但由于迷走神经刺激是入侵式的治疗方式,其高额的手术费用,并具有一定的手术风险。有学者发现,人体外耳廓的耳甲艇和耳甲腔存在较为密集的迷走神经,据此创造性地将传统耳针疗法与现代西方医学原理有机结合,提出耳甲部电针刺激术。本研究以食物所致肥胖鼠(dietary induced obesity,DIO) 为模型,选择刺激参数进行耳甲部电针刺激(electro-acupuncture stimulation of auricular concha region,EA-ACR) ,评估其对肥胖鼠体质量、摄食、脂肪代谢的影响。
1 材料与方法
1.1 动物与分组
60只雄性清洁级4周龄SD大鼠(购于上海斯莱克动物实验有限公司)独笼饲养,所有动物均在22±2 ℃、55±10%湿度、12 h昼夜(7 am~7 pm)变化环境中,自由饮食、饮自来水,实验时间为2012年7月24日至2012年11月20日。
动物适应性饲养1周后,按随机数字表法抽取10只作为空白对照组并给予普通饲料喂养,其余50只给予高脂食物喂养,自由进水,连续喂养8周。每周测量体质量和日摄食量1次。8周后根据对照组体质量的平均数,高脂喂养大鼠体质量高于其平均数10%的大鼠用于实验研究,其余剔除出实验。最后高脂喂养大鼠剩余36只,按随机数字表法分成模型组、耳甲电针刺激组和非耳甲电针刺激组,每组各12只。高脂饲料由上海莱克动物实验有限公司配制,饲料热量分布为蛋白质29.5%,脂肪45.6% ,糖类24.9%,总热量349 Kcal/100 g(1 cal=4.18 J)。
1.2试剂和仪器
戊巴比妥钠(Merck Drugs﹠Biotechnology,德国)、华佗牌0.38 mm×13 mm 不锈钢无菌毫针(购自苏州医疗用品有限公司)、韩氏电针仪/韩氏镇痛仪(HANS-100型)、鼠笼(宁波迈达医疗仪器有限公司)。
1.3 实验方法
1.3.1 耳甲部电针刺激组穴位选择 啮齿类动物迷走神经在耳廓上的分布和人类耳廓相似,迷走神经耳支在耳廓上主要支配耳甲艇和耳甲腔[3]。耳甲部电针刺激组选择的刺激点位于耳甲的2个反射区:胃区(位于耳轮脚消失处,耳穴国标图中的耳甲4区)和小肠区(位于耳甲艇,耳穴国标图中的耳甲6区)。实验过程中具体刺激点如图1所示。
1.3.2 非耳甲部电针刺激组位置选择 选取大鼠双侧臀部,位于大鼠骶骨和股骨大转子连线上中点下1 cm处,同侧安置2枚电极。
1.3.3 电针刺激方法 耳甲部电针刺激组在大鼠双侧耳甲腔和耳甲艇[3]各安置2枚刺激电极,同侧2枚电极连接到同一个刺激器上。非耳甲部电针刺激组大鼠选取双侧臀部各安置2枚电极。电针刺激参数:2/15 Hz、2 mA、30 min/d(HANS-100型),连续刺激6周。电针刺激过程中大鼠始终保持安静、无挣扎、嘶鸣等症状。
1.3.4 取材步骤 ①大鼠禁食12 h,给予2 g固体食物让其自由进食10 min,120 min后脱颈处死,取出胃体沿胃大弯剪开,取出胃内剩余固体食物,烘干后测量胃内残留物重量,计算胃内残留物占进食量2 g的百分比为胃内残留率;②其次分离睾周脂肪、肾周脂肪、肩胛部棕色脂肪,采用吸水纸吸干水分,称量其质量。
1.4 观察指标与方法
①体质量、摄食量和胃排空:体质量和日摄食量每周测量1次;②内脏脂肪和大鼠肩胛棕色脂肪重量:实验结束后所有动物称重并处死,切取附睾尾和睾丸末端之间的双侧附睾脂肪垫称重,取肾周脂肪垫称重,取大鼠肩胛部棕色脂肪称重。
1.5 统计学方法
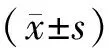
2 结果
2.1 大鼠体质量的变化
高脂饲料喂养大鼠8周后,高脂饲料喂养组大鼠和空白组大鼠体质量为[(496.95±27.30)g VS(438.46±26.08)g,P<0.05],达到造模需要;表1显示,连续6周干预后大鼠体质量变化,采用单因素ANOVA法、LSD 多重分析法比较。与Model组比较,EA-ACR组明显降低了体质量(P=0.02),Sham-EA- ACR组大鼠体质量无显著降低(P=0.66),与Sham-EA-ACR组比较,EA-ACR组大鼠体质量减少差异有统计学意义(P<0.05)。

表1 干预6周后各组SD大鼠体质量
2.2 大鼠摄食量的变化
表2显示,采用独立样本t检验分析:与Normal组比较,高脂饲料喂养的各组老鼠日进食量减少,差异有统计学意义,P值依次为(P1= 0.000,P2=0.00,P3=0.000);与Model组比较,EA-ACR组和Sham-EA-ACR组老鼠进食量比较差异无统计学意义,P值依次为(P1= 0.910、P2=0.091);EA-ACR组VS Sham-EA-ACR组,P=0.171。

表2 各组SD大鼠平均日进食量
2.3 各组大鼠胃排空的变化
各组大鼠胃内固体食物残留量采用单因素ANOVA法、LSD 多重分析法比较差异无统计学意义(Nomal组vs Model组vs EA-ACR组vs Sham-EA-ACR组,P值以此为P1= 0.119,P2=0.166、P3=0.178),(Model组vs EA -ACR组vs Sham-EA-ACR组,P值以此为P4=0.947,P6=0.490),(EA-ACR组vs Sham-EA-ACR组P7=0.480)。

表3 各组大鼠胃内固体食物残留量
2.4 内脏脂肪和大鼠肩胛部棕色脂肪质量的变化
表4显示,采用独立样本t检验分析如下:与Model组比较,EA-ACR组显著减少了睾周脂肪含量(P=0.024),增多了肩胛部棕色脂肪量(P=0.01),肾周脂肪变化差异统计无统计学意义(P=0.058);Sham-EA-ACR组对睾周脂肪、肾周脂肪和大鼠肩胛棕色脂肪重量影响差异无统计学意义,P值依次为(P1= 0.47,P2=0.30,P3=0.55);EA-ACR组与Sham-EA-ACR组相比,对睾周脂肪、肾周脂肪和大鼠肩胛棕色脂肪变化差异无统计学意义,P值依次为(▲P1= 0.016,▲P2=0.058,▲P3=0.001)。

表4 各组内脏脂肪和大鼠肩胛棕色脂肪重量
3 讨论
中医认为肥胖多由于肺、脾、肾功能失调、 气机失畅、 水湿停滞、痰湿内阻、 日久经络闭阻、冲任不调而形成。针灸是一种公认的“绿色疗法”,在治疗肥胖病的疗效方面取得了满意的成果。耳针作为针灸减肥的一个重要途径发挥着重要作用。耳并不是单独孤立的听觉器官,而是相当于人体缩影的一个小整体,全身五脏六腑、皮肤九窍、四肢百骸等部位,通过经络与耳廓密切联系,故有“耳者,宗脉之所聚也”,“十二经脉、三百六十五络,其血气皆上于面而走空窍”之说。耳通过经脉与脏腑及全身发生广泛的联系,针刺耳穴旨在宣畅经络、疏通气血、宣肺化浊、利湿降脂,调节人体脏腑的生理功能,进而到达减肥的作用。
从现代医学的观点来看,神经是耳廓与内脏联系的主要途径。耳廓有丰富的神经分布。实验表明,刺激耳部的淋巴管、血管、神经等组合在一起的神经道路,它通过神经丛、脊髓和大脑以后,又以神经的形式走向内脏器官,能达到改善器官功能作用。吕明庄[4]认为根据“经穴-脏腑”相关理论,刺激耳穴对调节全身各系统的功能,尤其对调整内分泌的功能非常重要。高昕妍[6]认为耳甲区的迷走神经耳支分布区域是体表激活副交感神经系统的部位之一,刺激该区域通过内脏感觉中枢孤束核,兴奋与内脏功能调节有关的中枢区域或核团相联系,通过“耳-迷走-内脏反射途径”治疗与植物神经系统功能失调有关及与内分泌失调有关的疾病。
研究认为,耳甲部是迷走神经体表的惟一分支。研究发现,迷走神经主要由传递来自胃肠机械和化学感受器信号的传入纤维组成[8,9],外周饱感信号主要通过迷走传入纤维传到下丘脑摄食中枢,从而影响进食。摄食调节的通路是: 外周信号传入摄食中枢,中枢处理这些信息从而调控摄食行为,迷走神经作为其重要通路成为潜在治疗靶点[10~12]。所以本实验研究电针刺激耳甲部,旨在探讨耳甲部电针刺激能否发挥刺激迷走神经的作用实现减肥作用? EA-ACR是一种电刺激,为了避免可能因应激反应而引起的减肥效果,在试验中设计Sham-EA-ACR组作为对照。
通过6周的EA-ACR治疗后,实验组大鼠体质量明显降低,而Sham-EA - ACR未出现减肥效果,进而排除因应激导致减肥效果。高脂饲料喂养组大鼠摄食量和胃排空统计差异无统计学意义,表明EA-ACR没有对摄食行为发生调控,这一点不同于既往VNS治疗肥胖大鼠的研究[13],其原因可能是EA-ACR组刺激迷走神经耳支,不同于VNS直接刺激内脏迷走神经传入支,这种刺激方式可能没有对内脏迷走神经传入支发生直接的影响。
此外,EA-ACR减少了睾周脂肪重量,同时增加了棕色脂肪(brown adipose tissue,BAT)的含量。人体内存在棕色脂肪组织和白色脂肪组织(white adipose tissue ,WAT)。WAT堆积在皮下,主要以甘油三酯的形式储存多余的能量,而BAT则以产热的形式消耗能量,包括非颤栗性产热和食物诱导产热,它可以加快人体新陈代谢,促进WAT消耗,将WAT转化成二氧化碳、水和热量。这是婴幼儿在寒冷环境下保持体温恒定的重要手段[14]。长期以来,人们一直认为人类在出生后不久其体内的 BAT 便逐渐消失。然而,现代磁共振技术证实 BAT 仍存在于正常成人体内,且其在肥胖患者体内的活性随肥胖程
度增加而降低[15],因此,人们正试图通过增加体内 BAT 数量和提高 BAT 活性或使WAT 具有 BAT 产热特性,从而消耗肥胖患者体内多余脂肪来发挥减肥作用。由此推测耳甲部电针刺激对肥胖大鼠减肥效应的作用机制可能主要通过促进棕色脂肪的代谢,加快脂肪的分解实现的。
综上所述,耳甲部电针刺激对肥胖大鼠可以产生减肥效应,其作用机制主要是促进棕色脂肪的代谢,加快脂肪的分解;其对于摄食行为的调控在本实验中未被发现,其具体的通路机制需要进一步的深入研究。
[1] Ahima R S.Connecting obesity,aging and diabetes[J].Nat Med,2009,15( 9):996-997.
[2] Camilleri M,Toouli J,Herrera MF,et al.Selection of electrical algorithms to treat obesity with intermittent vagal block using an implantable medical device[J].Surg Obes Relat Dis, 2009 ,5(2):224-229.
[3] Zhao YX,He W,Jing XH, et al.Transcutaneous auricular Vagus nerve stimulation protects endotoxemic rat from lipopolysaccharide-inducedinflammation[J].Evid Based Complement Alternat Med, 2012,2012:627023.
[4] 吕明庄.针灸治疗黄褐斑临床研究[J].中国针灸,1997,17(12):725.
[5] 高昕妍,李艳华,朱 兵,等.针刺耳甲区对自发性高血压及正常大鼠血压的影响及其机理探讨[J].针刺研究,2006,31(2):90-95.
[6] 赵强,冯伟. 针灸治疗单纯性肥胖取穴规律的临床研究[J]. 天津中医药大学学报,2011,30(2):95-97.
[7] Berthoud HR,Neuhuber WL. Functional and chemical anatomy of the afferent vagal system[J].Autonom Neurosci Basic Clin,2000,85(1-3):1-17.
[8] Powley TL,Phillips RJ.Musings on the wanderer:what's new in our understanding of vagovagal reflexes I. Morphology and topography of vagal afferents innervating the GI tract[J]. Am J Physiol Gastrointest Liver Physiol,2002,283( 6):G1217-G1225.
[9] Treasure J,Claudino AM,Zucker N ,et al. Eating disorders[J]. Lancet,2010,375 (9714):583-593.
[10] Chisuwa N,O’Dea JA. Body image and eating disorders amongst Japanese adolescents. A review of the literature[J]. Appetite,2010,54(1):5-15.
[11] Magni P,Dozio E,Ruscica M,et al. Feeding behavior in mammals including humans[J]. Ann N Y Acad Sci,2009,1163:221-232.
[12] Bugajski AJ,Gil K,Ziomber A,et al.Effect of long-term vagal stimulation on food intake and body weight during diet induced obesity in rats[J].J Physiol Pharmacol,2007 ,58 Suppl 1:5-12.
[13] Hansen JB,Kristiamen K.Regulatory circuits controlling white versus brown adipocyte differentiation[J].Biochem J. 2006, 398(2):153-168.
[14] van Marken Lichtenbelt WD,Vanhommerig JW,Smulders NM ,et al.Cold-activated brown adipose tissue in healthy men[J].N Engl J Med,2009 ,360(15):1500-1508.
