野百合碱对大鼠右心室心肌肥厚功能及规范性瞬时感受器电位6表达水平的影响
2014-02-09蔡克锋李维维徐训发林伟强许朝祥陈国桢
蔡克锋,李维维,徐训发,林伟强,许朝祥,陈国桢
肺动脉高压(pulmonary hypertension)是由多种心、肺或肺血管疾病引起的临床常见病症,其严重危害人类的身体健康,受到医学界的广泛重视。肺动脉高压时因肺循环阻力增加,右心负荷增大,最初右心室出现适应性改变,导致右心室肥厚,有利于维持心排血量,但随着肺动脉压的进行性升高,当肺动脉压升高的速度超过右心室代偿能力时,最终导致右心衰竭甚至猝死。因此,逆转心肌肥厚是当前治疗肺动脉高压研究的重点之一。以往的研究发现,肥厚心肌细胞胞质内Ca2+处于持续性高水平[1]。Ca2+内流能调节细胞内Ca2+浓度,参与细胞的肥大和凋亡,规范性瞬时感受器电位(canonical transient receptor potential,TRPC)亚家族可能参与了这种作用。本研究旨在探讨野百合碱(MCT)诱导的右心室肥厚大鼠模型的心肌细胞上TRPC6介导的Ca2+内流是否参与了心肌肥厚的发病,并探讨TRPC6在右心室心肌肥厚中的表达及其病理生理学意义。
1 材料与方法
1.1 材料 于2013年2月在上海斯莱克实验动物有限公司购买健康SD雄性大鼠50只,体质量(200±20)g,周龄(7±1)周。采用随机数字表法将大鼠分为对照组(CON组)和MCT给药模型组(MCT组),各25只。
1.2 方法 CON组大鼠置于常压和正常氧浓度(21%)饲养箱中饲养3周,MCT组大鼠以2%MCT 60 mg/kg一次性腹腔注射后常规饲养3周。
1.3 血流动力学指标检测 CON组和MCT组大鼠按照50 U/100 g于腹腔注射肝素,后采取腹腔注射20%氨基甲酸乙酯5 ml/kg麻醉。切开右侧颈部皮肤,分离右侧颈外静脉,将PE50管沿右颈外静脉送入右心室,记录大鼠右心室收缩压(right ventricular systolic pressure,RVSP)并同步记录心率(HR)、右心室内压力最大上升/下降速率(right ventricular pressure maximum rate of rise/descent,RV±dp/dtmax),同法从左侧颈总动脉插入导管,记录平均动脉压(MAP)。
1.4 右心室肥大指数(RVMI)计算 剪开大鼠胸腔,剪断腔静脉、主动脉以及心脏周围组织,分离右心室(RV)、左心室(LV)及室间隔(S),并置于滤纸片上吸干多余水分,分别称质量并计算RVMI,RVMI=RV/(LV+S)。
1.5 心肌组织形态学检测 取出大鼠心脏,剪除大血管、心包膜、脂肪组织等,滤纸吸干,取右心室心肌靠心尖部组织,置于4%多聚甲醛固定,常规石蜡包埋,切片,HE染色,光镜下观察心肌病理改变。
1.6 实时定量PCR(RT-PCR)检测TRPC6 mRNA表达水平 将约0.1 g右心室组织块在液氮中充分研磨后,提取总RNA,紫外分光光度法测定RNA浓度及纯度。用β-actin作为内参照进行RT-PCR,建立10 μl PCR反应体系:H2O 4.15 μl,ROX 5 μl,PCR Forward Primer 0.3 μl,PCR Reverse Primer 0.3 μl(见表1),cDNA 0.25 μl。PCR扩增反应条件:预变性95 ℃ 10 min,1个循环;95 ℃变性30 s、60 ℃退火1 min、70 ℃延伸 1 min,40个循环。

表1 β-actin及TRPC6 mRNA引物序列
1.7 Western blotting方法检测TRPC6蛋白表达水平 右心室心肌组织用液氮研磨后,加入RIPA细胞裂解液提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blotting实验。12.5%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后行转膜印迹,分别用兔抗大鼠TRPC6抗体或大鼠抗大鼠β-actin抗体(Santa Cruz Biotechnology,美国)与膜上的抗原结合,然后用相应的辣根过氧化物酶(HRP)耦联的二抗与其反应,用化学发光试剂Novex ECL(Invitrogen,美国)检测,经压片曝光后显影和定影。采用Phoretix 1D图像分析软件分析蛋白表达情况。
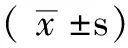
2 结果
2.1 两组大鼠一般情况比较 饲养3周后,CON组大鼠死亡1只,MCT组大鼠死亡7只。CON组大鼠体质量(221±15)g,周龄(10±1)周;MCT组体质量(198±17)g,周龄(10±1)周。两组大鼠体质量比较,差异有统计学意义(t=4.645,P<0.001);两组大鼠周龄比较,差异无统计学意义(t=0.000,P=1.000)。
2.2 两组大鼠血流动力学指标和RVMI比较 CON组和MCT组MAP和HR比较,差异无统计学意义(P>0.05);MCT组RVSP、RVMI、RV+dp/dtmax高于CON组,RV-dp/dtmax低于CON组,差异均有统计学意义(P<0.05,见表2)。

表2 两组大鼠血流动力学指标和RVMI比较
注:RVSP=右心室收缩压,MAP=平均动脉压,HR=心率,RV+dp/dtmax=右心室压力最大上升速率,RV-dp/dtmax=右心室压力最大下降速率,RVMI=右心室肥大指数
2.3 右心室心肌组织病理学观察 HE染色可见CON组大鼠右心室心肌细胞排列有序,胞核清晰(见图1A)。MCT组右心室心肌纤维粗大,细胞内肌原纤维数量增多,心肌纤维排列紊乱,细胞核深染,形状不整(见图1B)。
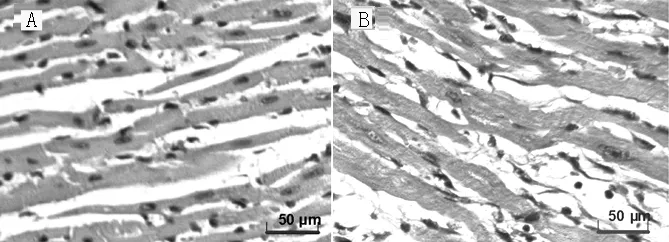
图1 两组右心室心肌组织病理切片(HE染色,×400)
Figure1 Pathological sections of right ventricular tissues of the two groups
2.4 两组右心室心肌组织TRPC6 mRNA表达水平比较 CON组右心室心肌组织TRPC6 mRNA表达水平为(1.00±0.51),MCT组为(2.49±0.96),MCT组右心室心肌组织TRPC6 mRNA表达水平高于CON组,差异有统计学意义(t=-3.33,P<0.05)。
2.5 两组右心室心肌组织TRPC6蛋白表达水平比较 CON组右心室心肌组织TRPC6蛋白表达水平为(1.00±0.46),MCT组为(2.90±0.32)。MCT组右心室心肌组织TRPC6蛋白表达水平高于CON组,差异有统计学意义(t=14.99,P<0.05,见图2)。
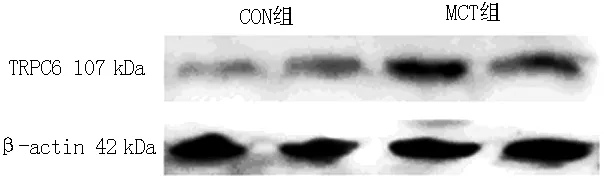
图2 TRPC6蛋白在大鼠右心室心肌组织的表达情况
3 讨论
MCT属双稠吡咯啶生物碱,其进入动物体内后可在肝脏内经P450单氧化酶转化为有活性的MCT吡咯,可选择性地损伤肺动脉内皮细胞,使内皮源性NO合成及分泌减少,增加释放收缩血管物质,如内皮素、血小板源性生长因子、碱性成纤维细胞生长因子等,引起肺动脉血管腔狭窄甚至堵塞及肺动脉血管收缩,同时由于内皮细胞坏死脱落容易启动内源性和外源性凝血途径,形成血栓,最终导致肺动脉高压[2-3]。肺动脉高压早期,右心室尚能代偿,舒张末期压仍正常,随着病情的进展,特别是急性加重期,肺动脉压持续升高且严重,超过右心室负荷,右心失代偿,右心排血量下降,右心室收缩末期残留血量增加,舒张末压增高,促使右心室扩大、右心衰竭甚至死亡。Tofovic等[4]研究结果显示,MCT诱导的大鼠肺动脉高压模型可以模拟人类原发性肺动脉高压症的发病过程。本研究结果显示,肺动脉高压引起RVSP显著升高,引起心肌组织代偿性肥大,导致RVMI显著升高,右心室心肌组织切片HE染色可见心肌纤维粗大,细胞内肌原纤维数量增多,心肌纤维排列紊乱,切面可见部分心肌纤维排列拥挤,细胞核深染,形状不整。RV+dp/dtmax显著升高,RV-dp/dtmax显著降低,提示右心室收缩、舒张功能代偿性增强,证明MCT诱导3周大鼠右心室心肌肥厚模型成功建立。且此模型方法简单,可重复性好。
本研究结果证实在大鼠心肌细胞能够检测TRPC6表达,且TRPC6 mRNA及蛋白表达水平在MCT组中发生明显上调。目前已有研究表明,TRPC6通道在心肌肥厚中发挥重要作用[5]。TRPC6是含有931个氨基酸的蛋白,有6次跨膜的结构,其N端和C端均在胞内,第5个和第6个跨膜结构区构成了非选择性阳离子通道[6]。目前研究发现,TRPC6更多地参与对肺血管紧张度的调节[7]。Kinoshita等[8]研究发现,GC-A基因缺失后的小鼠,由于解除了GC-A对TRPC6的抑制作用引起心脏钙调神经磷酸酶/激活T细胞核因子(CaN/NFAT)信号通路的激活,从而导致心肌肥厚。本研究以不同的造模方式——MCT诱导,进一步证实TPRC6通道的基因表达上调可能与心肌肥厚有关。
本研究以MCT诱导的大鼠右心室心肌肥厚模型进行研究,结果显示,MCT可以导致RVSP增高,使右心室心肌收缩和舒张功能增强;MCT组RVMI、TRPC6 mRNA和蛋白表达水平高于CON组,说明MCT可诱导SD大鼠产生右心室心肌肥厚,上调了编码右心室心肌细胞TRPC6 mRNA和蛋白表达,提示TRPC6可能参与右心室心肌肥厚的发生发展,其可能成为治疗肺动脉高压所致右心室肥厚的新靶点。但本研究采用的MCT诱导右心室肥厚模型是间接通过诱导肺动脉高压进而导致右心室肥厚而实现的,而MCT对右心室有无直接影响目前尚不清楚,TRPC亚家族其他成员在右心室肥厚中的表达情况如何,尚待进一步研究。
1 Vieillard-Baron A,Frisdal E,Eddahibi S,et al.Inhibition of matrix metalloproteinases by lung TIMP-1 gene transfer or doxycycline aggravates pulmonary hypertension in rats[J].Circ Res,2000,87(5):418-425.
2 Scotland RS,Chauhan S,Davis C,et al.Vanilloid receptor TRPV1,sensory C-fibers,and vascular autoregulation:a novel mechanism involved in myogenic constriction[J].Circ Res,2004,95(10):1027-1034.
3 Högestätt ED,Zygmunt PM.Cardiovascular pharmacology of anandamide[J].Prostaglandins Leukot Essent Fatty Acids,2002,66(2/3):343-351.
4 Tofovic SP,Zhang X,Zhu H,et al.2-Ethoxyestradiol is antimitogenic and attenuates monocrotaline-induced pulmonary hypertension and vascular remodeling[J].Vascul Pharmacol,2008,48(4/6):174-183.
5 Nakayama H,Wilkin BJ,Bodi I,et al.Calcineurin-dependent cardiomyopathy is activated by TRPC in the adult mouse heart[J].FASEB J,2006,20(10):1660-1670.
6 余冬梅.经典瞬时感受器阳离子通道研究进展[J].重庆医学,2011,40(25):2591-2593.
7 黄超贤,张萃.TRPC6与疾病研究进展[J].国际医药卫生导报,2011,17(6):765-767.
8 Kinoshita H,Kuwahara K,Nishida M,et al.Inhibition of TRPC6 Channel activity contributes to the antihypertrophic effects of natriuretic peptides-guanylyl cyclase-A signaling in the heart[J].Circ Res,2010,106(12):1849-1860.
