支气管哮喘不同表型血清及诱导痰中生长因子水平的关系研究
2014-02-09方秋红马迎民王学艳
邹 晖,方秋红,马迎民,王学艳
支气管哮喘是一种异质性、慢性气道炎症性疾病,包含不同表型,其特点为可逆性的气道阻塞和气道高反应性(AHR)[1]。支气管哮喘的表型可以根据临床表现进行分类,也可以根据炎症类型的免疫病理,特殊炎症细胞种类分为嗜酸粒细胞型或中性粒细胞型[1-3]。不同表型的支气管哮喘患者有其自然病程,治疗反应以及预后均不一样,因此区分不同的支气管哮喘表型具有重要的临床意义[1-2]。
生长因子在支气管哮喘的气道炎症和气道重构中起着重要作用。有研究报道,表皮生长因子(EGF)与其受体在支气管哮喘支气管上皮[4-6]、气道上皮、腺体、平滑肌中广泛表达,而且EGF参与支气管哮喘气道重构的病理生理过程[6]。EGF可以直接作用于气道平滑肌,促进平滑肌增殖,参与支气管哮喘的气道重构[7-8]。活化的EGF受体和血小板衍生生长因子(PDGF)受体激酶使气道平滑肌细胞、上皮细胞和杯状细胞增生[9]。有研究发现,支气管哮喘患者支气管肺泡灌洗液(BALF)中碱性成纤维细胞生长因子(bFGF)水平明显高于非支气管哮喘者,而且在过敏原暴露后其水平进一步增高,提示bFGF与支气管哮喘的气道重构有关[10]。另有研究发现,稳定期以及急性加重期支气管哮喘患者血清及诱导痰中血管内皮生长因子(VEGF)水平增高,且VEGF及其受体的表达与新生血管形成关系密切,预示着气道重构的发生[11]。
临床需要实用、可操作、可重复的有意义的指标评估支气管哮喘患者的气道炎症、病情的严重程度,从而指导临床选择针对性治疗和对其预后的评判。鉴于EGF、bFGF、PDGF以及VEGF在支气管哮喘发病机制气道炎症、AHR和气道重构中的重要作用,且目前血清及诱导痰中EGF、bFGF、PDGF以及VEGF水平与支气管哮喘不同临床表型间的关系系统报道较少。因此,本研究旨在探讨支气管哮喘患者血清及诱导痰中EGF、bFGF、PDGF以及VEGF水平之间的关系,以期指导临床工作。
1 资料与方法
1.1 一般资料 选择2010年6月—2011年6月首都医科大学附属北京世纪坛医院呼吸内科门诊及住院的支气管哮喘急性发作患者62例,其均符合中华医学会呼吸病学分会哮喘学组2008年制定的支气管哮喘防治指南中的诊断标准[12],近期出现不同频度和/或不同程度的喘息、气急、胸闷、咳嗽等症状。排除慢性阻塞性肺疾病(COPD)、活动性急或慢性肺部其他疾病以及其他严重免疫性疾病、恶性肿瘤、冠心病、高血压、妊娠及哺乳期妇女。本研究经本医院伦理委员会同意且所有受试者知情同意。
1.2 不同支气管哮喘临床表型分组方法以及标准 根据患者诱导痰细胞不同分为嗜酸粒细胞表型组和中性粒细胞表型组;根据患者肺功能分为第1秒用力呼气末容积占用力肺活量百分比(FEV1/FVC)≥70%组和FEV1/FVC<70%组,采用德国JEGER公司生产的肺功能仪检测患者FEV1/FVC水平;患者病情严重程度分级标准参考文献[12],分为轻度组、中度组和重度组。
1.3 治疗方法 患者均给予规范化治疗,包括按需使用短效β2受体激动剂,吸入糖皮质激素及长效β2受体激动剂的联合治疗以及白三烯受体拮抗剂治疗。
1.4 诱导痰技术 参照中华医学会呼吸病学会推荐的步骤进行。操作方法:(1)诱导前10 min患者吸入沙丁胺醇400 μg;(2)雾化吸入前清水漱口、擤鼻;(3)3%高渗盐水超声雾化吸入15 min,用力咳痰至培养皿;(4)若患者无痰或痰量不足则换用4%高渗盐水继续雾化7 min;(5)若患者继续无痰或痰量不足则换用5%高渗盐水继续雾化,7 min后终止诱导程序;(6)痰液称重,加入4倍体积的0.1%二硫苏糖醇(DTT)充分混合,37 ℃水浴10 min,离心沉淀细胞,计数细胞总数。沉淀涂片,苏木素-伊红(HE)染色,细胞分类计数,计算嗜酸粒细胞及中性粒细胞分数[13]。
1.5 生长因子测定 痰液进行处理后留取上清液,于-80 ℃冰箱中保存待用。于清晨采集静脉血2 ml,以1 780×g在离心机中离心10 min,留取血清,于-80 ℃冰箱中保存待用。采用酶联免疫吸附法(ELISA)检测上清液及血清中EGF、bFGF、PDGF-AA、PDGF-BB以及VEGF水平。试剂盒购自武汉华美生物工程有限公司,严格按照说明书操作步骤进行。
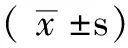
2 结果
2.1 临床资料 根据分组标准,中性粒细胞表型组48例,嗜酸粒细胞表型组14例;FEV1/FVC≥70%组24例,FEV1/FVC<70%组38例;轻度组38例,中度组10例,重度组14例。中性粒细胞表型组和嗜酸粒细胞表型组年龄、性别、病程、发病年龄<40岁、吸烟率、过敏性鼻炎发生率、支气管哮喘家族史、总免疫球蛋白E(T-IgE)、第1秒用力呼气末容积(FEV1)、FEV1/FVC比较,差异均无统计学意义(P>0.05);轻度组、中度组和重度组上述几项指标比较,差异均无统计学意义(P>0.05);FEV1/FVC≥70%组和FEV1/FVC<70%组年龄、性别、病程、发病年龄<40岁、吸烟率、过敏性鼻炎发生率、支气管哮喘家族史、血清嗜酸粒细胞分数、T-IgE比较,差异均无统计学意义(P>0.05),两组FEV1、FEV1/FVC比较,差异有统计学意义(P<0.05,见表1)。
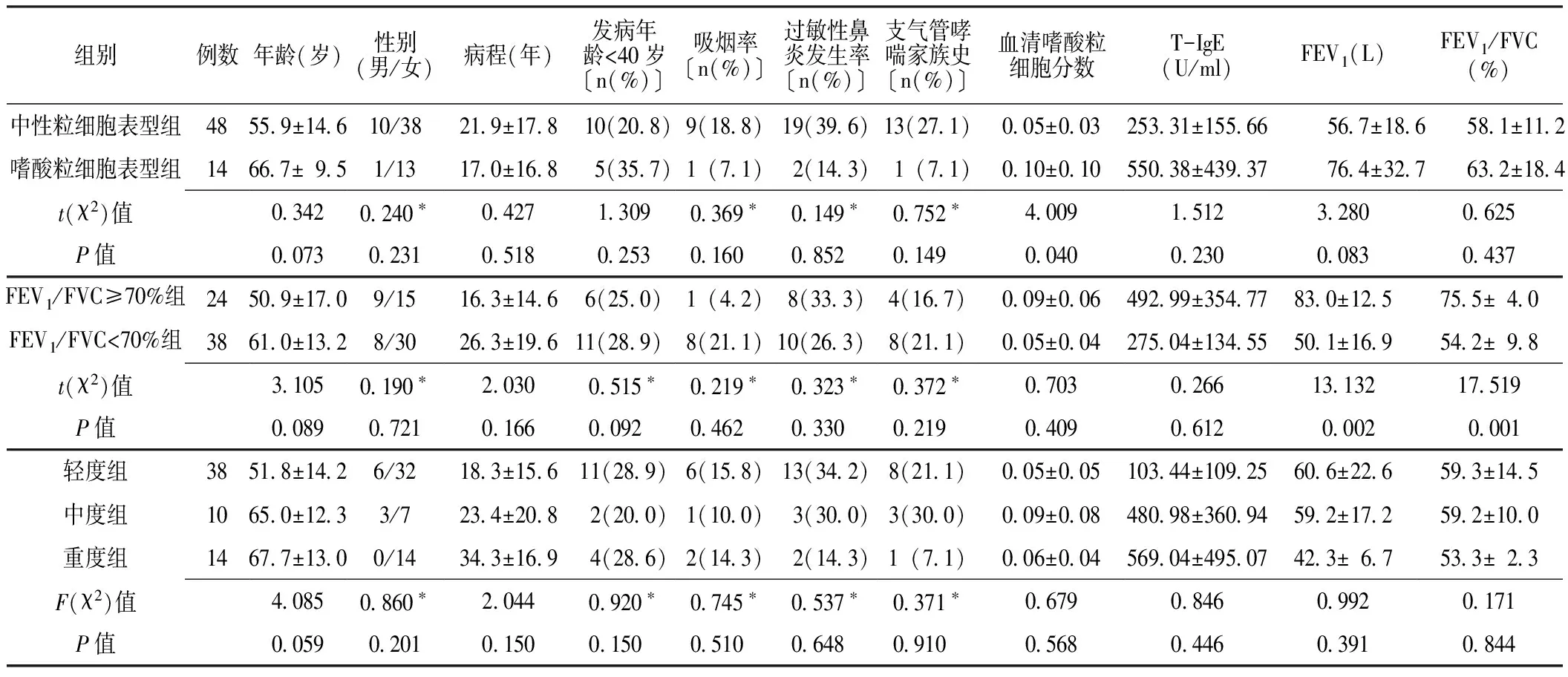
表1 不同表型分类支气管哮喘患者一般资料比较
注:*为χ2值;T-IgE=总免疫球蛋白E,FEV1=第1秒用力呼气末容积,FEV1/FVC=第1秒用力呼气末容积占用力肺活量百分比
2.2 血清及诱导痰中生长因子水平 血清EGF、PDGF-AA、VEGF水平均低于诱导痰中水平,差异有统计学意义(P<0.05);血清bFGF、PDGF-BB水平均高于诱导痰中水平,差异有统计学意义(P<0.05,见表2)。
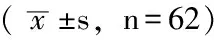
表2 支气管哮喘急性发作患者血清及诱导痰生长因子水平比较
注:EGF=表皮生长因子,bFGF=碱性成纤维细胞生长因子,PDGF-AA=血小板衍生生长因子AA,PDGF-BB=血小板衍生生长因子BB,VEGF=血管内皮生长因子
2.3 不同支气管哮喘临床表型血清及诱导痰中生长因子水平 血清及诱导痰中EGF、bFGF、PDGF-AA及PDGF-BB在不同支气管哮喘临床表型各组间比较,差异均无统计学意义(P>0.05)。血清及诱导痰中嗜酸粒细胞表型组VEGF水平高于中性粒细胞表型组,差异有统计学意义(P<0.05);血清及诱导痰中FEV1/FVC<70%组VEGF水平高于FEV1/FVC≥70%组,差异有统计学意义(P<0.05);血清及诱导痰中重度支气管哮喘组VEGF水平分别高于轻度组和中度组,差异有统计学意义(P<0.05,见表3、4)。

表3 不同表型支气管哮喘患者血清中生长因子水平比较
注:与重度组比较,*P<0.05
2.4 治疗前后血清及诱导痰中生长因子水平 在治疗1个月后,只随访到9例患者的完整资料,对9例患者的血清及诱导痰中生长因子水平进行检测,结果显示,治疗前后血清及诱导痰中EGF、bFGF、PDGF-AA、PDGF-BB和VEGF水平比较,差异均无统计学意义(P>0.05,见表5、6)。

表4 不同表型支气管哮喘患者诱导痰中生长因子水平比较
注:与重度组比较,*P<0.05
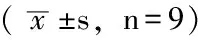
Table5 Comparison of serum growth factors levels in 9 cases before and after treatment
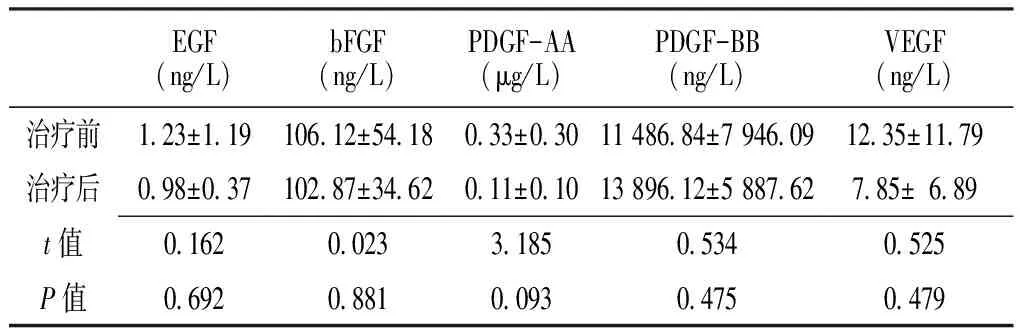
EGF(ng/L)bFGF(ng/L)PDGF-AA(μg/L)PDGF-BB(ng/L)VEGF(ng/L)治疗前1 23±1 19106 12±54 180 33±0 3011486 84±7946 0912 35±11 79治疗后0 98±0 37102 87±34 620 11±0 1013896 12±5887 627 85±6 89t值0 1620 0233 1850 5340 525P值0 6920 8810 0930 4750 479
Table6 Comparison of sputum growth factors levels in 9 cases before and after treatment
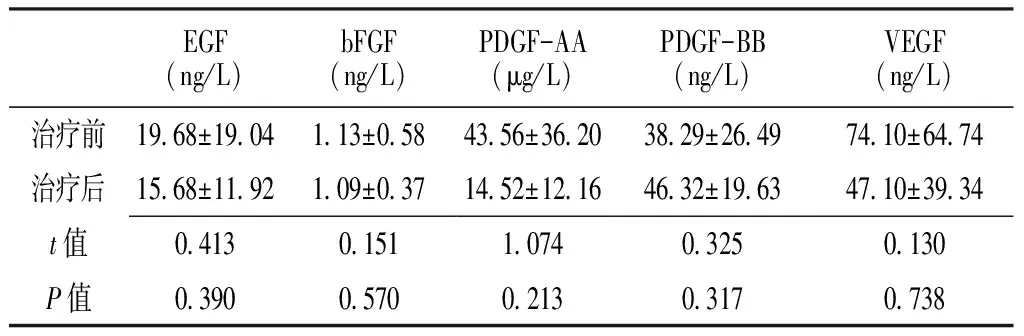
EGF(ng/L)bFGF(ng/L)PDGF-AA(μg/L)PDGF-BB(ng/L)VEGF(ng/L)治疗前19 68±19 041 13±0 5843 56±36 2038 29±26 4974 10±64 74治疗后15 68±11 921 09±0 3714 52±12 1646 32±19 6347 10±39 34t值0 4130 1511 0740 3250 130P值0 3900 5700 2130 3170 738
3 讨论
生长因子在支气管哮喘的气道炎症和气道重构中起重要作用。本研究探讨了血清及诱导痰中生长因子水平与支气管哮喘临床表型之间的关系。结果提示,EGF、bFGF、PDGF-AA、PDGF-BB及VEGF在血清及诱导痰中均能检测到,且血清及诱导痰中嗜酸粒细胞表型组VEGF水平高于中性粒细胞表型组,FEV1/FVC<70%组高于FEV1/FVC≥70%组,重度组分别高于轻度组和中度组。提示VEGF可能与嗜酸粒细胞型支气管哮喘,气道气流受限以及支气管哮喘的严重程度有关。而EGF、bFGF、PDGF-AA及PDGF-BB在各表型分组中无明显差别。
EGF、bFGF、PDGF以及VEGF在人体组织细胞分布广泛。这些生长因子合成后释放到体液或血液中,其在痰液或血清中的表达水平取决于多种因素。本研究结果显示,血清EGF、PDGF-AA、VEGF水平均低于诱导痰中水平,血清bFGF、PDGF-BB水平均高于诱导痰中水平。在诱导痰的收集和处理环节多会影响检测水平,血清中则相对稳定。另外,机体在生理状态和疾病状态时生长因子的表达会明显不同,同样也会影响不同部位生长因子水平的变化。
EGF、bFGF、PDGF-AA及PDGF-BB与哮喘发病机制的关系也非常密切。但在本研究中其在各表型中的水平无明显差别,可能与选取的研究对象和样本例数不多有关。
VEGF的主要来源为外周血嗜酸粒细胞[14-15]、BALF中嗜酸粒细胞[16]以及气道中其他细胞如上皮细胞、肥大细胞、肌成纤维细胞和平滑肌细胞[17]。多项研究发现,儿童支气管哮喘患儿血清及诱导痰中VEGF水平明显增高[18-19]。本研究结果显示,嗜酸粒细胞表型组嗜酸粒细胞分数明显高于中性粒细胞表型组,提示血清及诱导痰中增高的VEGF水平可能与外周血以及诱导痰中增高的嗜酸粒细胞及嗜酸粒细胞气道炎症明显相关。
美国国家心肺血液研究所工作组指出,支气管哮喘研究的重点应该是血管的研究。因为气道血管的重构和组织水肿是支气管哮喘气道炎症机制和生理异常的重要表现。VEGF在气道炎症、血管生成和血管通透性增加、上皮下胶原沉积、气道平滑肌增生以及气道生理异常中起重要作用[20-21]。VEGF可以使黏膜和黏膜下血管床通透性增高,从而导致气道壁增厚。因此,黏膜的水肿对气道功能会产生严重影响[18,22]。有研究还发现,重度支气管哮喘患者较轻度和中度支气管哮喘患者有更多的血管生成[23-24]。本研究结果显示,重度组血清及诱导痰中VEGF水平分别高于轻度组和中度组,FEV1/FVC<70%组VEGF水平高于FEV1/FVC≥70%组,提示VEGF可能通过气道炎症,新生血管生成,血管通透性增加导致气道黏膜水肿,气道壁增厚,使患者气道功能发生不可逆的气流受限,加重支气管哮喘严重程度。
多项研究提示,予以吸入激素治疗可以降低生长因子表达水平。Kanazawa等[25]报道,支气管哮喘患者诱导痰中VEGF水平经过1年的吸入激素治疗后明显降低。Asai等[17]报道,支气管哮喘患者诱导痰中VEGF水平经过8周的吸入激素治疗后,其水平明显下降。Abdel-Rahman等[19]报道,儿童支气管哮喘患儿急性发作时,诱导痰中VEGF水平经6周的吸入激素治疗后,其水平明显下降。本研究有9例患者经吸入激素治疗1个月后,再次检测其血清及诱导痰中生长因子水平发现,EGF、bFGF、PDGF-AA以及VEGF水平治疗后较治疗前有所下降,但无差异,究其原因可能是样本量少,没有区分不同表型的支气管哮喘患者,观察治疗时间没有足够长等因素。
1 Wenzel SE.Asthma:defining of the persistent adult phenotypes[J].Lancet,2006,368(9537):804-813.
2 Green RH,Brightling CE,Bradding P.The reclassification of asthma based on subphenotypes[J].Curr Opin Allergy Clin Immunol,2007,7(1):43-50.
3 Fahy JV.Eosinophilic and neutrophilic inflammation in asthma:insights from clinical studies[J].Proc Am Thorac Soc,2009,6(3):256-259.
4 Puddicombe SM,Polosa R,Richter A,et al.Involvement of the epidermal growth factor receptor in epithelial repair in asthma[J].FASEB J,2000,14(10):1362-1374.
5 Polosa R,Puddicombe SM,Krishna MT,et al.Expression of c-erbB receptors and ligands in the bronchial epithelium of asthmatic subjects[J].J Allergy Clin Immunol,2002,109(1):75-81.
6 Amishima M,Munakata M,Nasuhara Y,et al.Expression of epidermal growth factor and epidermal growth factor receptor immunoreactivity in the asthmatic human airway[J].Am J Respir Crit Care Med,1998,157(6 Pt 1):1907-1912.
7 Nasuhara Y,Munakata M,Sato A,et al.Mechanisms of epidermal growth factor-induced contraction of guinea pig airways[J].Eur J Pharmacol,1996,296(2):161-168.
8 Patel P,Itoh H,Lederis K,et al.Contraction of guinea pig trachea by epidermal growth factor-urogastrone[J].Can J Physiol Pharmacol,1988,66(10):1308-1312.
9 Ingram JL,Bonner JC.EGF and PDGF receptor tyrosine kinases as therapeutic targets for chronic lung diseases[J].Curr Mol Med,2006,6(4):409-421.
10 Redington AE,Roche WR,Madden J,et al.Basic fibroblast growth factor in asthma:measurement in bronchoalveolar lavage fluid basally and following allergen challenge[J].J Allergy Clin Immunol,2001,107(2):384-387.
12 中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案)[J].中华结核和呼吸杂志,2008,31(3):177-185.
13 中华医学会呼吸病学分会哮喘学组.咳嗽的诊断与治疗指南(2009版)[J].中华结核和呼吸杂志,2009,32(6):407-413.
14 Horiuchi T,Weller PF.Expression of vascular endothelial growth factor by human eosinophils:upregulation by granulocyte macrophage colony-stimulating factor and interleukin-5[J].Am J Respir Cell Mol Biol,1997,17(1):70-77.
15 Mitsuyama H,Matsuyama W,Iwakawa J,et al.Increased serum vascular endothelial growth factor level in Churg-Strauss syndrome[J].Chest,2006,129(2):407-411.
16 Lee SY,Kwon S,Kim KH,et al.Expression of vascular endothelial growth factor and hypoxia-inducible factor in the airway of asthmatic patients[J].Ann Allergy Asthma Immunol,2006,97(6):794-799.
17 Asai K,Kanazawa H,Kamoi H,et al.Increased levels of vascular endothelial growth factor in induced sputum in asthmatic patients[J].Clin Exp Allergy,2003,33(5):595-599.
18 Yoo Y,Choi IS,Byeon JH,et al.Relationships of methacholine and adenosine monophosphate responsiveness with serum vascular endothelial growth factor in children with asthma[J].Ann Allergy Asthma Immunol,2010,104(1):36-41.
19 Abdel-Rahman AM,el-Sahrigy SA,Bakr SI.A comparative study of two angiogenic factors:vascular endothelial growth factor and angiogenin in induced sputum from asthmatic children in acute attack[J].Chest,2006,129(2):266-271.
20 Busse W,Banks-Schlegel S,Noel P,et al.Future research directions in asthma:an NHLBI Working Group report[J].Am J Respir Crit Care Med,2004,170(6):683-690.
21 Lee CG,Link H,Baluk P,et al.Vascular endothelial growth factor(VEGF)induces remodeling and enhances TH2-mediated sensitization and inflammation in the lung[J].Nat Med,2004,10(10):1095-1103.
22 Kanazawa H,Hirata K,Yoshikawa J.Role of endogenous nitric oxide in exercise-induced airway narrowing in patients with bronchial asthma[J].J Allergy Clin Immunol,2000,106(6):1081-1087.
23 Salvato G.Quantitative and morphological analysis of the vascular bed in bronchial biopsy specimens from asthmatic and non-asthmatic subjects[J].Thorax,2001,56(12):902-906.
24 Vrugt B,Wilson S,Bron A,et al.Bronchial angiogenesis in severe glucocorticoid-dependent asthma[J].Eur Respir J,2000,15(6):1014-1021.
25 Kanazawa H,Yoshikawa J.Effect of beclomethasone dipropionate on basic fibroblast growth factor levels in induced sputum samples from asthmatic patients[J].Ann Allergy Asthma Immunol,2005,95(6):546-550.
