光学相干断层成像在糖尿病视网膜病变临床前期观察中的应用
2014-02-08冀向宁王志学王文英韩风梅
冀向宁,王志学,王文英,韩风梅
糖尿病视网膜病变(diabetes retinopathy,DR)是人类最主要的致盲原因,且近年来,DR患病率逐年上升。经典理论认为DR最基本的病理改变为微血管改变。但是,近年来研究发现:糖尿病患者和动物模型在眼底血管出现DR特征性微血管改变以前已经出现许多功能性改变如:色觉异常、对比敏感度降低[1]以及视网膜电图异常[2]等。光学相干断层扫描(optical coherence tomography,OCT)是一种新的类似B超的图像诊断技术,能够精确地测量视网膜神经纤维层(retinal nerve fiber layer,RNFL)的厚度,显示病变情况。故本研究以OCT为主要检查手段,以糖尿病病史10~15年尚处于DR临床前期的患者为研究对象,试图发现早期的眼底神经病变,发现DR进程的“窗口期”。

表1 对照组与观察组RNFL厚度比较
1 资料与方法
1.1 临床资料 以沧州市中心医院2011年6月—2012年6月有糖尿病病史10~15年,尚未出现视网膜病变的门诊2型糖尿病患者76例(152只眼)为观察组,其中男41例,女35例;年龄40~70岁。入选标准:确诊为2型糖尿病,糖尿病病史10~15年,检眼镜检查未发现任何视网膜病变且眼底荧光血管造影(fundus fluorescence angiography,FFA)检查未见异常荧光。矫正视力>0.8,屈光不正度数球镜-1.0 D~+1.0 D,除外青光眼、前部缺血性视神经病变等眼部疾病。另选择同时期体检健康者40例(80只眼)为对照组,其中男23例,女17例;年龄40~70岁。入选标准:矫正视力>0.8,屈光不正度数球镜-1.0 D~+1.0 D,无眼部疾病,内外眼无异常。两组性别、年龄具有均衡性。
1.2 方法 OCT检查:受试对象均行双眼OCT检查。均经复方托品酰胺滴眼液散大瞳孔至直径≥5 mm后,端坐在OCT扫描仪器(德国Zeiss公司HD-OCT4000)前,采用内注视的方法,按操作标准固定头位及下颌位置。OCT扫描图像均严格控制为以视盘中点为中心的同心圆环,分4个象限扫查视盘及视盘周边3.4 mm的范围,以地形图的方式显示RNFL厚度。以任何一个象限出现RNFL厚度低于正常厚度范围定义为神经纤维层厚度低于正常。以上全部操作由同一位有经验的主管技师完成。OCT对视盘周围RNFL的扫描分区:上1/4象限46°~135°,鼻侧1/4象限136°~225°,下1/4象限226°~315°,颞侧1/4象限316°~45°。21例OCT检查RNFL厚度明显变薄者9个月后复查OCT及FFA。

2 结果
2.1 两组RNFL厚度比较 观察组360°平均值、上1/4象限和下1/4象限的RNFL厚度较对照组均变薄,差异有统计学意义(P<0.05,见表1)。彩色眼底照相未见异常(见图1);OCT检查示RNFL厚度变薄(见图2);FFA检查未见异常荧光(见图3)。
2.2 复查结果 21例OCT检查RNFL厚度明显变薄者,9个月后复查,RNFL厚度继续变薄,差异有统计学意义(P<0.05,见表2);其中14例复查FFA发现颞上及颞下方可见点状强荧光(见图4)。

图1 彩色眼底照相未见异常
Figure 1 Fundus color photography showed no abnormal changes
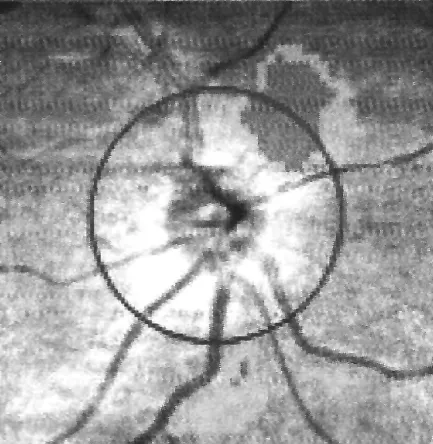
图2 OCT检查示:RNFL厚度变薄
Figure 2 OCT examination showed RNFL has thinned

图3 FFA未见异常荧光

图4 FFA复查示:颞上及颞下方可见点状强荧光
Figure 4 FFA reexamination showed dotted high fluorescence located in the temporal and infratemporal area

Table 2 RNFL thinkness variation re-checked after nine months

例数RNFL厚度入院时2195.35±11.239个月后2194.03±11.35差值 1.32±1.34 t值6.408P值0.000
3 讨论
临床上将已经确诊为糖尿病,而眼底尚未出现可视的特征性微血管病变以前定义为DR临床前期。来自美国的调查显示:糖尿病病程10年以内DR患病率为7%,病程15年以上者为63%,30年以上者为95%[3]。可见病程10~15年间为DR发生发展的重要阶段。有50%以上的患者在此5年间由临床前期进展至DR临床期。因此本研究选择糖尿病病史10~15年,尚属DR临床前期的这一特殊时期的患者。RNFL主要是由神经节细胞的轴突组成的,另外还有Mǚiler细胞、神经胶质细胞、传出纤维以及视网膜血管。节细胞轴索按照一定的排列走向视盘。因此视盘是神经纤维最为集中、RNFL最厚的部位,所以本研究以视盘及其周围3.4 mm的范围作为研究RNFL厚度的区域。OCT是一种新的类似B超的图像诊断技术。采用了傅立叶探测技术的频域OCT扫描速度提高了50~100倍,其轴向分辨率可以提高至5 μm,可获得视网膜内部微细结构的横断图像,是本研究的主要检测手段。
本研究结果显示,DR临床前期的患者与同龄健康者比较视盘周围的RNFL厚度变薄,以视盘上1/4象限和下1/4象限最为显著,在FFA检查无异常的情况下出现了明显的RNFL厚度变薄。Peng等[4]用OCT测量了DR临床前期患者和健康人视盘周围的RNFL厚度,发现DR临床前期患者RNFL厚度明显变薄,以视盘上1/4象限最为显著,本研究结果与之一致;Chihara等[5]应用无赤光眼底照相的方法研究糖尿病患者RNFL的改变,结果显示无视网膜微血管病变的糖尿病患者中20%出现视网膜RNFL厚度降低;赵海岚等[6]、熊小艳等[7]用OCT研究无视网膜病变的糖尿病患者RNFL厚度时,亦有大致相同的结论。
RNFL厚度反映了神经节细胞存活状况[8],DR临床前期患者视网膜RNFL厚度变薄,可以推测在出现检眼镜可见的DR特征性眼底血管改变前可能已经有神经元的退行性病变。病理观察结果和动物模型亦支持这一观点。糖尿病患者的视网膜切片电镜观察可见到视网膜部分神经节细胞的坏死,轴突、树突、胞体崩解,而残活的神经节细胞亦表现为轴突及胞体的变形、肿胀,神经节细胞层的厚度明显减低,神经轴突再生受到抑制[9],对神经元的损伤可以造成视网膜RNFL的丢失,继而引起视乳头周围RNFL厚度的变薄。通过对DR患者捐献眼的研究发现:即使轻微DR患者视盘及黄斑周围的神经节细胞层已有变薄,电镜下可见轴突有不规则肿胀,呈串珠样改变,树突明显变小,分支减少,RNFL细胞丢失。有学者研究发现,大鼠动物模型在糖尿病发生1周时,即可从超微结构水平发现了水平细胞、无长突细胞和神经节细胞坏死的特征[10]。Fukuda等[11]研究发现在动物模型上,糖尿病建模成功后10周可观察到神经元包括神经节细胞、无长突细胞等的凋亡增加。糖尿病患者的RNFL厚度减低,表明视网膜神经细胞受损和丢失。引起视网膜神经节细胞破坏、死亡的原因可能是多方面的。糖尿病患者出现血糖控制不佳、高血压等情况时,组织的易损性就会增加,RNFL更容易受损缺失。
进一步研究发现:检出的RNFL厚度变薄者,9个月后复查RNFL厚度进一步变薄,而且部分患者FFA中出现了异常荧光。这说明RNFL厚度变薄的患者进入了迈向DR的一个快速发展期,OCT观察到的RNFL厚度变薄是早于眼底血管病变的神经病变,故此,这一阶段,是糖尿病患者由DR临床前期过渡到DR的“窗口期”。
在研究中OCT较FFA可以更早期发现糖尿病患者眼底RNFL的病变,且无创、灵敏度高,更适于临床中应用于DR的早期筛查。
处于临床前期的DR患者已经有眼底视盘周围RNFL厚度变薄,此可能是由DR临床前期至DR1期的“窗口期”,OCT为检测此“窗口期”的有效手段。糖尿病患者只要病程足够长,绝大部分会出现视网膜病变。DR一旦进展至临床期,留给医生的时间和手段都很有限,而且预后总体不好,而在临床前期医生却有10年的时间可以干预这一疾病的进程。现在借助OCT等现代化的检查手段能够发现“窗口期”的视网膜病变,这是否会成为DR患者治疗的一个关键时期尚需进一步研究。
1 Hargadon DD,Wood J,Twelker JD,et al.Recognition acuity,grating acuity,contrast sensitivity,and visual fields in 6-year-old children[J].Arch Ophthamlol,2010,128(1):70-74.
2 Lakhani E,Wright T,Abdolell M,et al.Multifocal ERG defects associated with insufficient long-term glycemic control in adolescents with type 1 diabetes[J].Invest Ophthamlol Vis Sci,2010,51 (10):5297-5303.
3 Chaturvedi NL,Sjoelie AK,Porta M,et al.Markers of insulin resistance are strong risk factors for retinopathy incidence in type 1 diabetes[J].Diabetes Care,2001,24(2):284-289.
4 Peng PH,Lin HS,Lin S.Nerve fibre layer thinning in patients with preclinical retinopathy[J].Can J Ophthalmol,2009,44(4):417-422.
5 Chihara E,Matsuoka T,Ogura Y,et al.Retinal nerve fiber layer defect as an early manifestation of diabetic retinopathy [J].Ophthalmology,1993,100(8):1147-1151.
6 赵海岚,方丽华.无视网膜病变的糖尿病患者视网膜神经纤维层及黄斑中心凹厚度的动态变化[J].浙江医学,2012,34(4):244-247.
7 熊小艳,毛新帮,王婵婵,等.视网膜神经纤维层厚度与糖尿病视网膜病变程度的相关性研究[J].眼科新进展,2011,31(5):438-440.
8 刘杏.眼科临床光学相干断层成像学[M].广州:广东科技出版社,2006:68.
9 Oshitari T,Roy S.Diabetes:a potential enhancer of retinal injury in rat retinas[J].Neurosci Lett,2005,390(1):25-30.
10 Park SH,Park JW,Park SJ,et al.Apoptotic death of photoreceptors in the streptozotoc in induced diabetic rat retina[J].Diabetologia,2003,46(9):1260-1268.
11 Fukuda M,Nakanishi Y,Fuse M,et al.Altered expression of aquaporins 1 and 4 coincides with neurodegenerative events in retinas of spontaneously diabetic Torii rats [J].Exp Eye Res,2010,90(1):17-25.
