壶腹癌有效化疗方案研究
2014-02-08远丽芳丛明华孙晓莹朱爱华姚克青房艳星陈华强崔成旭
远丽芳,丛明华,孙晓莹,朱爱华,姚克青,房艳星,陈华强,崔成旭
壶腹周围癌占胃肠道肿瘤的5%,而壶腹癌更少见,仅占胃肠道肿瘤的0.2%[1-2]。胰十二指肠切除术(whipple 术)是壶腹癌的标准术式,但对壶腹癌的化疗至今无标准方案。本研究旨在通过回顾性分析壶腹癌患者的临床特征及治疗过程,以提高临床对其治疗效果。
1 资料与方法
1.1 一般资料 选取2005年1月—2013年10月北京市朝阳区桓兴肿瘤医院及中国医学科学院肿瘤医院收治住院的经组织病理学确诊的壶腹癌患者21例,其中男12例,女9例;年龄28~69岁,中位年龄56岁;临床表现为:黄疸16例,高热5例,腹痛4例,上腹部不适3例,呕吐1例,黑便1例;发病时分期为:Ⅰ期3例,Ⅱ期11例,Ⅲ期6例,Ⅳ期1例;病理分级为:高分化6例,中分化10例,低分化3例,分化不明确2例。发病时糖类抗原199(CA119)高于参考值(40 U/L)6例,癌胚抗原(CEA)高于参考值(5 μg/L)8例。患者中20例接受whipple 术,其中17例进展,淋巴结转移12例、肝转移9例、腹膜转移6例、肺转移3例。进展期患者均有影像学证据,有可评价的靶病灶,且完成6周以上化疗。
1.2 治疗方法 铂类联合氟尿嘧啶方案包括:XELOX方案(奥沙利铂130 mg/m2+卡培他滨1 000 mg/m2,每3周1次),顺铂联合氟尿嘧啶方案〔顺铂75 mg 静脉滴注(第1天)+(亚叶酸钙400 mg/m2静脉滴注2 h,氟尿嘧啶400 mg/m2静脉推注);随后氟尿嘧啶2 400 mg/m2持续静脉滴注46 h,每2周1次〕,FOLFOX6方案〔顺铂75 mg静脉滴注(第1天),奥沙利铂130 mg/m2静脉滴注2 h(第1天),每2周1次〕。吉西他滨联合铂类方案包括:GEMOX方案〔吉西他滨 1 000 mg/m2静脉滴注(第1、8天各1次)+奥沙利铂 130 mg/m2静脉滴注2 h(第1天),每3周1次〕,GP方案〔 吉西他滨 1 000 mg/m2静脉滴注(第1、8天各1次)+顺铂75 mg/m2静脉滴注(第1天),每3周1次〕,吉西他滨联合洛铂方案〔吉西他滨 1 000 mg/m2静脉滴注(第1、8天各1次)+洛铂30 mg/m2,每3周1次〕。其余方案包括:FOIFIRI方案〔CF 400 mg/m2静脉滴注2 h,5-FU 400 mg/m2静脉推注;随后 2 400 mg/m2持续静脉滴注 46 h时,伊立替康180 mg/m2静脉滴注30~90 min(第1天),每2周1次〕,单药替吉奥(80 mg/m2),培美曲塞(500 mg/m2)联合奥沙利铂。贝伐单抗(5 mg/kg,每2周1次;7.5 mg/kg,每3周1次),西妥西单抗(首剂400 mg/m2,以后每周250 mg/m2)。根据患者是否接受化疗分为接受化疗组和未接受化疗组;根据化疗方案不同分为铂类联合氟尿嘧啶方案组和其他方案(吉西他滨联合铂类方案和其余方案)组。姑息化疗(指晚期化疗,由于实体肿瘤的化疗治愈率低,故称姑息化疗)中,一开始使用的方案为一线化疗方案,化疗失败后换用的第二、三个化疗方案为二、三线化疗方案。
1.3 疗效评价 按RECIST实体瘤评价标准[3],分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD),CR和PR为有效。毒副作用按WHO抗癌药物急性、亚急性标准[3]分为0~Ⅳ级,消化道反应:无反应为0级,恶心为Ⅰ级,暂时性呕吐为Ⅱ级,呕吐需治疗为Ⅲ级,难控制的呕吐为Ⅳ级;骨髓抑制:白细胞计数≥4.0×109/L为0级,白细胞计数在3.0×109/L~3.9×109/L为Ⅰ级,白细胞计数在2.0×109/L~2.9×109/L为Ⅱ级,白细胞计数在1.0×109/L~1.9×109/L为Ⅲ分级,白细胞计数<1.0×109/L为Ⅳ级。所有患者随访至2013年10月,记录患者的生存期(OS)、无进展生存期(PFS)。
1.4 统计学方法 所有数据录入微机,建立Excel软件数据库,采用SAS统计学软件进行数据分析,计数资料采用χ2检验或Fisher确切概率检验;采用Kaplan-Meier法进行生存分析及用log-rank法比较生存曲线;采用COX风险比例回归模型评估多因素对中位OS的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 患者OS比较 21例患者中死亡13例,失访2例,生存6例,中位OS为22.3个月。17例患者接受辅助化疗(肿瘤根治术后化疗)或姑息化疗,4例未接受化疗。接受化疗组患者中位OS(28.7个月)与未接受化疗组患者(14.9个月)比较,差异无统计学意义〔OR(95%CI)=0.928(0.19,4.33),χ2=0.93,P=0.92,见图1〕。接受铂类联合氟尿嘧啶方案7例,接受其他方案10例。接受铂类联合氟尿嘧啶方案组患者中位OS(36.4个月)与其他方案组(18.7个月)比较,差异有统计学意义〔OR(95%CI)=0.21(0.04,0.97),χ2=3.95,P=0.04,见图2〕。
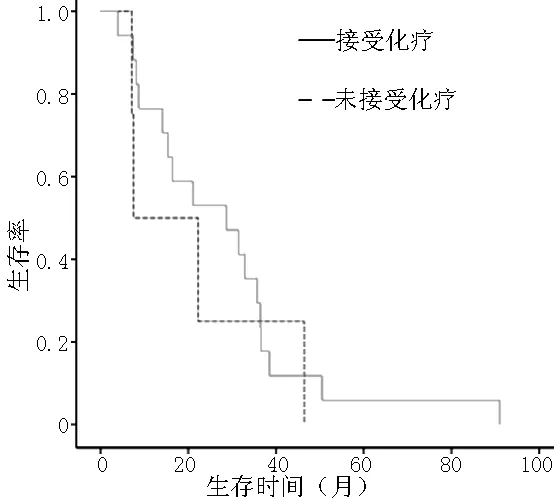
图1 接受化疗组与未接受化疗组生存曲线
Figure1 The chemotherapy group and did not receivechemotherapy group survival curve
2.2 进展期患者化疗有效率 15例进展期患者接受姑息化疗,6例接受铂类联合氟尿嘧啶方案,其中XELOX方案4例,顺铂联合氟尿嘧啶方案1例,FOLFOX6方案1例;6例接受吉西他滨联合铂类方案,其中GEMOX方案4例,GP方案1例,吉西他滨联合洛铂方案1例;3例接受其余方案,其中FOIFIRI方案1例,单药替吉奥1例,培美曲塞联合奥沙利铂1例。
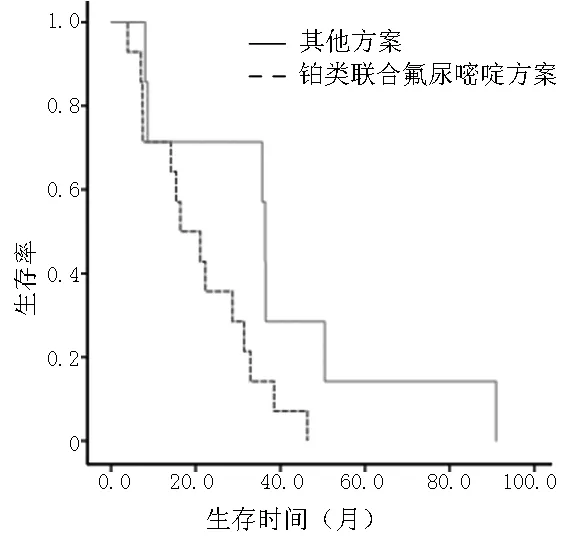
图2 铂类联合氟尿嘧啶类方案与其他方案生存曲线
Figure2 Platinum combined with fluorouracil with other schemes survival curve
15例进展期患者接受不同方案化疗后有效率为13.3%(2/15),其中CR 0例,PR 2例,SD 4例,PD 9例。铂类联合氟尿嘧啶方案有效率为33.3%(2/6),其中XELOX方案及顺铂联合氟尿嘧啶方案各1例,高于其他方案(P=0.014)。
2.3 进展期患者化疗对PFS及OS的影响 进展期患者PFS 2.0个月,铂类联合氟尿嘧啶方案组PFS(2.7个月)与其他方案组(2.0个月)比较,差异无统计学意义〔OR(95%CI)=0.33(0.08,2.33),χ2=1.53,P=0.43〕。进展期患者OS为 11.2个月,铂类联合氟尿嘧啶方案组OS(11.6个月)与其他方案组(10.9个月)比较,差异无统计学意义〔OR(95%CI)=0.57(0.13,2.42),χ2=1.06,P=0.45〕。
2.4 二线及三线化疗 4例接受二线化疗,3例接受三线化疗,应用的化疗方案有FOIFIRI方案、紫杉醇联合替吉奥、伊立替康联合替吉奥及贝伐珠单抗、伊立替康联合贝伐珠单抗及西妥昔单抗。其中PR 1例,为FOIFIRI方案。
2.5 辅助化疗 入选的21例患者中,有20例接受手术治疗,其无病生存期(DFS)为16.1个月。随访至2013年10月,有17例进展,3例未进展。20例患者中有6例接受辅助化疗,接受辅助化疗患者OS(35.6个月)与未辅助化疗患者(21.0个月)比较,差异无统计学意义〔OR(95%CI)=1.19(0.33,4.25),χ2=0.07,P=0.79〕。接受辅助化疗患者DFS(22.1个月)与未辅助化疗患者(9.3个月)比较,差异无统计学意义〔OR(95%CI)=0.86(0.29,2.46),χ2=0.13,P=0.77〕。
2.6 Cox回归分析 性别、年龄、发病时分期,病理分级、CA119、CEA与壶腹癌患者OS 无关(P>0.05,见表1)。
表1 壶腹癌患者OS的多变量Cox回归分析
Table1 Multivariate Cox regression analysis of OS in ampullary carcinoma patients
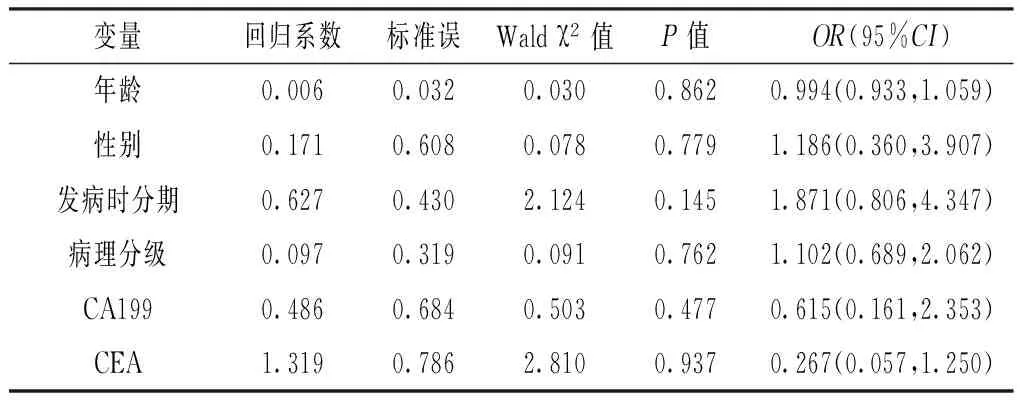
变量回归系数标准误Waldχ2值P值OR(95%CI)年龄0.0060.0320.0300.8620.994(0.933,1.059)性别0.1710.6080.0780.7791.186(0.360,3.907)发病时分期0.6270.4302.1240.1451.871(0.806,4.347)病理分级0.0970.3190.0910.7621.102(0.689,2.062)CA1990.4860.6840.5030.4770.615(0.161,2.353)CEA1.3190.7862.8100.9370.267(0.057,1.250)
2.7 毒副作用 消化道反应7例,其中Ⅰ度2例,Ⅱ度5例,均经对症治疗缓解;骨髓抑制6例,Ⅰ度2例,Ⅱ度2例,Ⅲ度1例,Ⅳ度1例,均经治疗恢复。
3 讨论
手术是壶腹癌的主要治疗方案,其切除率为50%,远高于胰腺癌的10%[4]。whipple术是其标准术式,5年生存率为33%~68%。进展期或转移性壶腹癌预后差,其2年生存率为5%~10%[5]。由于壶腹癌发病率低,目前还没有统一的标准化疗方案,国内也未见壶腹癌化疗报道。
国外探索壶腹癌化疗多包含于胆管癌的研究中,最著名的是ABC-3研究,其是英国Valle等[6]完成的多中心、随机、对照 Ⅲ期临床试验,结果表明GP方案优于吉西他滨单药,OS延长3.6个月,PFS延长3.0个月,且均有统计学差异。自此,GP方案成为胆管细胞癌姑息治疗的标准方案。但其入组的患者包括胆管上皮癌、胆囊癌及壶腹癌,其中壶腹癌20例,未见壶腹癌亚组分析结果。Romiti等[7]的研究结果显示,所入选的20例转移性壶腹癌患者中,7例接受以吉西他滨为基础的化疗方案均无效。提示壶腹癌和胆管癌化疗有效方案不尽相同。
本研究结果显示,接受姑息化疗或辅助化疗的患者无生存获益,接受铂类联合氟尿嘧啶类化疗的患者OS较其他方案患者生存时间延长,与Valle等[6]的研究结果不同。这可能与本组肠型患者较多,其生物学行为与结肠癌和十二指肠癌[8]相似,对铂类和氟尿嘧啶类化疗敏感有关。本研究还发现,15例进展期壶腹癌患者,化疗有效率为13.3%,其中2例PR患者均来自铂类联合氟尿嘧啶方案;6例患者接受铂类联合氟尿嘧啶类方案,2例PR,2例SD,有效率为33.3%,提示有超过60%的患者从铂类联合氟尿嘧啶类化疗方案中获益。而Overman等[9]的Ⅱ期临床研究中,有12例转移性壶腹癌患者接受奥沙利铂联合卡培他滨方案,有效率33.0%。本研究显示,接受吉西他滨联合铂类方案6例,未见有效病例,提示铂类联合氟尿嘧啶方案可能为治疗转移性壶腹癌的较优化疗方案。本研究有4例患者接受二线或三线化疗,其中有1例PR(应用FORFIRI方案),对体力状况较好的一线化疗失败患者,不宜过早放弃治疗。
国外对壶腹癌的辅助治疗研究较多,但结果不尽相同。Kim等[10]和Narang等[11]研究显示,壶腹癌术后辅助放化疗可从治疗中获益,而Zhou等[12]的研究证实,术后辅助放化疗对壶腹癌患者不能带来生存获益。Neoptolemos等[13]的多中心、随机、开放对照研究表明,氟尿嘧啶及吉西他滨和对照组相比,未延长壶腹癌患者的生存期,亚组分析RO切除患者辅助化疗获益,但无统计学差异。本研究结果显示,辅助化疗患者OS和DFS均长于未化疗组,但未见统计学差异,可能与本研究样本量小,检验效能差有关。
靶向药物的应用为晚期消化道肿瘤提供了新的选择,多项研究表明,西妥昔单抗联合化疗可提高K-RAS野生型结肠癌患者的OS[14]。而国外研究表明壶腹癌患者血管内皮生长因子(VEGF)及环氧合酶-2(COX2)高表达[15]。Yoshikawa等[16]结果表明,表皮生长因子受体(EGFR)在胆管细胞癌高表达。Gruenberger 等[17]的研究表明,奥沙利铂联合吉西他滨及西妥昔单抗治疗胆管上皮癌有效率达63.3%,提示靶向药物对胆管癌有较高疗效。
本研究探索了性别、年龄、发病时分期,病理分级、CA199、CEA等与壶腹癌患者OS的关系,均未发现与OS有关。这可能与本研究样本量小,检验效能较低有关。本研究耐受性较好,仅有2例出现Ⅲ/Ⅳ度粒细胞抑制,经治疗恢复,5例患者Ⅱ度消化道反应,经对症治疗均缓解,无治疗相关死亡。
总之,氟尿嘧啶联合铂类治疗壶腹癌有一定疗效,耐受性较好。但本组为回顾性研究,患者的选择及相关结果可能存在一定的偏倚,因此需深入探索。
1 Kim RD,Kundhal PS,McGilvray ID,et al.Predictors of failure after pancreaticoduodenectomy for ampullary carcinoma[J].J Am Coll Surg,2006,202(1):112-119.
2 Howe JR,Klimstra DS,Moccia RD,et al.Factors predictive of survival in ampullary carcinoma[J].Ann Surg,1998,228(1):87-94.
3 孙燕,石远凯.肿瘤咳咳手册[M].北京:人民卫生出版社.2007:149-150.
4 Riall TS,Cameron JL,Lillemoe KD,et al.Resected periampullary adenocarcinoma:5-year survivors and their 6- to 10-year follow-up[J].Surgery,2006,140(5):764-772.
5 Key C,Meisner ALW.Cancers of the liver and biliary tract.In:Ries LAG,Young JL,Keel GE,Eisner MP,Lin YD,HornerMJ,editors.SEER survival monograph:cancer survivalamong adults:US SEER Program,1988—2001,patient and tumor characteristics.Bethesda,MD:National Cancer Institute[J].SEER Program,2007:49-58.
6 Valle J,Wasan H,Palmer DH,et al.Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer[J].N Engl J Med,2010,362(14):1273-1281.
7 Romiti A,Barucca V,Zullo A,et al.Tumors of ampulla of Vater:A case series and review of chemotherapy options[J].World J Gastrointest Oncol,2012,4(3):60-67.
8 Westgaard A,Tafjord S,Farstad IN,et al.Pancreatobiliary versus intestinal histologic type of differentiation is an independent prognostic factor in resected periampullary adenocarcinoma[J].BMC Cancer,2008,8:170.
9 Overman MJ,Varadhachary GR,Kopetz S,et al.Phase Ⅱstudy of capecitabine and oxaliplatin for advanced adenocarcinoma of the small bowel and ampulla of Vater[J].J Clin Oncol,2009,27(16):2598-2603.
10 Kim K,Chie EK,Jang JY,et al.Role of adjuvant chemoradiotherapy for ampulla of Vater cancer[J].Int J Radiat Oncol Biol Phys,2009,75(2):436-441.
11 Narang AK,Miller RC,Hsu CC,et al.Evaluation of adjuvant chemoradiation therapy for ampullary adenocarcinoma:the Johns Hopkins Hospital-Mayo Clinic collaborative study[J].Radiat Oncol,2011,6:126.
12 Zhou J,Hsu CC,Winter JM,et al.Adjuvant chemoradiation versus surgeryalone for adenocarcinoma of the ampulla of Vater[J].Radiother Oncol,2009,92(2):244-248.
13 Neoptolemos JP,Moore MJ,Cox TF,et al.European Study Group for Pancreatic Cancer.Ampullary cancer ESPAC-3(v2) trial:A multicenter,international,open-label,randomized controlled phase Ⅲ trial of adjuvant chemotherapy versus observation in patients with adenocarcinoma of the ampulla of vater[J].J Clin Oncol,2011(Suppl):29.
14 Cunningham D,Humblet Y,Siena S,et al.Cetuxiamb mono-therapy and Cetuximab plus Irinotecan in Iriontecan-refractory metastatic colorectal cancer[J].N Engl J Med,2004,351(4):337-345.
15 Perrone G,Santini D,Verzì A,et al.COX-2 expression in ampullary carcinoma:correlation with angiogenesis process and clinicopathological variables[J].J Clin Pathol,2006,59(5):492-496.
16 Yoshikawa D,Ojima H,Iwasaki M,et al.Clinicopathological and prognostic significance of EGFR,VEGF,and HER2 expression incholangiocarcinoma[J].Br J Cancer,2008,98(2):418-425.
17 Gruenberger B,Schueller J,Heubrandtner U,et al.Cetuximab,gemcitabine,and oxaliplatin in patientswith unresectable advanced or metastatic biliary tract cancer:a phase 2 study[J].Lancet Oncol,2010,11(12):1142-1148.
