环氧化酶2基因多态性与中国汉族人群缺血性脑卒中及其亚型的关系研究
2014-02-08陈忠云李珊珊徐志伟
陈忠云,李珊珊,李 婧,徐志伟,杨 旭
脑卒中已成为我国居民死亡的首要原因[1],其中约80%是缺血性脑卒中(ischemic stroke,IS)[2]。新近研究表明,炎性反应在IS的发病机制中发挥重要作用,编码炎性分子的基因变异可能影响IS的发生、发展过程[3-4]。环氧化酶(cyclooxygenase,COX)作为催化花生四烯酸合成各种内源性前列腺素(prostaglandins,PGs)的限速酶,通过其代谢产物前列腺素E2(PGE2)来调节炎性反应[5]。COX在人体内主要存在COX-1和COX-2两种亚型。COX-2为诱导型,只在炎症及细胞因子等刺激因素诱导下生成。已有研究表明COX-2基因多态性与IS密切相关[6-7],但亦存有争议[4,8]。Kim等[9]研究指出,不同病因的IS可能存在不同的遗传背景,忽略这种差异可能会得到矛盾的结论。基于此,本研究拟探讨COX-2基因两个基因多态性位点(-1195G>A和-765G>C)与IS及其亚型的相关性。
1 对象与方法
1.1 研究对象 于2011年12月—2013年7月连续收集入住航天中心医院(北京大学航天临床医学院)神经内科的IS患者355例。IS定义为由脑缺血而引起的突发的持续时间超过24 h的局灶性或全脑神经功能损伤,并经颅脑磁共振成像(MRI)或计算机断层扫描(CT)证实。根据1993年TOAST诊断标准[10]对IS进行病因学分型:大动脉粥样硬化性卒中(large-artery atherosclerosis,LAA)93例、心源性脑梗死(cardioembolism,CE)52例、小动脉闭塞性卒中或腔隙性卒中(small vessal occlusion,SVO)117例、其他原因(stroke of other determined etiology,SOD)43例及不明原因(stroke of undetermined etiology,SUD)50例。本研究共纳入SVO患者117例(SVO组)和LAA患者93例(LAA组)作为IS组,其中男123例、女87例,平均年龄(61.6±12.1)岁。患者均在发病5 d内入选。同期从体检中心采用简单随机抽样法选取266例体检健康者作为对照组,男160例、女106例,平均年龄(62.1±10.8)岁。排除严重感染、骨髓增生异常综合征、恶性浆细胞病、肿瘤、肝病、肾病等患者。入选受试者均为中国汉族人,并居住在北京地区。本研究协议经我院伦理协会和医院伦理委员会审查批准,受试者均签署知情同意书。
1.2 资料收集与检测指标 本研究采用病例对照研究。对受试者进行问卷调查,收集危险因素,包括高血压、糖尿病、冠心病、吸烟、饮酒、体质指数(BMI)等资料。如果患者无法沟通,通过其直系亲属采集病史资料。
于患者住院次日清晨空腹抽取肘静脉血4 ml,用全自动分析仪测定低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、总胆固醇(TC)。
1.3 基因提取及分型 于患者住院次日清晨空腹抽取肘静脉血2 ml抗凝(枸橼酸钠和EDTA-K2联合抗凝),按照DNA提取试剂盒(TIANGEN)操作,提取全血标本DNA。提取的基因组DNA于-80 ℃保存备用。运用扩增阻滞突变系统(ARMS)结合荧光探针(TaqMan)技术的方法(ARMS-TaqMan),采用ABI公司的TaqExpress软件(ABI,Foster City,CA)设计引物和探针,由北京赛百盛生物技术公司合成。测定的基因型均通过测序法进行验证。-1195 G>A位点突变扩增片段长度119 bp,引物3′端-2位引入错配碱基“T”(正配碱基应为“A”),-765 G>C位点突变扩增片段长度116 bp,引物3′端-2位引入错配碱基“T”(正配碱基应为“C”,见表1)。
ARMS-TaqMan法的PCR反应体系及测定条件:反应体系20 μl,包括:反应液8 μl,上、下游引物各1 μl,增强液1 μl,探针1 μl,H2O 6 μl,模板2 μl;使用7500荧光定量PCR测定仪(美国ABI公司)检测探针羧基荧光素的荧光信号。-1195 G>A、-765 G>C位点突变反应条件为94 ℃ 5min,94 ℃ 25 s、60 ℃ 35 s 40个循环,以2~9个循环为基线和阈值0.02确定循环阈值(Ct值)。
ARMS-TaqMan法检测不同基因型判定标准的建立:利用引物3′端与模板正配与错配扩增效率不同,以已知浓度梯度不同基因型质粒标准品为模板,按上述反应条件,通过荧光信号检测确定PCR反应有无指数扩增期和Ct值,确定可区分位点突变检测的浓度范围。在可区分位点突变检测的浓度范围内,记录不同拷贝数的野生引物Ct值(Wct)和突变引物Ct值(Mct),计算两者差值Δct(Δct= Wct-Mct),根据总体均数计算Δct的99%可信区间(Δct±2.58)及PCR扩增时有无指数增长期,建立各种等位基因型的判定标准。


表1 COX-2基因位点突变引物及探针序列
注:序列中加_的碱基是引入的错配碱基,用以增加引物特异性
2 结果
2.1 临床资料比较 IS组高血压、糖尿病患病率,吸烟率,饮酒率,BMI及TG、TC、LDL-C水平高于对照组(P<0.05);SVO组高血压、糖尿病患病率,饮酒率,BMI及TG、TC、LDL-C水平高于对照组(P<0.05);LAA组高血压、糖尿病患病率,饮酒率,BMI及TG、TC、LDL-C水平明显高于对照组(P<0.05);IS组、SVO组、LAA组HDL-C水平均低于对照组(P<0.05,见表2)。
2.2 COX-2基因-1195G>A和-765G>C基因型、等位基因分布频率比较 -1195G>A和-765G>C基因型分布均符合Hardy-Weinberg平衡(χ2=0.757,P=0.384;χ2=3.016,P=0.082)。
对照组与IS组COX-2基因-1195G>A位点基因型分布频率及等位基因分布频率间差异无统计意义(P>0.05)。与对照组-1195G>A位点GG基因型相比,AA基因型及携带A等位基因(GA+AA)发生SVO的风险更高〔OR=2.20,95%CI(1.15,4.22),P=0.02;OR=1.67,95%CI(1.01,2.77),P=0.04〕;行多因素Logistic回归校正年龄、性别及传统危险因素后,仍有统计学意义〔OR=2.18,95%CI(1.05,4.51),P=0.04;OR=1.76,95%CI(1.01,3.11),P=0.05〕。LAA组-1195G>A位点基因型分布频率、等位基因分布频率与对照组相比,差异无统计学意义(P>0.05)。
对照组与IS组、LAA组、SVO组比较,COX-2基因-765G>C位点的基因型分布频率间差异无统计学意义(χ2=0.30,P=0.86;χ2=0.24,P=0.89),等位基因分布频率在各组间差异亦无统计学意义(χ2=0.18,P=0.67;χ2=0.24,P=0.62,见表3)。
2.3 COX-2基因2个SNPs位点的单体型分布频率比较 连锁不平衡分析提示-1195G>A与-765G>C存在一定的连锁不平衡(D′=0.52,r2=0.13)。2个SNPs共构建G-G、G-C、A-G、A-C 4个单体型,其中单体型G-G在IS组及对照组中频率最大(48.1%和52.3%)。SVO组单体型A-G频率高于对照组(41.1% 和32.7%),差异有统计学意义〔OR=1.44,95%CI(1.05,1.97),P=0.02〕。IS组和LAA组与对照组单体型分布频率间差异无统计学意义(P>0.05,见表4)。

表2 各组受试者临床资料比较
注:与对照组比较,*P<0.05;●为χ2值;△为对照组与IS组比较,▲为对照组与SVO组、LAA组比较;BMI=体质指数,TG=三酰甘油,TC=总胆固醇,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇
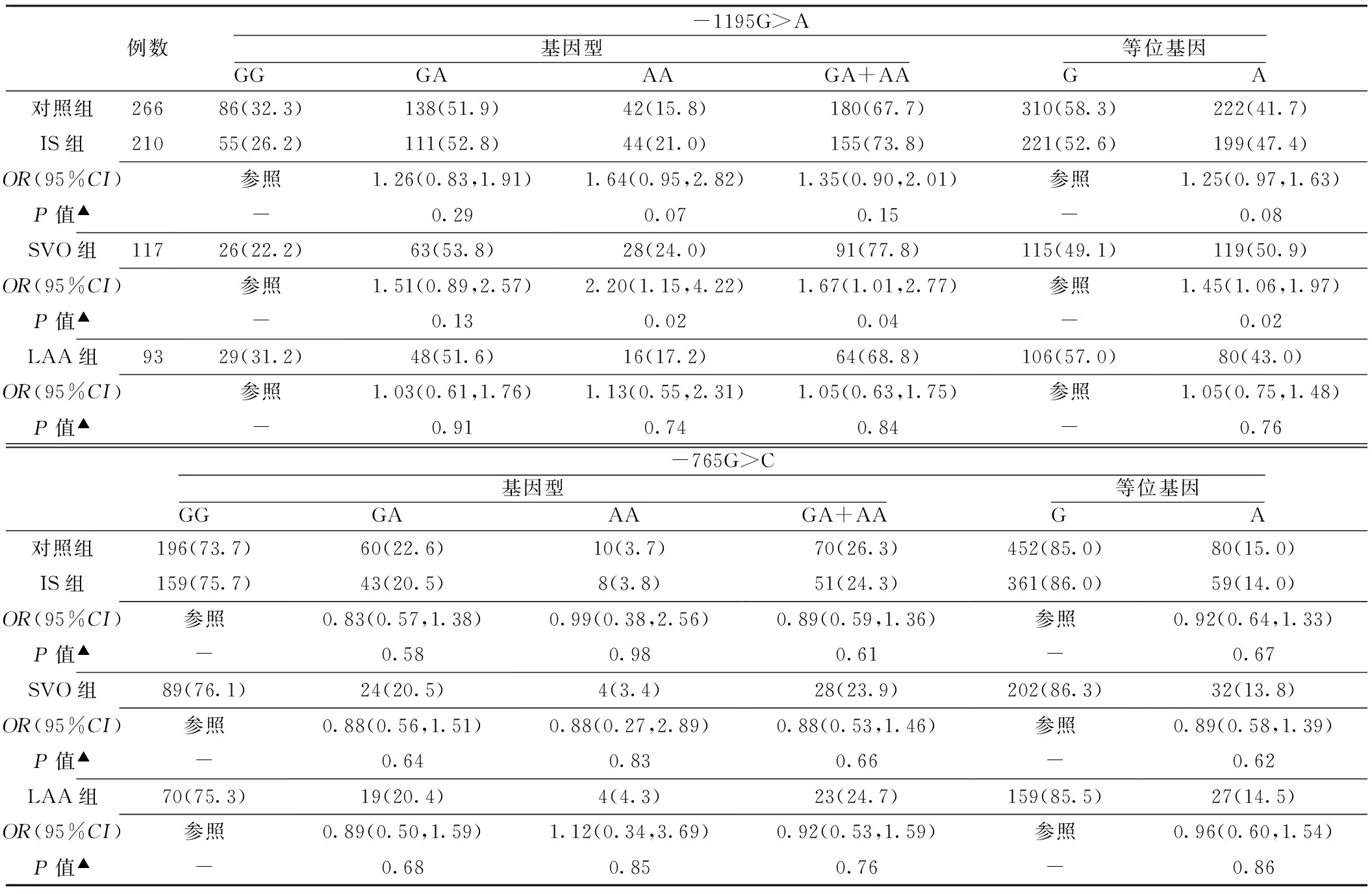
表3 各组受试者COX-2基因SNPs基因型、等位基因分布频率比较〔n(%)〕
注:▲与对照组比较
表4 各组受试者COX-2基因单体型分布频率比较〔n(%)〕
Table4 Comparison of haplotypes frequency distribution of the COX-2 gene in each group
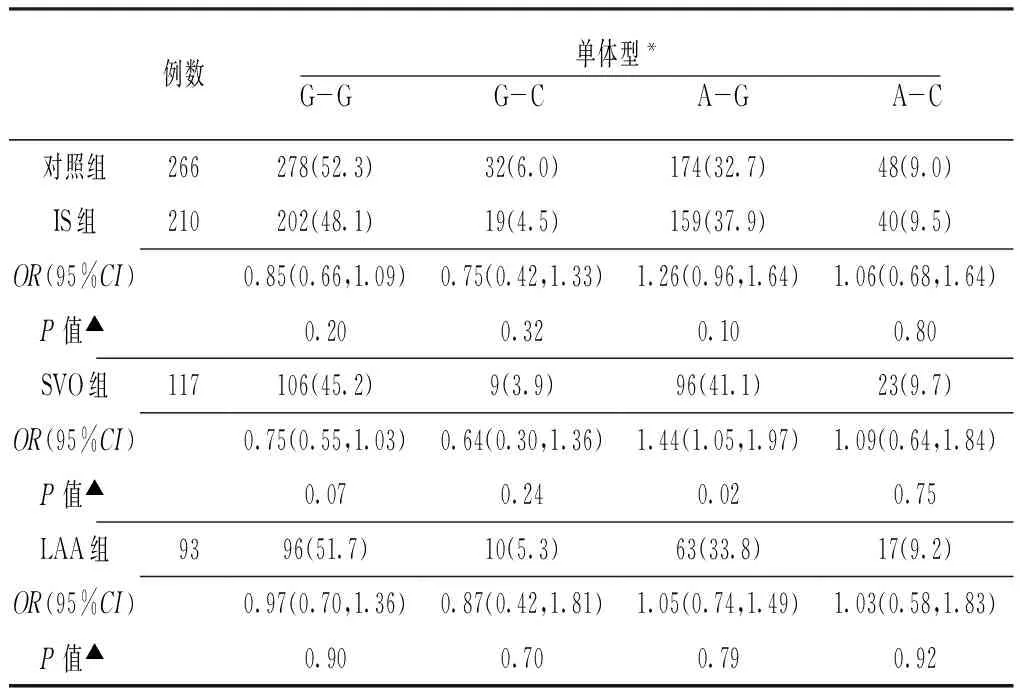
例数单体型*G-G G-C A-G A-C对照组266278(52.3)32(6.0)174(32.7)48(9.0)IS组210202(48.1)19(4.5)159(37.9)40(9.5)OR(95%CI)0.85(0.66,1.09)0.75(0.42,1.33)1.26(0.96,1.64)1.06(0.68,1.64)P值▲0.200.320.100.80SVO组117106(45.2)9(3.9)96(41.1)23(9.7)OR(95%CI)0.75(0.55,1.03)0.64(0.30,1.36)1.44(1.05,1.97)1.09(0.64,1.84)P值▲0.070.240.020.75LAA组9396(51.7)10(5.3)63(33.8)17(9.2)OR(95%CI)0.97(0.70,1.36)0.87(0.42,1.81)1.05(0.74,1.49)1.03(0.58,1.83)P值▲0.900.700.790.92
注:*表示单体型按照-1195G >A及-765G>C列出;▲与对照组比较
3 讨论
本研究以中国汉族人群作为研究对象,探讨COX-2基因-1195G>A和-765G>C与IS及其亚型的相关性,结果显示-1195G>A和-765G>C基因型、等位基因频率及其组成单体型与IS的发生均无相关性;校正相关危险因素后仍无统计学意义。进一步探讨COX-2基因多态性与IS亚型的相关性,结果显示-1195 AA基因型及携带A等位基因(AA+GA)与SVO有关,而与LAA无关;构建单体型,结果亦显示单体型A-G与SVO相关。
人类COX-2基因位于1号染色体q25.2~q25.3,含有10个外显子和9个内含子。在基础条件下,COX-2基因表达是高度受限的,在正常生理情况下几乎不表达,但在受到内外环境刺激时可使COX-2呈过度表达。COX-2基因-765G>C位点与-1195G>A位点均位于启动子位置,既往研究表明,该位点突变能改变启动子的活性从而影响COX-2的表达[11-12]。
既往关于COX-2基因-1195G>A位点的研究多局限在炎症[13]和肿瘤[14]方面。本研究发现,与纯合野生基因GG相比,A等位基因携带者患SVO的风险更大,这个结果与Chen等[6]的结论一致。但关于此位点的研究结论仍有争议。国内学者杜丹华等[15]研究表明,该位点与IS及其亚型无相关性。Zhang等[12]研究发现,-1195G>A位点变异可以产生一个新的转录因子C-MYB结合位点,与G等位基因相比,A等位基因可以提高启动子活性及COX-2 mRNA的表达。但是,COX-2基因多态性影响SVO的确切机制尚不清楚。已有研究发现,COX-2通过调节炎性反应在血栓形成中发挥着重要作用[16]。因此,猜测-1195G>A位点A等位基因携带者的COX-2水平升高,引起PGE2水平的升高,从而通过炎性反应促进SVO的形成,但仍需进一步研究。
Cipollone等[7]研究发现,COX-2基因-765G>C位点GC和CC基因型与卒中发病率降低相关,提出C等位基因可能为减少卒中发病率的遗传保护性因子。然而,Kohsaka等[17]研究结果提示,与GG基因型相比,GC与CC基因型携带者发生卒中的可能性更大〔OR=1.34,95%CI(1.03,1.74),P=0.03〕。本研究并未发现-765G>C位点基因型、等位基因频率与IS及其亚型相关,这与Lemaitre等[4]研究结论相一致。Li等[8]针对-765G>C与IS是否存在相关性进行了Meta分析,共纳入1 628例IS患者及17 653例对照,结果亦显示,与GG基因型相比,GC与CC基因型携带者与IS的发生无相关性〔OR=1.11,95%CI(0.88,1.06)〕。
遗传异质性可能是这些结论有争议的原因之一。首先,本研究对照组-1195G>A的基因型频率GG为32.3%,GA为51.9%,AA为15.8%,这与国内其他研究相一致(GG为24%,GA为48%,AA为29%)[15],而与国外的研究相比该基因型分布频率差异较大(GG为5%,GA为33%,AA为62%)[18]。同样,此种差异在-765G>C位点亦较显著[19]。其次,由于IS的病因不同,遗传因素在不同亚型中发挥的作用也不同,关于这两个位点与IS的研究,既往研究多未对IS进行分型,因此可能对研究结果产生了一定的影响。
总之,本研究提示,COX-2基因-1195G>A多态性及单体型A-G与SVO相关联,但仍需扩大样本并且在不同种族之间进一步分析-1195G>A对IS及其亚型发生的影响。
1 Yang G,Wang Y,Zeng Y,et al.Rapid health transition in China,1990-2010: findings from the Global Burden of Disease Study 2010[J].Lancet, 2013,381(9882):1987-2015.
2 Matarin M,Singleton A,Hardy J,et al.The genetics of ischaemic stroke[J].J Intern Med,2010,267(2):139-155.
3 Rodriguez-Yanez M,Castillo J.Role of inflammatory markers in brain ischemia[J].Curr Opin Neurol,2008,21(3):353-357.
4 Lemaitre RN,Rice K,Marciante K,et al.Variation in eicosanoid genes,non-fatal myocardial infarction and ischemic stroke[J].Atherosclerosis, 2009,204(2):e58-e63.
5 Warner TD,Mitchell JA.Cyclooxygenases:new forms,new inhibitors,and lessons from the clinic[J].FASEB J,2004,18(7):790-804.
6 Chen GZ,Shan XY,Cheng GP,et al.Cyclooxygenase-2 genetic polymorphism and stroke subtypes in Chinese[J].J Mol Neurosci,2013,51(2):467-473.
7 Cipollone F,Toniato E,Martinotti S,et al.A polymorphism in the cyclooxygenase 2 gene as an inherited protective factor against myocardial infarction and stroke[J].JAMA,2004,291(18):2221-2228.
8 Li W,Xu J,Wang X,et al.Cyclooxygenase-2(COX-2) G-765C is a protective factor for coronary artery disease but not for ischemic stroke: a meta-analysis[J].Atherosclerosis,2009,207(2):492-495.
9 Kim Y,Lee C.The gene encoding transforming growth factor beta 1 confers risk of ischemic stroke and vascular dementia[J].Stroke,2006,37(11):2843-2845.
10 Adams HP Jr,Bendixen BH,Kappelle LJ,et al.Classification of subtype of acute ischemic stroke.Definitions for use in a multicenter clinical trial.TOAST.Trial of Org 10172 in Acute Stroke Treatment[J].Stroke,1993,24(1):35-41.
11 Her MY,El-Sohemy A,Cornelis MC,et al.Cyclooxygenase-2 polymorphisms and risk of systemic lupus erythematosus in Koreans[J].Rheumatol Int,2006,27(1):1-5.
12 Zhang X,Miao X,Tan W,et al.Identification of functional genetic variants in cyclooxygenase-2 and their association with risk of esophageal cancer[J].Gastroenterology,2005,129(2):565-576.
13 Daing A,Singh SV,Saimbi CS,et al.Cyclooxygenase 2 gene polymorphisms and chronic periodontitis in a North Indian population: a pilot study[J].J Periodontal Implant Sci,2012,42(5):151-157.
14 Guo S,Li X,Gao M,et al.Synergistic association of PTGS2 and CYP2E1 genetic polymorphisms with lung cancer risk in northeastern Chinese[J].PLoS One,2012,7(6):e39814.
15 杜丹华,吴江,高鹏,等.环氧合酶基因多态性与缺血性卒中相关性研究[J].中风与神经疾病杂志,2008,25(1):49-52.
16 Linton MF,Fazio S.Cyclooxygenase-2 and inflammation in atherosclerosis[J].Curr Opin Pharmacol,2004,4(2):116-123.
17 Kohsaka S,Volcik KA,Folsom AR,et al.Increased risk of incident stroke associated with the cyclooxygenase 2(COX-2) G-765C polymorphism in African-Americans: the Atherosclerosis Risk in Communities Study[J].Atherosclerosis,2008,196(2):926-930.
18 Vogel U,Segel S,Dethlefsen C,et al.Associations between COX-2 polymorphisms,blood cholesterol and risk of acute coronary syndrome[J].Atherosclerosis,2010,209(1):155-162.
19 Lee CR,North KE,Bray MS,et al.Cyclooxygenase polymorphisms and risk of cardiovascular events: the Atherosclerosis Risk in Communities(ARIC) study[J].Clin Pharmacol Ther,2008,83(1):52-60.
