广西境内两种常见神经毒类毒蛇咬伤中毒的临床特点与院前急救策略分析
2014-02-08陈泉芳巫艳彬李其斌苌海华廖园莉白玉龙
王 威,陈泉芳,巫艳彬,李其斌,苌海华,廖园莉,白玉龙,黄 锟

表1 两组患者临床特点比较
注:*为t值;与眼镜王蛇组比较,△P<0.05;MODS=多器官功能障碍综合征
眼镜王蛇与银环蛇同属眼镜蛇科,均为我国十大毒蛇之一,其主要分布在我国长江以南地区,在广西境内较为常见[1-2]。此两种毒蛇的主要毒素为神经类毒素,被其咬伤患者主要临床表现为短时间内呼吸肌麻痹而导致的呼吸骤停,死亡率极高,是急诊科的一种常见危重症[3]。目前,对此神经毒类毒蛇咬伤的系统性报道较少,本研究收集了我科近6年收治的102例此两种毒蛇咬伤患者的临床资料并进行对比分析,总结其临床特点,为完善院前急救措施、降低死亡率以及进一步提高神经毒类毒蛇咬伤中毒的救治水平提供参考。
1 资料与方法
1.1 临床资料 选择2007—2012年在我科急诊抢救与住院的102例眼镜王蛇与银环蛇咬伤中毒患者,其中男81例,女21例,男女比例为3.86∶1;年龄17~65岁,平均(39.8±9.2)岁。所有患者经识别就诊时所携带毒蛇或辨认“中国十大毒蛇图谱”并结合临床表现确诊,均符合7版《内科学》中毒蛇咬伤中毒的诊断标准[4];根据咬伤蛇类将患者分为眼镜王蛇组35例和银环蛇组67例。
1.2 方法 回顾性分析所有患者的临床资料,对比两组患者的院前急救措施、就诊时间、出现呼吸肌麻痹时间、伤情分级、临床表现、呼吸机治疗情况、预后情况及院外与院内死亡率等。所有患者就诊后静脉滴注抗蛇毒血清,进行局部伤口环状封闭、抗感染、对症治疗及支持治疗等。
1.3 伤情分级标准 参照中国中西医结合学会急救医学专业委员会蛇伤急救学组制定的毒蛇咬伤的临床分型及严重程度评分标准(修订稿)[5]分为3种类型:(1)轻型:眼睑下垂、视物模糊、言语不清、肌肉酸痛、兴奋或嗜睡,但意识清醒;(2)重型:张口、吞咽困难,喉间痰鸣,四肢乏力,谵妄,嗜睡;(3)危重型:全身横纹肌进行性松弛性瘫痪,呼吸运动停止,深度昏迷。
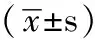
2 结果
2.1 一般情况 两组患者的性别、年龄、院前急救措施及就诊时间比较,差异均无统计学意义(P>0.05,见表1)。
2.2 伤情分级和临床表现 两组患者伤情分级比较,差异有统计学意义(P<0.05),且眼镜王蛇组危重型所占比例高于银环蛇组(χ2=4.843,P=0.028,见表1)。两组患者均出现了全身症状,眼镜王蛇组局部肿痛、多器官功能障碍综合征(MODS)发生率高于银环蛇组,出现呼吸肌麻痹时间短于银环蛇组,差异均有统计学意义(P<0.05,见表1)。
2.3 呼吸机治疗情况及预后情况 两组患者采用呼吸机治疗率比较,差异无统计学意义(P>0.05,见表1),均未出现治疗相关并发症。两组患者预后情况比较,差异有统计学意义(P<0.05),且眼镜王蛇组治愈率低于银环蛇组,死亡率高于银环蛇组(见表1)。
2.4 院外与院内死亡率 眼镜王蛇组8例死亡患者中,4例为院外死亡,4例为院内死亡;银环蛇组3例死亡患者中,1例为院外死亡,2例为院内死亡。眼镜王蛇组院外死亡率高于银环蛇组(χ2=4.869,P=0.027),而两组院内死亡率比较,差异无统计学意义(χ2=2.961,P=0.085)。
3 讨论
神经类毒素广泛分布于眼镜蛇科和海蛇科,眼镜王蛇与银环蛇同属眼镜蛇科,临床上常把它们与海蛇归为神经毒类毒蛇。根据作用机制的不同,神经类毒素可分为突触后神经毒素(α-神经毒素)、突触前神经毒素(β-神经毒素)及其他类型神经毒素。突触后神经毒素的致病机制主要是通过与神经肌肉接头处N型乙酰胆碱受体(n-AchR)结合而抑制化学神经递质乙酰胆碱(Ach)与受体结合,从而阻断神经-肌肉的兴奋性[6]。根据相对分子质量和二硫键数目,突触后神经毒素可分为短链神经毒素和长链神经毒素[7]。突触前神经毒素具有磷脂酶A2活性,可破坏突触前膜,造成乙酰胆碱大量释放并耗竭,从而阻断突触间兴奋的传递。
本研究结果显示,眼镜王蛇组和银环蛇组患者均出现了全身症状并采用呼吸机治疗,呼吸机治疗率均>80%,而眼镜王蛇组危重型患者所占比例,局部肿痛、MODS发生率,死亡率及院外死亡率均高于银环蛇组,出现呼吸肌麻痹时间短于银环蛇组,治愈率低于银环蛇组,表明眼镜王蛇咬伤的危害性较银环蛇大,患者病情更为危重,预后更差,分析其原因与眼镜王蛇体积更大、排毒量更多、毒素更强有关。眼镜王蛇每次咬物排毒量为400~600 mg,最高可达700 mg以上,其排毒量为其他蛇类的5~7倍,被其咬伤中毒患者很容易在短期内出现呼吸衰竭[8]。眼镜王蛇神经毒素约占粗毒的48.3%[9],主要成分为突触后神经毒素,并与其他已知的眼镜蛇科毒蛇如银环蛇、金环蛇等的神经毒素有较高的同源性[10-11]。眼镜王蛇神经毒素具有独特的“三指结构”,即由3个相互临近的环状结构从1个小的、球形的、由4对保守二硫键连接的疏水核心伸出,形似3根伸开的手指结构,该结构包含长链神经毒素、短链神经毒素、弱神经毒素、心脏毒素、毒蕈毒素及含有1个游离巯基的长链神经毒素[12]。长链神经毒素属于突触后神经毒素,可以与位于骨骼肌突触后膜上的肌型乙酰胆碱受体以一种高亲和力的、特异性极强的方式结合,从而成为该类受体激活剂如乙酰胆碱、烟碱等的强竞争性拮抗剂[13]。此特性使得长链神经毒素与短链神经毒素成为眼镜王蛇神经毒素中毒性最强的成分,可导致被其咬伤的人或动物产生迟缓性麻痹和呼吸衰竭,甚至造成迅速死亡[14-15]。弱神经毒素、心脏毒素及毒蕈碱毒素主要导致出血和细胞裂解[16-17],这是部分被眼镜王蛇咬伤患者出现局部肿痛、出血的原因,而银环蛇神经毒素中毒则不具备此类表现。
银环蛇神经毒素的主要成分为蛋白质和多肽,包括α银环蛇毒素(α-BGT)、β-银环蛇毒素(β-BGT)、κ银环蛇毒素(κ-BGT)、γ-银环蛇毒素(γ-BGT)和磷脂酶A等酶类[18]。与眼镜王蛇神经毒素相比,银环蛇毒素还具有突触前神经毒素,即β-BGT,其能减少突触的胆碱能受体数量,抑制运动神经末梢释放和摄取乙酰胆碱,导致突触在较长时间内不可逆地停止释放乙酰胆碱,进而阻断运动神经与肌肉间的信号传递,最终导致骨骼肌麻痹[19]。β-BGT主要作用于外周神经系统,且其作用不可逆,其作用方式主要是导致运动神经突触前膜产生一种三相变化(乙酰胆碱数量迅速减少-乙酰胆碱反馈性释放增加-抑制运动神经末梢释放乙酰胆碱)而阻断突触间神经兴奋传导,最终使骨骼肌出现持续性麻痹[20]。
综上所述,本研究通过对广西境内两种常见神经毒类毒蛇咬伤中毒患者的临床特点进行对比分析,认为相对于银环蛇,被眼镜王蛇咬伤患者病情更为凶险,出现呼吸肌麻痹的时间更短,MODS发生率及院外死亡率更高,应注重完善此类蛇咬伤患者的院前急救策略。在临床实际工作中经常遇见不少被此类毒蛇咬伤患者要求具备丰富毒蛇咬伤救治经验的上级医院出诊或舍近求远自行驾车前往上级医院就诊,而这是错误的致命的行为。被神经毒类毒蛇咬伤患者正确的院前急救策略是在充分、及时排毒的基础上尽早就近就医,接诊医院应保障辅助呼吸工具如呼吸机等设备的正常运行,以随时应对致命性呼吸骤停。而医务工作者不仅应充分认识呼吸机辅助呼吸治疗神经毒类毒蛇咬伤的关键性,更应加强神经毒类毒蛇咬伤院前急救策略的宣教,以减少患者病情恶化,改善患者预后。
1 Sawai Y,Kawamura Y,Toriba M,et al.An epidemiological study on the snake bites in Guangxi Zhuang autonomous region,China in 1990[J].The Snake,1992,24(1):1-15.
2 王乃平,李其斌,李炳一,等.广西1990年蛇伤流行病学研究[J].蛇志,1993,5(1):10-11.
3 包水明,周亚平.我国主要毒蛇及其毒性、排毒量和蛇伤救治[J].江西教育学院学报:自然科学,1997,18(6):51-52.
4 陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:955.
5 中国中西医结合学会急救医学专业委员会蛇伤急救学组.毒蛇咬伤的临床分型及严重程度评分标准(修订稿)[J].中国中西医结合急救杂志,2002,9(1):18.
6 覃公平.中国毒蛇学[M].2版.南宁:广西科学技术出版社,1998:204-212.
7 Chang CC.Looking back on the discovery of alpha-bungarotoxin[J].J Biomed Sci,1999,6(6):368-375.
8 殷方臣,郑颖,邱薇,等.蛇毒神经毒素研究进展[J].动物医学进展,2008,29(8):67-70.
9 蓝海,陈远聪.中国毒蛇及蛇伤救治[M].上海:上海科技出版社,2008.
10 黄立峰 许云禄.福建产眼镜王蛇毒神经毒素的分离及活性测定[J].福建医科大学学报,2004,38(2):125-128.
11 李其斌,渡庆次贺博,金城记代彦,等.PCR法分子克隆及序列分析广西产眼镜王蛇蛇毒α-神经毒素基因[J].中华急诊医学杂志,2004,13(2):77-80.
12 Fruchart-Gaillard C,Mourier G,Marquer C,et al.How three-finger-fold toxins interact with various cholinergic receptors[J].J Mol Neurosci,2006,30(1/2):7-8.
13 Tsetlin V.Snake venom alpha-neurotoxins and other′three- finger′proteins[J].Eur J Biochem,1999,264(2):281-286.
14 Hodgson WC,Wickramaratna JC.In vitro neuromuscular activity of snake venoms[J].Clin Exp Pharmacol Physiol,2002,29(9):807-814.
15 Phui Yee JS,Nanling G,Afifiyan F,et al.Snake postsynaptic neurotoxins:gene structure,phylogeny and applications in research and therapy[J].Biochimie,2004,86(2):137-149.
16 Bilwes A,Rees B,Moras D,et al.X-ray structure at 1.55 A of toxin gamma,a cardiotoxin from Naja nigricollis venom.Crystal packing reveals a model for insertion into membranes[J].J Mol Biol,1994,239(1):122-136.
17 Zhou H,Meng Q,Xie L,et al.A weak neurotoxin exhibits synergic effect with cardiotoxins when co-applied to two non-neural cell lines[J].Biol Pharm Bull,2004,27(8):1241-1244.
18 Aird SD,Womble GC,Yates JR 3rd,et al.Primary structure of gamma-bungarotoxin,a new postsynaptic neurotoxin from venom of Bungarus multicinctus[J].Toxicon,1999,37(4):609-625.
19 陈朝晖,蓝琳友,洪溪屏.银环蛇咬伤急诊救治的临床研究[J].浙江中医药大学学报,2010,34(2):218-219.
20 邓海霞,李其斌.银环蛇咬伤中毒发病机制和治疗的研究进展[J].蛇志,2008,20(1):35-46.
