性激素对雄性非酒精性脂肪性肝炎小鼠的影响研究
2014-02-08辛光大秦少游王江滨
辛光大,秦少游,王江滨
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是世界范围内分布的常见的慢性肝病,可进展为肝硬化和肝细胞癌[1-4]。寻找NASH发生、发展的危险因素,探讨其防治策略是目前国内外肝病学界的研究热点之一。流行病学调查显示,不同性别、不同年龄段人群NASH发生率有明显差异[5],并推测性激素种类及其水平在NASH的性别差异中起重要作用,性别干预可能会对NASH的进展产生影响,但目前的研究结论尚存在争议。本研究通过建立蛋氨酸-胆碱缺乏(methionine-choline-deficient,MCD)饮食诱导C57BL/6雄性NASH小鼠模型[6],观察其血清性激素水平、肝脏病理组织学表现及相关生化指标变化,旨在探讨性激素对NASH小鼠的影响。
1 材料与方法
1.1 实验动物 选用14周龄C57BL/6雄性小鼠50只(购自吉林大学实验动物中心),常规饲养于吉林大学实验动物中心清洁级动物房,12 h光照和黑夜循环,温度(22±2)℃,湿度50%~60%。采用随机数字表法将50只小鼠分为对照组、MCD组、睾丸切除组、睾丸切除+雄激素组、睾丸切除+雌激素组5组,每组10只。
1.2 方法 对照组和MCD组小鼠行假手术,睾丸切除组、睾丸切除+雄激素组、睾丸切除+雌激素组小鼠行睾丸切除术,恢复2 d后,对照组小鼠饲喂MCD对照饮食(Research Diets公司生产,A02082003B),其余4组小鼠饲喂MCD饮食(Research Diets公司生产,A02082002B),建立MCD诱导C57BL/6雄性NASH小鼠模型,自由摄取水及食物。性别干预:睾丸切除+雄激素组小鼠皮下注射丙酸睾酮(5 mg·kg-1·d-1,溶于橄榄油,Sigma公司生产,T1875),睾丸切除+雌激素组小鼠皮下注射苯甲酸雌二醇(0.5 mg·kg-1·d-1,溶于橄榄油,Sigma公司生产,E8515)。造模4周后所有小鼠禁食/水12 h,摘眼球取血,并颈椎脱臼处死。
1.3 观察指标 (1)小鼠肝左叶固定部位取材,行HE染色及Masson染色观察肝脏组织炎症活动度和纤维化程度;行锇酸染色观察肝细胞脂肪变性情况,采用Olympus摄像系统进行观察和摄片。(2)由两人双盲行病理组织学检查,根据美国国立卫生研究院NASH临床研究网络病理工作组指南行非酒精性脂肪性肝病活动度评分(NAFLD activity score,NAS)[7]:①肝细胞脂肪变评分:肝实质内脂肪变肝细胞占总细胞的比例<5%计0分;5%~33%计1分;34%~66%计2分;>66%计3分。②小叶内炎症评分:200倍光镜下计数坏死灶,无计0分,<2个计1 分,2~4个计2分,>4个计3分。③肝细胞气球样变:无计0分,少见计1分,多见计2分。以上3项计分之和即为NAS总分。(3)血清睾酮、雌二醇、ALT、AST水平:所有小鼠摘眼球取血,置于离心管中,静置待血液凝固后,3 000 r/min离心10 min,离心半径为13.5 cm,取上清液,采用ELISA法测定血清睾酮、雌二醇水平(CSB-E05109m和CSB-E05098m试剂盒购自美国Cusabio公司),采用全自动生化分析仪测定血清ALT、AST水平。

2 结果
2.1 染色结果及NAS总分 对照组小鼠肝组织形态、结构均正常;MCD组、睾丸切除组、睾丸切除+雄激素组、睾丸切除+雌激素组小鼠肝小叶各区肝细胞内均有大量脂肪空泡,汇管区及小叶内可见灶状炎性细胞浸润,以淋巴细胞浸润为主,偶可见肝细胞气球样变,MCD组小鼠肝细胞脂肪变性及小叶内炎性细胞浸润最明显(见图1)。5组小鼠NAS总分比较,差异有统计学意义(χ2=36.724,P=0.000),其中MCD组、睾丸切除组、睾丸切除+雄激素组、睾丸切除+雌激素组NAS总分秩均值大于对照组,睾丸切除组、睾丸切除+雌激素组NAS总分秩均值小于MCD组,睾丸切除+雌激素组NAS总分秩均值小于睾丸切除组、睾丸切除+雄激素组,差异均有统计学意义(P<0.05,见表1)。
2.2 血清睾酮、雌二醇、ALT、AST水平 5组小鼠血清睾酮、雌二醇、ALT、AST水平比较,差异均有统计学意义(P<0.05)。睾丸切除组和睾丸切除+雌激素组小鼠血清睾酮水平低于对照组、MCD组、睾丸切除+雄激素组,睾丸切除+雌激素组小鼠血清雌二醇水平高于对照组、MCD组、睾丸切除组、睾丸切除+雄激素组,差异均有统计学意义(P<0.05);MCD组、睾丸切除组、睾丸切除+雄激素组、睾丸切除+雌激素组小鼠血清ALT、AST水平高于对照组,睾丸切除组小鼠血清ALT、AST水平低于MCD组,睾丸切除+雌激素组小鼠血清ALT、AST水平低于MCD组、睾丸切除组、睾丸切除+雄激素组,差异均有统计学意义(P<0.05,见表2)。

表1 5组小鼠NAS总分比较
注:与对照组比较,*P<0.05;与MCD组比较,△P<0.05;与睾丸切除组比较,▲P<0.05;与睾丸切除+雄激素组比较,☆P<0.05
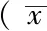
Table2 Comparison of serum testosterone,estradiolin,ALT and AST in the five groups

组别例数睾酮(ng/ml)雌二醇(pmol/L)ALT(U/L)AST(U/L)对照组10631±081 350±044 335±50 411±52 MCD组10635±060 350±037 1094±104∗ 1142±68∗ 睾丸切除组10018±004∗△☆ 339±035 953±63∗△ 1042±84∗△ 睾丸切除+雄激素组10621±063 339±030 1022±104∗ 1103±77∗ 睾丸切除+雌激素组10018±005∗△☆2185±217∗△▲☆ 753±63∗△▲☆ 821±58∗△▲☆ F值3862910658214441930P值0000000000000000
注:与对照组比较,*P<0.05;与MCD组比较,△P<0.05;与睾丸切除组比较,▲P<0.05;与睾丸切除+雄激素组比较,☆P<0.05

图1 5组小鼠肝脏组织染色结果(×200)
3 讨论
随着肥胖症及代谢综合征在全球范围内的流行,非酒精性脂肪性肝病(NAFLD)迅速增长并呈低龄化发病趋势。NAFLD包括非酒精性单纯性脂肪肝(NAFL)、NASH及其相关肝硬化和肝细胞癌,NASH是NAFL向肝硬化转化的必经阶段,是隐源性肝硬化的重要原因之一。NASH预后不佳,部分患者可进一步进展为肝硬化、肝细胞癌。寻找NASH发生、发展的危险因素及阻断其进一步进展的保护性因素,探讨其防治策略是目前国内外肝病学界的研究热点之一。
流行病学调查结果显示,NASH在不同的年龄段人群具有不同的性别易感性,性激素种类及其水平在NASH的性别差异中起重要作用,性别干预可能会对NASH的进展产生影响,但目前的研究结论尚存在争议。Tian等[8]对男性人群进行的研究表明雄激素与NASH无关,而Mu等[9]和Zhang等[10]在大鼠动物模型中发现雄激素对NASH有保护作用。目前关于雌激素对NASH的作用还存在较多的争议,Kamada等[11]认为雌激素对NASH具有保护作用,而Kashireddy等[12]则认为雌激素对NASH无明显影响,还可能是促进NASH进展的因素[13]。由于上述实验研究是在不同的人群和/或动物模型中进行的,其发病机制不尽相同,因此所得结论也存在一定的局限性。
本研究观察了性别干预对MCD饮食诱导C57BL/6雄性NASH小鼠的影响,研究结果显示,睾丸切除组小鼠NAS总分秩均值小于MCD组,血清睾酮、ALT、AST水平均较MCD组降低,但睾丸切除+雄激素组小鼠与MCD组和睾丸切除组小鼠NAS总分秩均值,血清睾酮、ALT、AST水平间无差异,这与黄承飞等[14]研究结论不一致,其认为雄激素对NASH具有保护作用,分析原因可能与研究所采用的动物模型不同有关,提示雄激素在不同的NASH动物模型中的作用途径是不同的。值得注意的是,雄性小鼠去势后NASH病情程度有所减轻,但补充雄激素后NASH病情程度却无明显加重,目前其确切作用机制尚不清楚,考虑是在MCD饮食诱导NASH小鼠模型中,雄激素可能通过肝细胞脂变、炎症等多条途径发挥作用,是多因素参与的。本研究结果还显示,睾丸切除+雌激素组小鼠NAS总分秩均值小于MCD组、睾丸切除组、睾丸切除+雄激素组,血清ALT、AST水平均低于MCD组、睾丸切除组、睾丸切除+雄激素组,提示雌激素可改善MCD饮食诱导C57BL/6雄性NASH小鼠病情严重程度,但其具体作用机制较为复杂,同样也是多因素参与的,需在今后的研究中进一步深入分析NASH的性别差异及其机制,寻找NASH的保护性因素,不断探讨新的防治策略。
1 Adams LA,Sanderson S,Lindor KD,et al.The histological course of nonalcoholic fatty liver disease:a longitudinal study of 103 patients with sequential liver biopsies[J].J Hepatol,2005,42(1):132-138.
2 Kashi MR,Torres DM,Harrison SA.Current and emerging therapies in nonalcoholic fatty liver disease[J].Semin Liver Dis,2008,28(4):396-406.
3 Hashimoto E,Yatsuji S,Kaneda H,et al.The characteristics and natural history of Japanese patients with nonalcoholic fatty liver disease[J].Hepatol Res,2005,33(2):72-76.
4 Sanyal AJ,Banas C,Sargeant C,et al.Similarities and differences in outcomes of cirrhosis due to nonalcoholic steatohepatitis and hepatitis C[J].Hepatology,2006,43(4):682-689.
5 Hashimoto E,Tokushige K.Prevalence,gender,ethnic variations,and prognosis of NASH[J].J Gastroenterol,2011,46(Suppl 1):63-69.
6 Kirsch R,Clarkson V,Shephard EG,et al.Rodent nutritional model of non-alcoholic steatohepatitis:species,strain and sex difference studies[J].J Gastroenterol Hepatol,2003,18(11):1272-1282.
7 Kleiner DE,Brunt EM,Van Natta M,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J].Hepatology,2005,41(6):1313-1321.
8 Tian GX,Sun Y,Pang CJ,et al.Oestradiol is a protective factor for non-alcoholic fatty liver disease in healthy men[J].Obes Rev,2012,13(4):381-387.
9 Mu Y,She R,Zhang H,et al.Effects of estrogen and androgen deprivation on the progression of non-alcoholic steatohepatitis(NASH)in male Sprague-Dawley rats[J].Hepatol Res,2009,39(9):910-920.
10 Zhang H,Liu Y,Wang L,et al.Differential effects of estrogen/androgen on the prevention of nonalcoholic fatty liver disease in the male rat[J].J Lipid Res,2013,54(2):345-357.
11 Kamada Y,Kiso S,Yoshida Y,et al.Estrogen deficiency worsens steatohepatitis in mice fed high-fat and high-cholesterol diet[J].Am J Physiol Gastrointest Liver Physiol,2011,301(6):G1031-1043.
12 Kashireddy PR,Rao MS.Sex differences in choline-Deficient diet-induced steatohepatitis in mice[J].Exp Biol Med(Maywood),2004,229(2):158-162.
13 Miyashita T,Toyoda Y,Tsuneyama K,et al.Hepatoprotective effect of tamoxifen on steatosis and non-alcoholic steatohepatitis in mouse models[J].J Toxicol Sci,2012,37(5):931-942.
14 黄承飞,董冰.性激素对非酒精性脂肪变性肝炎(NASH)的保护作用研究[J].中国畜牧杂志,2008,44(23):20-23.
