多肽pd20与肿瘤坏死因子α融合蛋白的纯化及生物学活性鉴定
2014-02-08呼圣娟姜荣兴师红利谢华红
呼圣娟,姜荣兴,师红利,沈 皓,谢华红
多肽pd20是本课题组在前期工作中筛选出的可特异性结合于胃癌肝高转移潜能细胞的新多肽分子,实验证实多肽pd20具有胃癌肝转移的导向性[1-2]。为了探讨此多肽是否具有携带抗癌药物或抑癌基因靶向性治疗胃癌肝转移的作用,本研究前期工作已将多肽pd20与肿瘤坏死因子α(TNF-α)进行了基因融合,并构建了原核表达载体,对重组融合蛋白进行了诱导表达,此次实验目的是将pd20-TNF-α融合蛋白进行纯化,并对纯化后的蛋白进行鉴定和生物学活性检测。
1 材料与方法
1.1 材料
1.1.1 细胞系 小鼠成纤维细胞L929购自上海中科院细胞库。胃癌肝高转移潜能细胞XGC9811-L由本实验组制备,保存于第四军医大学消化病研究所。
1.1.2 试剂和抗体类 Ni-NTA柱购自QIAGEN公司;蛋白Marker购自上海丽珠东风生物技术有限公司;鼠抗人TNF-α单克隆抗体购自Santa Cruz公司。RPMI 1640培养基、四甲基偶氮唑盐(MTT)、PE Annexin V细胞凋亡检测试剂盒、Matrigel胶均购自BD公司。TNF-α标准品由中国药品生物制品鉴定所提供。显色试剂ABTS为Sigma 公司产品。
1.2 方法
1.2.1 融合蛋白的纯化和鉴定 将含融合基因pd20-TNF-α的大肠埃希菌BL21用异丙基硫代半乳糖苷(IPTG)诱导培养4 h,13 000 r/min,离心半径为6 cm,离心1 min,收集诱导表达后的菌体,按1 g菌体加7 ml裂菌缓冲液的比例将菌体重悬,进行超声波裂菌。收集上清液用镍柱进行纯化,具体步骤如下:(1)Equilibrium buffer平衡镍柱;(2)将稀释过滤后的溶菌上清液上样;(3)Equilibrium buffer再洗5个床体积,使目标蛋白充分挂柱;(4)Elution buffer 1洗去杂蛋白,收集洗杂峰;(5)Elution buffer 2进行洗脱,并收集洗脱峰和洗脱液;(6)将收集的洗脱液用15 ml超滤离心管超滤浓缩,收集各次浓缩液合并后再次超滤浓缩,分装备用;(7)各取1 ml过柱前、挂柱穿透、洗杂液、洗脱液进行活性测定和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 。
1.2.2 SDS-PAGE及Western blotting检测 将样品进行SDS-PAGE,考马斯亮蓝R250染色。将样品蛋白用电转移法转到硝酸纤维膜上,用鼠抗人TNF-α单克隆抗体为一抗,酶标兔抗鼠IgG为二抗,进行Western blotting分析。
1.2.3 生物学活性测定 采用L929 细胞毒法检测pd20-TNF-α融合蛋白的生物学活性,步骤如下:调整小鼠成纤维细胞L929的细胞密度为1.0×105细胞/ml,接种于96孔培养板中,每孔100 μl,培养至细胞贴壁80%以上。TNF-α标准品起始浓度为100 U/ml,依次做4倍比梯度稀释至终浓度6.25×10-3U/ml。样品预稀释起始浓度为100 U/ml,再做4倍比梯度稀释,终体积均为100 μl。标准品和样品每个剂量各测3个复孔,置于37 ℃、5%二氧化碳(CO2)孵箱中培养16 h。用结晶紫染色,测OD570 nm值,以稀释倍数的对数值为横坐标,OD570 nm为纵坐标做图,以标准品的最低OD570 nm和最高OD570 nm之平均值做一平行于X轴的直线交于曲线,以样品对应曲线与该直线交点在X轴上读出半效量的稀释度,按以下公式计算样品活性:样品活性(U/ml)=标准品效价×(样品预稀释倍数/标准品预稀释倍数)×(标准品半效量稀释度/样品相当于标准品半效量的稀释度)。
1.2.4 细胞凋亡实验 将胃癌细胞XGC9811-L调整细胞密度为1.0×106个/ml,培养至贴壁80%以上。融合蛋白起始浓度为100.00 U/ml(A组),做4倍比梯度稀释,浓度依次为25.00 U/ml(B组)、6.25 U/ml(C组)。对照组为不加融合蛋白的阴性对照组(D组)和流式细胞凋亡的KB组(E组)。分别将不同浓度的融合蛋白加入胃癌肝高转移潜能细胞XGC9811-L培养24 h。然后吸出至离心管内,磷酸盐缓冲液(PBS)洗涤一次,加入胰酶进行消化。吸除胰酶,用离心法收集各组细胞,取(5~10)×104个/ml用PBS重悬的细胞,离心后弃上清液,加入195 μl磷脂结合蛋白V-异硫氰酸荧光素(Annexin V-FITC)结合液轻轻重悬细胞。加入5 μl Annexin V-FITC轻轻混匀。室温避光孵育10 min。加入10 μl碘化丙啶(PI)染色液,轻轻混匀,冰浴避光放置。随即用流式细胞仪检测细胞凋亡情况,计算细胞早期凋亡率,即Annexin V-FITC阳性细胞在总细胞数中的比例。每组设3个副孔,实验重复3次,取均值进行分析。
1.2.5 细胞侵袭实验 将Millicell小室放入灭菌的24孔板中;在小室内膜上加入Matrigel胶(100 μl/膜),37 ℃ 4~5 h。用1%不完全培养液悬浮胃癌肝高转移潜能细胞XGC9811-L,调整细胞密度为2.5×105细胞/ml,分别取200 μl与TNF-α(TNF-α组)、pd20-TNF-α(pd20-TNF-α组)各100 U在室温下孵育1 h后加入小室内,将只加入等量XGC9811-L细胞(XGC9811-L组)或对照肽(对照肽组)作为对照。在下室中加入10%的完全培养液600 μl作为趋化剂用,37 ℃、5%CO2培养20 h;取出小室,弃去培养液,用棉签擦去上室中的细胞,95%甲醇固定15 min 后,取下滤膜;固定后的滤膜进行Giemsa染色,中性树胶封片,在40倍光镜下计数膜背面侵袭的细胞数,随机计数中间和四周共5个视野,每细胞计数3份,求出其平均值。相对侵袭指数=V2/V1×1,其中V2代表融合蛋白影响胃癌细胞的穿膜数,V1代表XGC9811-L组细胞的穿膜数。

2 结果
2.1 融合蛋白的纯化和鉴定 通过Ni-NTA柱纯化,其中目的蛋白在咪唑浓度为200 mmol/L时得到浓集。电泳普带扫描分析表明蛋白纯度可达92%。经Western blotting分析,纯化的融合蛋白可以与抗TNF-α单抗相结合(见图1)。
2.2 蛋白活性检测 体外活性实验显示:pd20-TNF-α融合蛋白对小鼠成纤维腺细胞L929的杀伤活性为7.6×106U/ml,标准品的杀伤活性为1×107(见图2)。
2.3 细胞凋亡实验结果 将不同浓度的pd20-TNF-α融合蛋白作用于胃癌肝高转移潜能细胞XGC9811-L,A组细胞早期凋亡率为(9.04±0.08)%,B组为(6.96±1.21)%,C组为(5.99±0.02)%,D组为(0.73±0.02)%,E组为(0.01±0.00)%,各组细胞早期凋亡率比较,差异有统计学意义(F=2.57,P<0.05);其中A组细胞早期凋亡率高于B组,B组亦高于C组,差异均有统计学意义(q值分别为2.08和3.06;均P<0.01,见图3)。
2.4 细胞侵袭实验结果 用Matrigel包被的Transwell小室观察纯化后的pd20-TNF-α融合蛋白对胃癌肝高转移潜能细胞XGC9811-L的体外侵袭能力的影响:pd20-TNF-α组、TNF-α组、XGC9811-L组、对照肽组单位时间内的穿膜细胞数分别为(26.5±5.9)、(36.0±3.2)、(63.5±5.0)、(64.0±6.8)个,4组间差异有统计学意义(F=49.87,P<0.01);其中pd20-TNF-α组、TNF-α组单位时间内的穿膜细胞数少于XGC9811-L组(q值分别为19.5和14.6;均P<0.01)和对照组(q值分别为19.7和14.9;均P<0.01);而pd20-TNF-α组与TNF-α组比较,XGC9811-L组与对照肽组比较,差异均无统计学意义(q值分别为4.25和0.75,均P>0.05,见图4)。
注:MK为标准蛋白marker;1为过柱前;2为挂柱穿透;3为洗杂液;4~8为洗脱液(咪唑浓度分别为50、100、200、500 mmol/L);9为Western blotting 检测
图1 Ni-NTA柱纯化结果
Figure1 The purification result of Ni-NTA
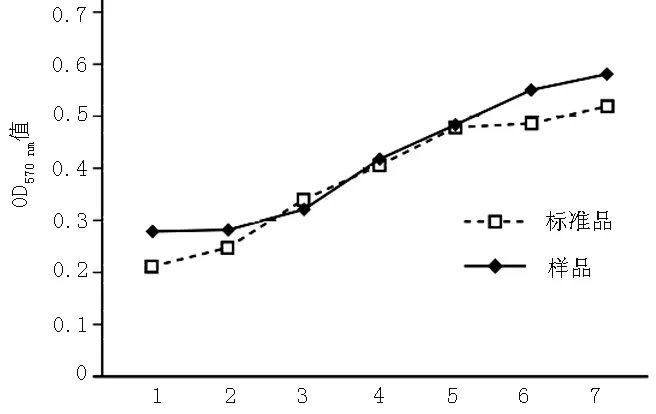
注:横坐标表示蛋白的稀释度
图2 pd20-TNF-α融合蛋白生物学活性检测结果
Figure2 The biological activity of fusion protein pd20-TNF-α
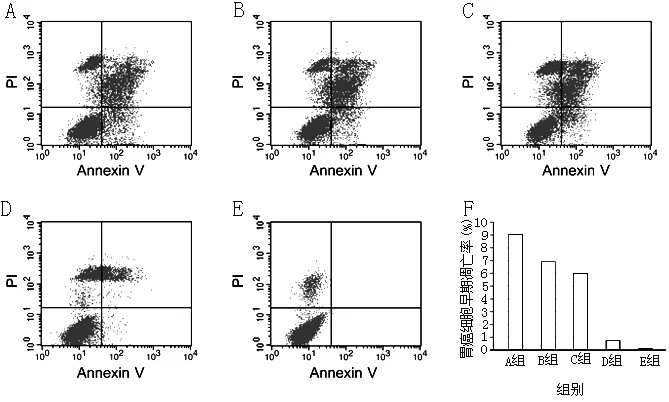
注:PI=碘化丙啶,Annexin V=磷脂结合蛋白V;A、B、C pd20-TNF-α融合蛋白的浓度分别为100.00、25.00、6.25 U/ml;D为阴性对照组,未添加药物;E为流式细胞凋亡所使用的KB组;F为不同组的胃癌细胞早期凋亡率
图3 胃癌肝高转移潜能细胞XGC9811-L凋亡实验
Figure3 Apoptosis test of high level hepatic metastasis from gastric cancer-related potential cell XGC9811-L
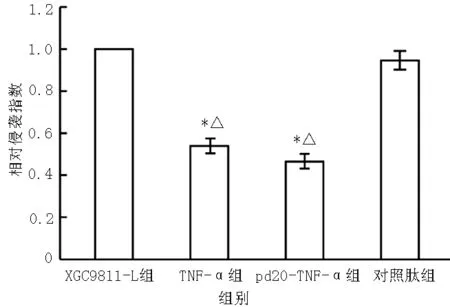
注:与XGC9811-L组比较,*P<0.01;与对照肽组比较,△P<0.01
图4 各组胃癌肝高转移潜能细胞XGC9811-L相对侵袭指数比较
Figure4 Comparison of relative invasive indexes of high level hepatic metastasis from gastric cancer-related potential cell XGC9811-L among various groups
3 讨论
TNF是一种由活化的单核细胞/巨噬细胞产生的具有多功能的炎性递质,是迄今为止人们发现的抗肿瘤活性最强的细胞因子[3]。随着20世纪80年代中期重组TNF-α的获得,人们开始探索TNF-α在肿瘤治疗中的作用。近年发现,TNF-α对体外多种肿瘤细胞株包括胃癌细胞在内有明显的细胞毒性,但由于所用的治疗剂量大,导致毒副作用严重[4-5]。因此,如何提高TNF-α的治疗作用,降低其毒副作用成为TNF-α能否作为抗肿瘤药物的关键性问题。
分子靶向治疗是近年来在治疗血液病和实体肿瘤中涌现出的新的治疗手段[6-7],其关键是要找到具有肿瘤导向性的靶向载体,以携带抗癌药物或抑癌基因起到全身用药、局部发挥的作用,减少毒副作用的发生[8]。多肽pd20是本课题组在前期工作中筛选出的可与胃癌肝高转移潜能细胞及胃癌肝转移组织相结合,并在裸鼠体内可归巢于胃癌肝转移组织,具有胃癌肝转移导向性的新多肽分子[1-2]。为了提高TNF-α在癌组织中的有效治疗浓度并避免进入循环系统引起严重毒副作用,本研究前期工作中已将胃癌肝高转移潜能细胞导向肽pd20与TNF-α进行了基因融合,构建了原核表达载体,此次实验的目的是对融合蛋白进行纯化并对纯化后的蛋白进行生物学活性检测。
镍柱组氨酸标签亲和层析纯化试剂盒是被公认的高效的蛋白纯化系统[9],其纯化标签为6个组氨酸,每个组氨酸含有一个咪唑基团,这个化学结构带有很多额外电子,可亲和镍、锌、钴等金属离子,在中性和弱碱性条件下带组氨酸标签的目的蛋白与镍柱结合,在低pH下用咪唑竞争洗脱。本研究中表达载体pet28a(+)带有his标签,这个标签在pH 8.0时不带电,且无免疫原性,对蛋白质的分泌、折叠基本上无影响,可高度亲和镍离子,使融合蛋白进行镍柱纯化成为可能。TNF-α有157 个氨基酸残基,约17 kD,没有糖基化,分子内有一个二硫键,对维持其空间结构有意义。故本研究中用不同浓度的咪唑洗脱pd20-TNF-α融合蛋白时,在其中加入少量的蛋白酶抑制剂,这既有利于洗脱,也会避免标签被折叠进二级结构里[10]。结果显示,在咪唑浓度200 mmol/L时得到条带单一的浓集蛋白,经检测其纯度可达92%,并具有与抗TNF-α单抗结合的能力。
为了进一步验证纯化后的融合蛋白是否具有TNF-α的杀伤活力,本研究先对融合蛋白进行了体外活性检测,纯化得到的目的蛋白pd20-TNF-α杀伤活性为7.6×106U/ml,证实了融合蛋白兼有TNF-α的杀伤活性。多肽pd20是具有胃癌肝脏导向性的多肽分子,在凋亡实验和侵袭实验中选择了胃癌肝高转移潜能细胞XGC9811-L,观察融合蛋白pd20-TNF-α是否会对此细胞的转移能力产生影响。结果显示:融合蛋白pd20-TNF-α具有促进胃癌肝高转移潜能细胞凋亡和抑制胃癌肝高转移潜能细胞侵袭的能力,间接证实了融合蛋白pd20-TNF-α可能兼有胃癌肝转移的导向性,为下一步裸鼠体内鉴定实验和开发抗胃癌肝转移新的靶向药物奠定了实验基础。
1 Hu S,Guo X,Hie H,et al.Phage display selection of peptides that inhibit metastatic ability of gastric cancer cells with high liver-metastatic potential[J].Biochem Biophys Res Commun,2006,341(4):964-972.
2 呼圣娟,郭新宁,赵进,等.胃癌肝高转移潜能细胞噬菌体结合肽的特异性鉴定[J].现代肿瘤医学,2005,13(2):158-160.
3 Van Ostade X,Vandenabeele P,Everaerdt B,et al.Human TNF mutants with selective activity on the p55 receptor [J].Nature,1993,361(6409):266-269.
4 Mao W,Zhu X,Tang D,et al.TNF-α expression in the UCB-MSCs as stable source inhibits gastric cancers growth in nude mice[J].Cancer Invest,2012,30(6):463-472.
5 Shaw J,Chen B,Huang WH,et al.The small-molecule TNF-alpha modulator,UTL-5g,reduces side effects induced by cisplatin and enhances the therapeutic effect of cisplatin in vivo[J].J Exp Ther Oncol,2011,9(2):129-137.
6 Fulda S.Molecular targeted therapies for rhabdomyosarcoma:focus on hedgehog and apoptosis signaling[J].Klin Padiatr,2013,3(2):76-79.
7 Lin ZK,Zhang R,Ge Z,et al.Characteristics of 4 specific target antigens in adult acute lymphoblastic leukemia[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2013,21(2):289-295.
8 Almhanna K.Targeted therapy for gastric adenocarcinma[J].Adv Pharmacol,2012,65:437-470.
9 Schafer F,Römer U,Emmerlich M,et al.Automated high-throughput purification of 6xHis-tagged proteins[J].J Biomol Tech,2002,13(3):131-142.
10 Tropea JE,Cherry S,Nallamsetty S,et al.A generic method for the production of recombinant proteins in Escherichia coli using a dual hexahistidine-maltose-binding protein affinity tag[J].Methods Mol Biol,2007,363:1-19.
