难治性癫痫细胞模型中N-乙酰氨基葡萄糖转移酶Vb和肌营养不良蛋白聚糖基因的表达变化及意义
2014-02-08叶洁梅黄金山李偲俊
叶洁梅,吴 原,黄金山,李偲俊,韦 兴,刘 云
癫痫是神经系统的常见病、多发病。目前难治性癫痫的发病机制尚未十分清楚,突触重建是其重要的病理基础之一[1]。研究表明,N-乙酰氨基葡萄糖转移酶Vb(N-acetylglucosaminyltransferase Vb,GnT-Vb)和肌营养不良蛋白聚糖(dystroglycan)是重要的神经元表面受体,可与细胞外基质成分如层黏连蛋白、纤维连接蛋白等结合,介导细胞之间的黏附,参与细胞外环境信息交换,维持细胞骨架,影响神经元极性,参与神经突触的形成及突触后介质的成熟等[2]。本研究拟观察难治性癫痫细胞模型(Sombati癫痫细胞模型)中GnT-Vb和dystroglycan基因的表达变化,探讨二者在癫痫形成过程中的可能作用。
1 材料与方法
1.1 材料 (1)实验动物:新生24 h内的SD乳鼠,SPF级,雌雄不限。(2)主要试剂:DMEM/F12培养基、胎牛血清、NEUROBASAL Medium培养液、B27 Supplement(GIBICO);Trizol、SuperScript VILO cDNA Synthesis Kit(Invitrogen公司);SYBR Green PCR Master Mix(ABI公司)。(3)主要仪器设备:荧光定量PCR仪(ABI7500 Fast);荧光显微镜(Olympus公司); 二氧化碳(CO2)培养箱(Thermo公司)等。
1.2 方法
1.2.1 原代海马神经元分离培养与鉴定 取新生24 h内SD乳鼠,于75%乙醇中浸泡消毒。断头取脑,置于预冷的D-Hank′s液中。分离双侧海马,剔除脑膜后剪碎组织,用0.125%胰蛋白酶于37 ℃的恒温水浴箱消化15 min。小心吸出胰酶后,加入5 ml种植培养液终止消化。漂洗2次,巴氏滴管轻柔吹打20次,1 000 r/min离心5 min弃上清液,重悬于种植培养液中。以200目筛网过滤,调整细胞密度为1×109/L。1.5 ml/孔移入经0.1%多聚赖氨酸包被过的6孔细胞培养板,置37 ℃ 5%CO2细胞培养箱内培养12 h后,全量更换为无血清维持培养液2 ml继续培养。每天观察细胞生长情况,每3 d半量换液1次。
种植培养液配制:90%DMEM/F12培养基,10%胎牛血清,2 mmol/L L-谷氨酰胺,100 U/ml青霉素,100 U/ml链霉素。无血清维持培养液的组成:98%NEUROBASAL Medium培养液,2%B27 Supplement,2 mmol/L L-谷氨酰胺,100 U/ml青霉素,100 U/ml链霉素。于第7天采用神经微丝免疫组化染色鉴定神经元(按说明书操作),取纯度≥95%的细胞用于后继实验研究。
1.2.2 Sombati癫痫细胞模型的构建 将培养至第14天的海马神经元随机分为对照组和模型组,每组设6孔,重复实验3次。对照组更换为正常细胞外液培养3 h后恢复无血清维持培养液培养,模型组则更换为低镁细胞外液培养3 h后恢复无血清维持培养液培养。正常细胞外液(mmol/L)的配制:NaCl 145 mmol/L,KCl 2.5 mmol/L,HEPES缓冲液 10 mmol/L,CaCl22 mmol/L,葡萄糖 10 mmol/L,甘氨酸 0.002 mmol/L,MgCl21 mmol/L,溶解于1 000 ml三蒸水,调pH值至7.0~7.2,过滤除菌。低镁细胞外液(mmol/L)的配制:NaCl 145 mmol/L,KCl 2.5 mmol/L,HEPES缓冲液10 mmol/L,CaCl22 mmol/L,葡萄糖10 mmol/L,甘氨酸0.002 mmol/L,溶解于1 000 ml三蒸水,调pH值至7.0~7.2,过滤除菌。
1.2.3 通过实时定量聚合酶链式反应(real-time qPCR)方法检测Sombati癫痫细胞模型中GnT-Vb和dystroglycan基因表达。
1.2.3.1 细胞样品总RNA的提取 每10 cm2细胞加入1 ml Trizol液,用枪头吹吸混匀,尽量让细胞全部裂解,室温放置5 min,每管中各加入0.2 ml氯仿,盖紧离心管,反复颠倒混匀15 s,12 000×g,4℃离心10 min,取上层水相于离心管中。每管中各加0.5 ml异丙醇,轻轻混匀,室温放置10 min,12 000×g,4 ℃离心10 min,弃去上清液。每管中加入1 ml的75%乙醇轻轻洗涤沉淀,12 000×g,4 ℃离心10 min,小心弃去上清液。室温干燥5~10 min,RNA溶于50~100 μl水中。
1.2.3.2 反转录cDNA 按照SuperScript VILO cDNA Synthesis Kit试剂盒说明书操作,取无RNA酶的eppendorf管,每个样本加入如下组分(Mix ×1):RNA 2 μl,5×VILO Reaction Mix 4 μl,10×SuperScript Enzyme Mix 2 μl,DEPC-treated water 12 μl,总体系20 μl。轻轻混匀后,25 ℃孵育10 min,42 ℃孵育60 min,85 ℃孵育5 min终止反应。所得到的cDNA保存在-20 ℃备用。
1.2.3.3 Real-time qPCR检测目的基因的表达 检测细胞样品中目的基因和内参基因(GAPDH基因)的表达量。体系中各组分的体积如下:超纯水5.7 μl,2×SYBR Green PCR Master Mix 7.5 μl,上游引物(10 μmol/L)0.15 μl,下游引物(10 μmol/L)0.15 μl,模板1.5 μl,总体系15 μl(见表1)。反应条件:95 ℃预变性10 min,40个循环;95 ℃变性15 s;60 ℃退火延伸60 s。根据qPCR反应曲线得到各样品目的基因和内参基因的循环阈值(Ct值),数据分析使用QIAGEN公司RT2 Profiler PCR Array Data Analysis系统。
表1 GnT-Vb和dystroglycan基因检测用引物序列(5′-3′)
Table1 Primer sequences for the gene expression detection of GnT-Vb and dystroglycan
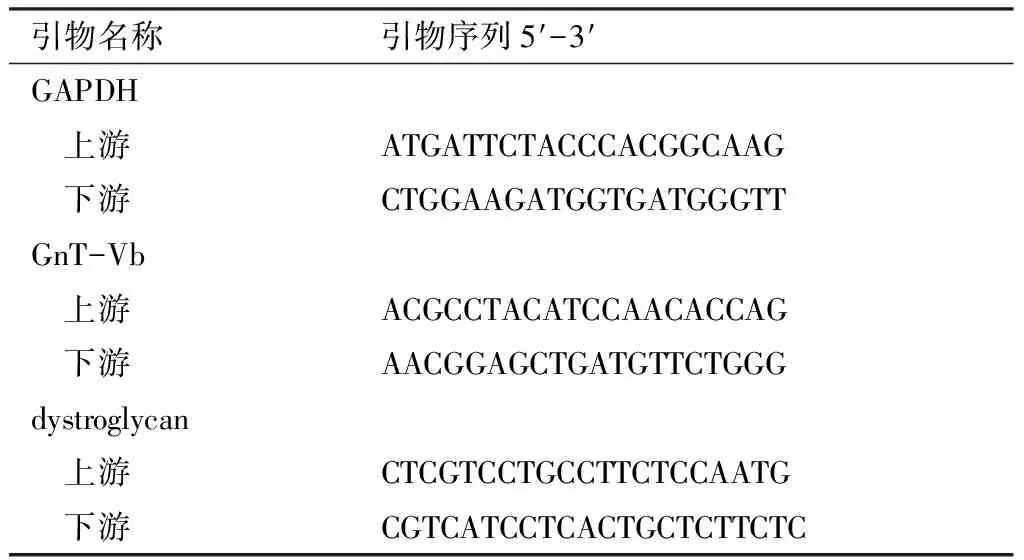
引物名称引物序列5′-3′GAPDH 上游ATGATTCTACCCACGGCAAG 下游CTGGAAGATGGTGATGGGTTGnT-Vb 上游ACGCCTACATCCAACACCAG 下游AACGGAGCTGATGTTCTGGGdystroglycan 上游CTCGTCCTGCCTTCTCCAATG 下游CGTCATCCTCACTGCTCTTCTC
注:GAPDH =内参,GnT-Vb=N-乙酰氨基葡萄糖转移酶Vb,dystroglycan=肌营养不良蛋白聚糖

2 结果
2.1 Sombati癫痫细胞造模后第1天GnT-Vb和dystroglycan基因表达变化 Sombati癫痫细胞造模后第1天,模型组GnT-Vb基因表达水平低于对照组,差异有统计学意义(P<0.05);而两组dystroglycan基因表达水平比较,差异无统计学意义(P>0.05,见表2)。
2.2 Sombati癫痫细胞造模后第4天GnT-Vb和dystroglycan基因表达变化 Sombati癫痫细胞造模后第4天,模型组GnT-Vb、dystroglycan基因表达水平均高于对照组,差异有统计学意义(P<0.05,见表3)。
3 讨论
GnT-Vb和dystroglycan是重要的跨膜糖蛋白,两者均广泛表达于神经系统,是连接细胞外基质和细胞骨架蛋白的重要分子结构,影响神经元的分化、迁移,在神经生长发育过程中起重要作用。GnT-Vb和dystroglycan不仅参与神经系统的发育和可塑性,而且与成熟神经元的病理状态密切相关。
癫痫的反复放电造成神经突起-生长锥异常生长最终形成异常的神经网络,是癫痫难治性形成的基础。研究发现,Sombati癫痫细胞模型中层黏连蛋白、整合素呈高表达,经低镁细胞液处理72 h后Sombati癫痫细胞出现明显的形态学改变,表现为部分神经元胞体相融合,神经突起迁徙靠近,神经元之间出现网格变化,异常神经网络形成[3-4]。生长锥表面的整合素胞外段在层黏连蛋白等因子的作用下使生长锥黏附于细胞外基质上,引起微丝和微管运动,启动胞内各级信号转导系统,直接调节细胞骨架,最终引起神经突起的生长、延伸和神经纤维的发芽,提示层黏连蛋白-整合素跨膜系统是难治性癫痫形成异常网络的关键。Dystroglycan作为层黏连蛋白的重要受体之一,可参与神经元的轴突靶向和髓鞘形成过程。Berti等[5]研究发现,当dystroglycan和整合素两者同时缺失时,层黏连蛋白介导的丝裂原活化蛋白激酶p38磷酸化受抑制,提示dystroglycan和整合素两者可能共同参与层黏连蛋白介导的丝裂原活化蛋白激酶p38磷酸化过程,影响神经元的轴突靶向和髓鞘形成。Lee等[6]报道,神经元表面的GnT-Vb可以通过影响整合素与细胞外基质的相互作用,进而影响酪氨酸的磷酸化,参与激活胞内多条信号转导途径,促进神经细胞突起生长和突触形成。本实验结果显示,Sombati癫痫细胞造模后第4天,与正常海马神经元比较,其GnT-Vb、dystroglycan基因表达水平均增高,提示GnT-Vb和dystroglycan可能同时参与了难治性癫痫的形成过程。
Sombati癫痫细胞模型是一种研究癫痫发病机制的理想模型,在低镁细胞外液的作用下可形成持续的反复自发性癫痫样放电。马美刚等[7]研究发现,经低镁细胞外液处理3 h后的Sombati癫痫细胞在3、6、24 h乳酸脱氢酶(LDH)活性均较对照组明显升高,并随着时间的延长,LDH的释放量呈逐渐上升趋势,提示Sombati癫痫细胞存在早期损伤作用。赵文元等[8]研究同样发现Sombati癫痫细胞在产生癫痫样放电早期可引起可神经元的坏死,于3~24 h内明显,其中6 h达最高峰,推测神经元在低镁状态下早期持续激烈的癫痫样放电可能引起线粒体通透性改变,神经元内ATP大量消耗,部分神经元发生应激损伤,甚至由于ATP 的耗竭引起急性神经元坏死。本实验结果显示,在Sombati癫痫细胞产生癫痫样放电后第1天,与正常海马神经细胞比较,其GnT-Vb表达水平降低,而dystroglycan基因表达水平无差异,可能是由于Sombati癫痫细胞早期产生持续剧烈的癫痫样放电时引起神经元急性氧化应激、损伤,阻断了各种活性因子往返转运,引起细胞营养与代谢紊乱,导致造模后早期神经元内某些功能蛋白合成的短暂的反应性降低。总之,GnT-Vb和dystroglycan基因在Sombati癫痫细胞模型中的表达呈现一定的动态变化,随着时间的延长,二者基因表达水平逐渐增高。提示GnT-Vb和dystroglycan基因可能参与了难治性癫痫的形成过程,尤其是细胞持续自发性放电后的后期异常神经网络的重组过程。
表2 造模后第1天对照组和模型组GnT-Vb和dystroglycan基因表达水平比较(n=6)
Table2 Comparison of mRNA expression levels of GnT-Vb and dystroglycan between control group and experimental group on the first day after model establishment

组别GnT-VbAVGΔCt 2-ΔΔCt 倍数变化 t值 P值dystroglycanAVGΔCt 2-ΔΔCt 倍数变化 t值 P值对照组模型组6 29±0 037 12±0 140 0127520 0071720 56-10 3550 0003 84±0 063 97±0 080 0698490 0639420 92-2 2310 090
注:倍数变化为模型组2-ΔΔCt/对照组2-ΔΔCt
表3 造模后第4天对照组和模型组GnT-Vb和dystroglycan基因表达水平比较(n=6)
Table3 Comparison of mRNA expression levels of GnT-Vb and dystroglycan between control group and experimental group on the fourth day after model establishment

组别GnT-VbAVGΔCt 2-ΔΔCt 倍数变化 t值 P值dystroglycanAVGΔCt 2-ΔΔCt 倍数变化 t值 P值对照组模型组7 40±0 006 43±0 090 0059320 0116311 9618 6280 0003 80±0 053 30±0 090 0719050 1017581 428 8150 001
癫痫的形成过程是一个受多种因子共同参与的复杂过程,不仅涉及神经元之间、神经元与胶质细胞之间的相互作用,而且还涉及许多生物活性分子之间复杂的相互调控机制。GnT-Vb和dystroglycan可能同时参与了癫痫的形成过程,但仍需要更深入的研究以阐明GnT-Vb和dystroglycan相关的信号转导通路及其与整合素-层黏连蛋白跨膜系统的相互作用,从而进一步阐明癫痫的形成机制,有可能为难治性癫痫的治疗提供一个新的靶点。
1 Casillas-Espinosa PM,Powell KL,O′Brien TJ. Regulators of synaptic transmission:roles in the pathogenesis and treatment of epilepsy[J]. Epilepsia, 2012,53(9):41-58.
2 Kiryushko D,Berezin V,Bock E.Regulators of neurite outgrowth:role of cell adhesion molecules[J]. Ann N Y Acad Sci,2004,1014:140-154.
3 马美刚,吴原,苏婕,等. 难治性癫痫细胞模型中Lamininβ1的表达及意义[J].中风与神经疾病杂志,2010,27(10):886-889.
4 苏婕,吴原,吴月娟,等. 体外培养癫痫细胞模型中整合素α2表达的变化[J].中国神经精神疾病杂志 ,2011,37(8):482-485.
5 Berti C,Bartesaghi L,Ghidinelli M,et al. Non-redundant function of dystroglycan and β1 integrins in radial sorting of axons[J]. Development,2011,138(18):4025-4037.
6 Lee I,Guo HB,Kamar M,et al. N-acetylglucosaminyltranferase VB expression enhances beta1 integrin-dependent PC12 neurite outgrowth on laminin and collagen[J]. J Neurochem,2006,97(4):947-956.
7 马美刚,吴原,刘秀颖,等. 海马神经元癫痫细胞模型的建立及乳酸脱氢酶变化的研究[C].中华医学会第十三次全国神经病学学术会议论文汇编,2010.
8 赵文元,刘建民,卢亦成,等. 体外培养海马神经元癫痫样放电后的丢失方式[J]. 中华医学杂志,2002,82(23):1629-1631.
