三阴乳腺癌组织中乳腺小黏蛋白和局部黏着斑激酶的表达及意义
2014-02-08张尘玉杨志强迟新楠
张 微,张尘玉,杨志强,迟新楠,岳 莉
乳腺癌是发展中国家女性最常见的恶性肿瘤之一[1],每年大约有40万女性死于该疾病[2],其中三阴乳腺癌(triple-negative breast cancer,TNBC)是导致治疗失败和死亡的主要类型。TNBC复发和转移的风险较高[3],并且容易对蒽环类和紫杉类药物耐药,对激素和靶向治疗也不敏感,这些药物治疗失败后没有更好的解救方案可选择,是目前临床治疗TNBC最大的难题。在过去的几十年里,发达国家乳腺癌的发病率持续上升,而病死率则呈现相对下降的趋势,这得益于良好的医疗环境和体检的常规化。乳腺小黏蛋白(small breast epithelial mucin,SBEM)近几年被认为是乳腺癌患者微转移的分子标志物[4],在乳腺组织、淋巴结和外周血中检测到乳腺特异性蛋白的表达,可以早期发现乳腺癌微转移、预测肿瘤复发、指导临床用药等。局部黏着斑激酶(focal adhesion kinase,FAK)是一种非受体酪氨酸激酶,在多种恶性肿瘤中高表达或过度激活[5],其高表达导致肿瘤细胞的黏附状态发生改变,促进肿瘤细胞的侵袭和转移。本研究回顾性分析TNBC患者组织中SBEM和FAK的表达情况,并探讨两者在TNBC中的表达相关性及对预后的影响。
1 资料与方法
1.1 临床资料 收集2005—2007年辽宁医学院附属第一医院术后诊断为乳腺癌的石蜡标本67例,均为女性,年龄35~68岁,平均52岁,患者术前均未接受放化疗及免疫治疗。乳腺癌的诊断和分级参照世界卫生组织(WHO)诊断标准,经两名病理学专家诊断确定TNBC。其中Ⅰ级14例,Ⅱ级29例,Ⅲ级24例;存在淋巴结转移者35例。免疫组化标本经10%福尔马林溶液固定,石蜡包埋。随访从术后第1天开始,主要采用电话、邮件、面谈、门诊随访的方式,每例患者至少随访5年。
1.2 主要试剂及方法 (1)兔抗人SBEM与FAK多克隆抗体及免疫组化SP试剂盒购自美国R&B公司。免疫组化技术采用三步法,标本常规采用10%福尔马林溶液固定,60 ℃烘烤过夜。脱蜡水化,磷酸盐缓冲液(PBS)冲洗3次,3%过氧化氢(H2O2)室温孵育15 min,PBS冲洗,高压修复1.5 min,加入一抗(浓度1∶100)4 ℃过夜(4 ℃过夜后在37 ℃复温45 min)。PBS冲洗3次,加入二抗室温孵育20 min,PBS冲洗3次,滴加试剂链霉亲和素-生物素复合物(SABC)室温孵育20 min,二氨基联苯胺(DAB)显色,蒸馏水洗,苏木素对比染色,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜检。用已知阳性组织切片做阳性对照,PBS代替一抗作为阴性对照。
1.3 结果判断 SBEM主要表达于细胞膜,其次表达于细胞质,极少部分表达于细胞核。FAK主要表达在细胞质,以出现棕黄色颗粒判定为阳性细胞(见图1~4)。根据染色程度及染色阳性细胞占肿瘤细胞总数百分比综合计分。按照阳性细胞比例计分:<25%为0分,25%~50%为1分,51%~75%为2分,>75%为3分;不染色记0分,淡黄色记1分,黄色或深黄色记2分,棕黄色记3分。每张切片的两项得分之和<4分为阴性表达,≥4分为阳性表达。
1.4 无病生存期(DFS)和总生存期(OS) DFS的定义是指从随机化开始至疾病复发或由于疾病进展导致患者死亡的时间。该指标也常作为抗肿瘤药物Ⅲ期临床试验的主要终点。OS的定义是指从随机化开始至因任何原因引起死亡的时间。该指标常被认为是肿瘤临床试验中最佳的疗效终点。如果在生存期上有小幅度的提高,可以认为是有意义的临床受益证据。通过与患者直接接触或者通过电话随访,截止到最后一次有记录的、与患者接触的时间。
1.5 统计学方法 采用SPSS 17.0统计软件进行统计学分析,不同组间蛋白表达差异采用χ2检验;生存分析采用Kaplan-Meier生存曲线;预后因素采用Cox风险比例模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 SBEM和FAK在TNBC组织中的表达与临床病理特征的关系 SBEM在TNBC中阳性率为52.2%(35/67),FAK在TNBC中阳性率为68.7%(46/67)。不同病理分级、淋巴结转移和Ki67表达情况的TNBC患者癌组织中SBEM和FAK阳性率比较,差异均有统计学意义(P<0.05),而不同月经状况、年龄、肿块直径的TNBC患者癌组织中SBEM和FAK阳性率比较,差异均无统计学意义(P>0.05,见表1)。
2.2 SBEM和FAK在TNBC组织中表达的相关性 列联表独立性χ2检验显示SBEM与FAK之间有关联(χ2=15.92,P<0.05),Pearson列联系数r=0.438(见表2)。
表1 SBEM和FAK在TNBC组织中的表达与临床病理特征的关系(例)
Table1 Relationship of SBEM and FAK with clinicopathological features in TNBC
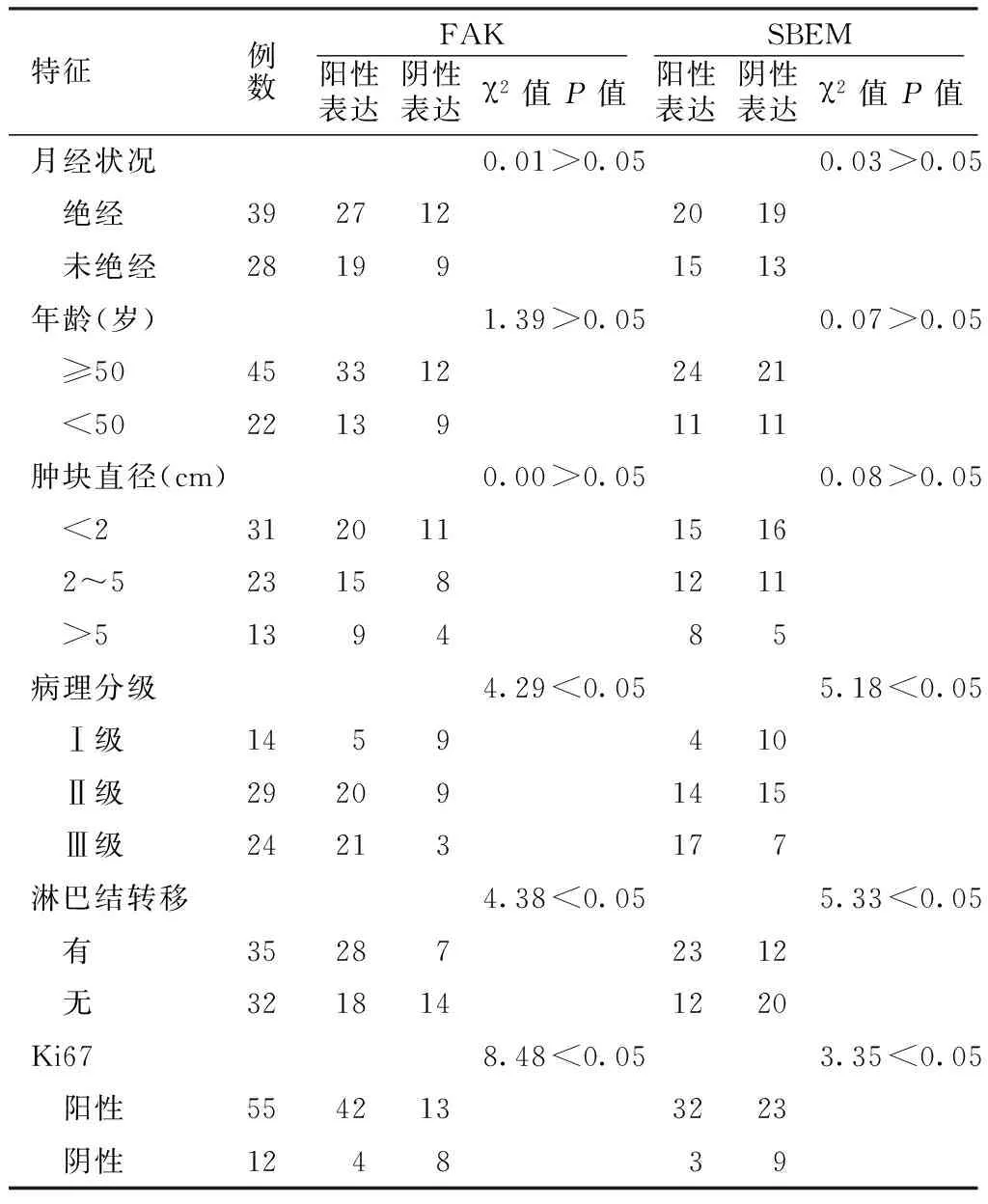
特征例数FAK阳性表达阴性表达χ2值P值SBEM阳性表达阴性表达χ2值P值月经状况0.01>0.050.03>0.05 绝经3927122019 未绝经281991513年龄(岁)1.39>0.050.07>0.05 ≥504533122421 <50221391111肿块直径(cm)0.00>0.050.08>0.05 <23120111516 2~5231581211 >5139485病理分级4.29<0.055.18<0.05 Ⅰ级1459410 Ⅱ级292091415 Ⅲ级24213177淋巴结转移4.38<0.055.33<0.05 有352872312 无3218141220Ki678.48<0.053.35<0.05 阳性5542133223 阴性124839
注:SBEM=乳腺小黏蛋白,FAK=局部黏着斑激酶
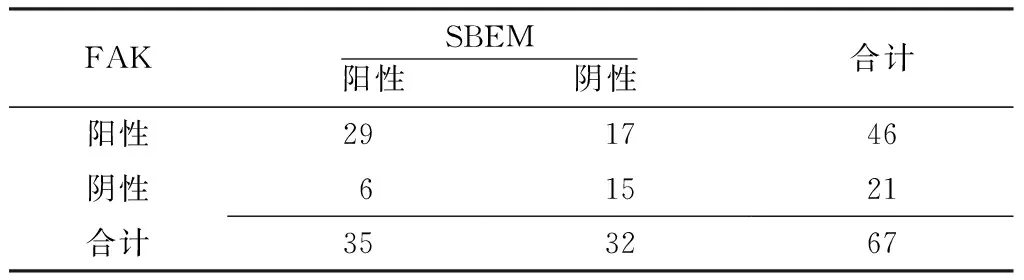
表2 SBEM和FAK在TNBC组织中表达的相关性(例)
2.3 生存分析 所有患者随访至2013年3月,中位随访时间25.8(11.0~45.1)个月。SBEM阳性组中位DFS为21.4个月,中位OS为28.9个月,SBEM阴性组中位DFS为23.3个月,中位OS为35.6个月,两组比较差异均有统计学意义(χ2值分别为9.63和8.56,P<0.05,见图5、6)。FAK阳性组中位DFS为20.7个月,中位OS为25.4个月,FAK阴性组中位DFS为22.9个月,中位OS为32.5个月,两组比较差异均有统计学意义(χ2值分别为11.37和9.20,P<0.05,见图7、8)。
2.4 预后因素分析 67例TNBC患者5年无瘤生存率为7.5%,5年总生存率为13.4%。采用Cox模型进行多因素分析,结果显示,病理分级、淋巴结转移、Ki67、SBEM和FAK与5年无瘤生存率和5年总生存率有回归关系(P<0.05,见表3)。
3 讨论
TNBC占所有新诊断乳腺癌患者的11%~20%[6],与其他亚型乳腺癌相比,TNBC患者缺乏激素治疗和靶向治疗的抗体表型,进展迅速,预后较差[7]。这可能是因为在某些情况下,特定的非规范的治疗产生的分子变化可能导致临床耐药,因此对TNBC提出有效的治疗策略,是控制乳腺癌发展的一个重大挑战[8]。乳腺癌的发生和发展是一个多基因、多因素参与的复杂过程,淋巴结是乳腺癌复发和转移最重要的预测[9],化疗耐药[10]是影响患者预后的重要因素,而侵袭和转移是恶性肿瘤危及生命的最重要的生物学特征[11]。目前虽然对于肿瘤的侵袭转移认识在不断深入,但是,对隐匿性恶性肿瘤的早期发现给予明确的诊断,仍然非常困难,特别是对于一些恶性度特别高的肿瘤,早期发现并控制转移具有重要的临床意义。
表3 影响TNBC患者5年无瘤生存率和5年总生存率的多因素Cox分析
Table3 Multiple factors Cox analysis of 5-year DFS and 5-year OS in TNBC patients
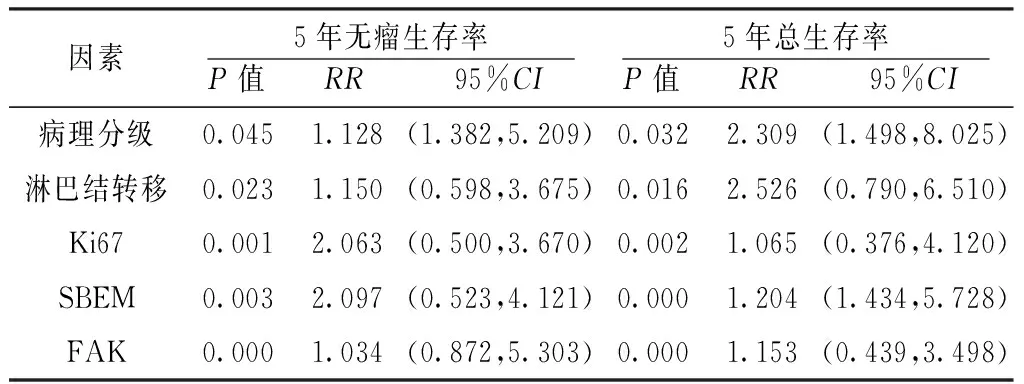
因素5年无瘤生存率P值 RR 95%CI 5年总生存率P值 RR 95%CI 病理分级0.0451.128(1.382,5.209)0.0322.309(1.498,8.025)淋巴结转移0.0231.150(0.598,3.675)0.0162.526(0.790,6.510)Ki670.0012.063(0.500,3.670)0.0021.065(0.376,4.120)SBEM0.0032.097(0.523,4.121)0.0001.204(1.434,5.728)FAK0.0001.034(0.872,5.303)0.0001.153(0.439,3.498)

图1 SBEM在TNBC组织中阴性表达
Figure1 Negative expression of SBEM in TNBC
图2 SBEM在TNBC组织中阳性表达
Figure2 Positive expression of SBEM in TNBC
图3 FAK在TNBC组织中阴性表达
Figure3 Negative expression of FAK in TNBC
图4 FAK在TNBC组织中阳性表达
Figure4 Positive expression of FAK in TNBC
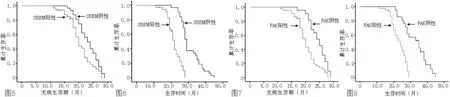
图5 SBEM阳性组与SBEM阴性组TNBC患者DFS
Figure5 DFS of TNBC patients in SBEM positive group and SBEM negative group
图6 SBEM阳性组与SBEM阴性组TNBC患者OS
Figure6 OS of TNBC patients in SBEM positive group and SBEM negative group
图7 FAK阳性组与FAK阴性组TNBC患者DFS
Figure7 DFS of TNBC patients in FAK positive group and FAK negative group
图8 FAK阳性组与FAK阴性组TNBC患者OS
Figure8 OS of TNBC patients in FAK positive group and FAK negative group
SBEM仅在乳腺和唾液中表达,在乳腺癌组织及转移性淋巴结中呈过度表达,Miksicek等[4]于2002年首先报道了该蛋白具有较高的特异性,可能是用于检测乳腺癌微转移的生物标志物之一。Skliris等[12]发现SBEM在乳腺癌ER阴性组的阳性表达率明显高于ER阳性组。Valladares-Ayerbes等[13]评估了SBEM作为一种潜在的肿瘤标志物在乳腺癌骨髓转移中诊断的准确性,可能与乳腺癌的不同分子亚型相关。目前,SBEM与乳腺癌的关系仍在探讨中,其过度表达可能与乳腺癌的TNM分期以及淋巴结转移均密切相关,对乳腺癌转移的预测和治疗可能具有重要的指导意义。
FAK是由Schaller等首先发现的一种非受体酪氨酸激酶。FAK的高表达导致肿瘤细胞的黏附状态发生改变,启动一个“外部”信号级联[14],参与调节细胞的存活、运动和黏附,参与细胞骨架的变化和基因转录[15]等多种细胞反应。FAK在多种细胞不同功能的调节中具有重要的信号转导功能,促进乳腺癌细胞的增殖和转移,是乳腺癌干细胞表面一个重要的生物标志物之一[16]。FAK已被证明在乳腺癌发生的早期阶段中会出现过度表达[17],其高表达是乳腺癌细胞发生侵袭和转移的重要因素,围绕FAK开发新的靶向药物以抑制肿瘤细胞的侵袭和转移,成为目前的研究热点之一。
本研究发现SBEM在TNBC中阳性率为52.2%,FAK在TNBC中阳性率为68.7%,两者在TNBC组织中的表达呈正相关。SBEM及FAK阳性组中位DFS和中位OS均低于阴性组。多因素Cox分析结果显示:病理分级、淋巴结转移、Ki67、SBEM和FAK是5年无瘤生存率和5年总生存率的独立预后影响因素。SBEM及FAK的阳性表达是影响预后的重要因素。SBEM和FAK可能在乳腺癌的发生及发展过程中起着重要的促进作用。这表明两者的阳性表达可能对乳腺癌的早期转移是一个潜在的生物学信号,从而对乳腺癌的预后判断具有重要的指导意义。围绕这两个因子开展的靶点研究成为目前的研究热点,两者相关性的研究可能为寻找其共同的上游通路提供一定的依据。
尽管目前许多肿瘤标志物已经应用于临床,但是由于缺乏特异度且敏感度较低等原因,对于肿瘤的诊断以及预后判断尚未形成统一的标准。虽然,本研究结果支持SBEM和FAK可作为判断TNBC预后的标志物,但由于样本量较少,仍需要加大样本量进一步研究证实,检测两者的表达可能为乳腺癌的转移及预后判断提供一定的参考。
1 Kosti O,Byrne C,Cocilovo C,et al.Phytohemagglutinin-induced mitotic index in blood lymphocytes:a potential biomarker for breast cancer risk[J].Breast Cancer(Auckl),2010,4:73-83.
2 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
3 Dent R,Trudeau M,Pritchard KI,et al.Triple-negative breast cancer:clinical features and patterns of recurrence[J].Clin Cancer Res,2007,13(15):4429-4434.
4 Miksicek RJ,Myal Y,Watson PH,et al.Identification of a noval breast-and salivary gland specific,mucin-like gene strongly expressed in normal and tulnor human mammary epithelium[J].Cancer Res,2002,62(10):2736-2740.
5 Carelli S,Zadra G,Vaira V,et al.Up-regulation of focal adhesion kinase in non-small cell lung cancer[J].Lung Cancer,2006,53(3):263-271.
6 Ismail-Khan R,Bui MM.A review of triple-negative breast cancer[J].Cancer Control,2010,17(3):173-176.
7 Krishnamurthy S,Poornima R,Challa VR,et al.Triple negative breast cancer -our experience and review[J].Indian J Surg Oncol,2012,3(1):12-16.
8 Schneider BP,Winer EP,Foulkes WD,et al.Triple-negative breast cancer:risk factors to potential targets[J].Clin Cancer Res,2008,14(24):8010-8018.
9 Carpenter WR,Reeder-Hayes K,Bainbridge J,et al.The role of organizational affiliations and research networks in the diffusion of breast cancer treatment innovation[J].Med Care,2011,49(2):172-179.
10 Morganti AG,Cilla S,de Gaetano A,et al.Forward planned intensity modulated radiotherapy(IMRT) for whole breast postoperative radiotherapy.Is it useful? When? [J].J Appl Clin Med Phys,2011,12(2):3451.
11 Markopoulos CJ.Minimizing early relapse and maximizing treatment outcomes in hormone-sensitive postmenopausal breast cancer:efficacy review of AI trials[J].Cancer Metastasis Rev,2010,29(4):581-594.
12 Skliris GP,Hubé F,Gheorghiu I,et al.Expression of small breast epithelial mucin(SBEM) protein in tissue microarrays(TMAs) of primary invasive breast cancers[J].Histopathology,2008,52(3):355-369.
13 Valladares-Ayerbes M,Iglesias-Díaz P,Díaz-Prado S,et al.Diagnostic accuracy of small breast epithelial mucin mRNA as a marker for bone marrow micrometastasis inbreast cancer:a pilot study[J].J Cancer Res Clin Oncol,2009,135(9):1185-1195.
14 Wolf K,Friedl P.Molecular mechanisms of cancer cell invasion and plasticity[J].Br J Dermatol,2006,154(1):11-15.
15 Alapati K,Gopinath S,Malla RR,et al.uPAR and cathepsin B knockdown inhibits radiation-induced PKC integrated integrin signaling to the cytoskeleton of glioma-initiating cells[J].Int J Oncol,2012,41(2):599-610.
16 Guan JL.Integrin signaling through FAK in the regulation of mammary stem cells and breast cancer[J].IUBMB Life,2010,62(4):268-276.
17 Golubovskaya VM,Zheng M,Zhang L,et al.The direct effect of focal adhesion kinase(FAK),dominant-negative FAK,FAK-CD and FAK siRNA on gene expression and human MCF-7 breast cancer cell tumorigenesis[J].BMC Cancer,2009,9:280.
