异基因造血干细胞移植后伊马替尼维持治疗对Ph+ALL疗效的Meta分析*
2014-02-06周立昕陈洁平
周立昕,宫 蔷,陈洁平
(第三军医大学西南医院血液病中心,重庆 400038)
费城染色体(Ph+染色体)以9号染色体与22号染色体长臂的相互异位[t(9;22)(q34;q11)]为特征,可形成BCR/ABL融合基因,多见于成人急性淋巴细胞白血病(ALL)患者,为成人ALL中最常见的细胞遗传学异常,其比例随年龄而增加,在大于50岁的患者中其发生率可高达50%以上[1-3]。Ph+ALL采用常规化学治疗的疗效差、缓解率低、复发率高,中位生存时间仅为6~12个月[4-5]。
异基因造血干细胞移植(Allo-HSCT)被认为是惟一有望治愈Ph+ALL的手段,但长期疗效并不让人满意,移植后长期生存率仅为21%~57%[6]。导致治疗失败的主要原因为复发,即使在CR1期时行移植仍有近30%的患者复发[7-9]。如何提高Ph+ALL治疗效果是临床治疗的一大难题。伊马替尼(imatinb,IM)为高效的酪氨酸激酶抑制剂(TKI),能有效抑制Ph+染色体编码的BCR/ABL融合基因,为治疗Ph+慢性髓系白血病(CML)的一线药物[10-11],近年来开始广泛用于Ph+ALL的治疗。多项研究表明联合IM的治疗方案明显提高了Ph+ALL的完全缓解率(90%~100%),同时可降低复发率并改善无病生存率,使更多患者有机会接受造血干细胞移植,很大程度上改善了Ph+ALL的预后,但复发的可能性仍较高[12-16]。近年来,IM联合Allo-HSCT治疗Ph+ALL的研究备受关注,有研究表明Allo-HSCT后IM维持治疗可预防复发并促进长期生存[17-18],但其作用及有效性仍存在争议。
本研究收集比较Allo-HSCT后含与不含IM的治疗方案或IM不同治疗起点对移植后Ph+ALL疗效影响的研究,进行系统评价,评估IM在治疗移植后Ph+ALL中的作用及疗效,旨在为临床Ph+ALL治疗提供线索及依据。
1 资料与方法
1.1一般资料
1.1.1研究对象 (1)经骨髓细胞形态学、荧光原位杂交法、融合基因检测等确诊为Ph+ALL的患者;(2)无年龄、性别、种族及临床分期限制;(3)排除患有2种及以上恶性肿瘤者。
1.1.2研究类型 纳入比较研究为随机对照研究(RCT)及观察性研究,排除历史对照及自身对照研究,不限发表时间。
1.1.3干预措施 纳入比较移植后用与不用IM或IM不同治疗起点对Ph+ALL疗效影响的比较研究。
1.1.4结局指标 (1)总生存率;(2)无病生存率;(3)非复发死亡率;(4)白细胞植入时间;(5)血小板植入时间;(6)复发率。
1.2方法
1.2.1检索策略 计算机检索Cochrane Library及临床试验注册中心(metaregister of controlled trials)、PubMed、EMbase、中国知网、中国生物医学文献数据库、中国万方和中国维普等数据库,并辅以手工检索和文献追溯,获取移植后含与不含IM的治疗方案或IM不同治疗起点对Ph+ALL疗效影响的比较研究。检索时限均从建库至2014年4月3日。检索采用主题词和自由词相结合的方式。英文检索词为acute lymphoblastic leukemia、imatinib、transplantation等;中文检索词为急性淋巴细胞白血病、伊马替尼、移植等。检索策略无语种限制。
1.2.2文献筛选 将检索结果导入文献管理软件EndNote X7中,由2位评价员独立按纳入与排除标准筛选文献并相互核对。首先通过阅读文献标题和摘要剔除不相关和重复的研究,获取可能相关的研究全文,如符合纳入标准则纳入;通过讨论或咨询第3方解决分歧。
1.2.3资料提取 制定本课题数据提取表,由2名作者独立提取资料,并相互核查,有分歧时通过讨论或咨询第3方解决,提取的资料包括:(1)研究的基本信息:题目、发表杂志、作者等;(2)研究方法:研究设计、偏倚来源等;(2)观察对象纳入标准、干预措施、受试者特征;(3)结果测量指标等。
1.2.4纳入研究的方法学质量评价 RCT采用Cochrane的偏倚风险评估工具评价纳入研究的方法学质量。非RCT文章采用纽卡斯尔-渥太华量表(NOS)评价纳入研究质量,量表包括3个部分,共8个条目,满分为9分。
1.3统计学处理 采用Cochrane协作网RevMan5.2软件进行Meta分析。首先采用χ2检验分析纳入研究的异质性,当P≥0.10,I2≤50% 时,采用固定效应模型进行Meta分析;反之,则采用随机效应模型。时间事件数据的提取参照Tierney 等[19]的方法,疗效效应量选择风险比(HR)。对于计量资料,疗效效应量选用均数差(MD)。以P<0.05为差异有统计学意义。通过森林图列出异质性检验及统计分析结果。使用漏斗图分析可能的发表偏移。
2 结 果
2.1文献检索结果 初检共获得1 302 篇文献,去重后共760篇,通过阅读题目和摘要排除724,筛选出36篇文献获取全文后进行进一步评估,最终纳入7篇文献[20-26]。
2.2纳入研究的基本特征及方法学质量评价 纳入研究的7篇文献共包括366例受试对象,所有纳入病例均为经骨髓细胞形态学、荧光原位杂交法、融合基因检测等确诊为Ph+ALL的患者。其中6项回顾性研究目的为Allo-HSCT后Ph+ALL是否使用IM的疗效比较,另1项RCT研究为移植后不同IM治疗起点的比较。各纳入研究的基本特征及方法学评价见表1。
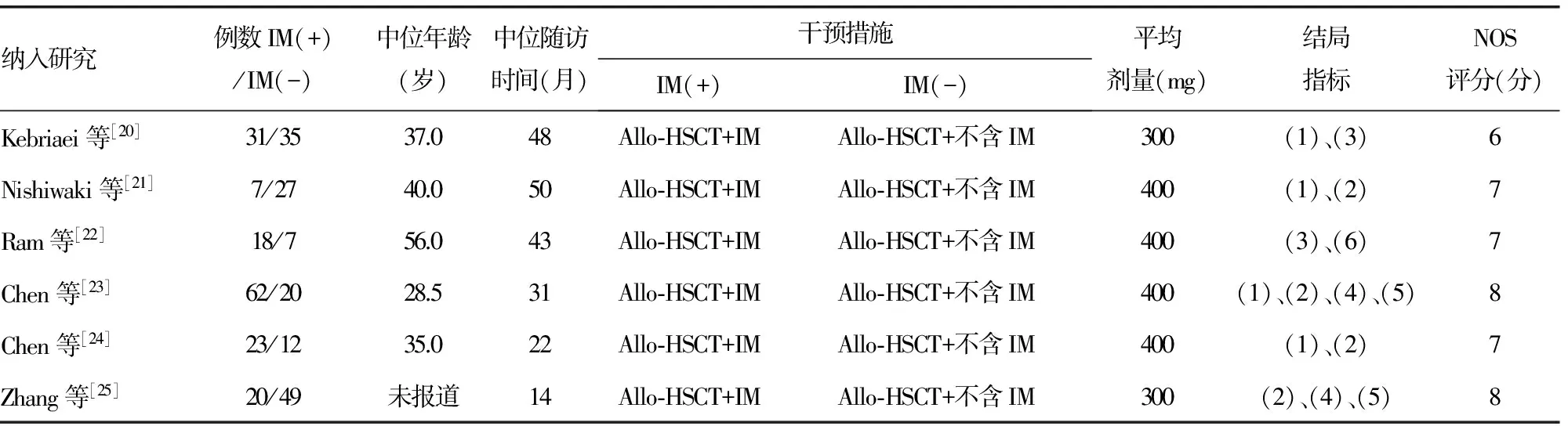
表1 纳入非RCT研究的基本特征
+:使用IM;-:未使用IM。
2.3统计分析结果
2.3.1总生存率 共4个研究[20-21,23-24]报告了移植后是否使用IM的总生存率的数据。异质性检验结果P=0.84,I2=0,采用固定效应模型。Meta 分析结果显示移植后IM(+)组与IM(-)组间总生存率比较的效应统计量HR及其95%CI为0.22(0.17~0.27),差异有统计学意义(P<0.01),见图1。
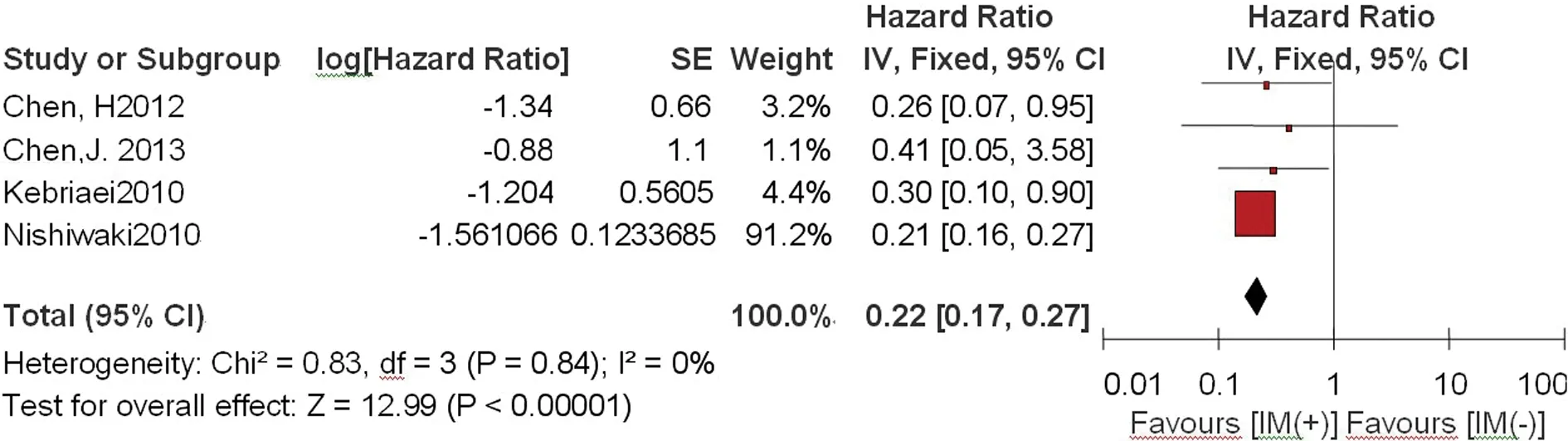
图1 移植后IM(+)组与IM(-)组总生存率比较的Meta分析
2.3.2无病生存率 共4个研究[21,23-25]报道了移植后是否使用IM的无病生存率的数据。异质性检验结果P=0.170,I2=41%,采用固定效应模型。Meta分析结果显示移植后IM(+)组与IM(-)组间无病生存率比较的效应统计量HR及其95%CI为0.84(0.80~0.89),差异有统计学意义(P<0.01),见图2。
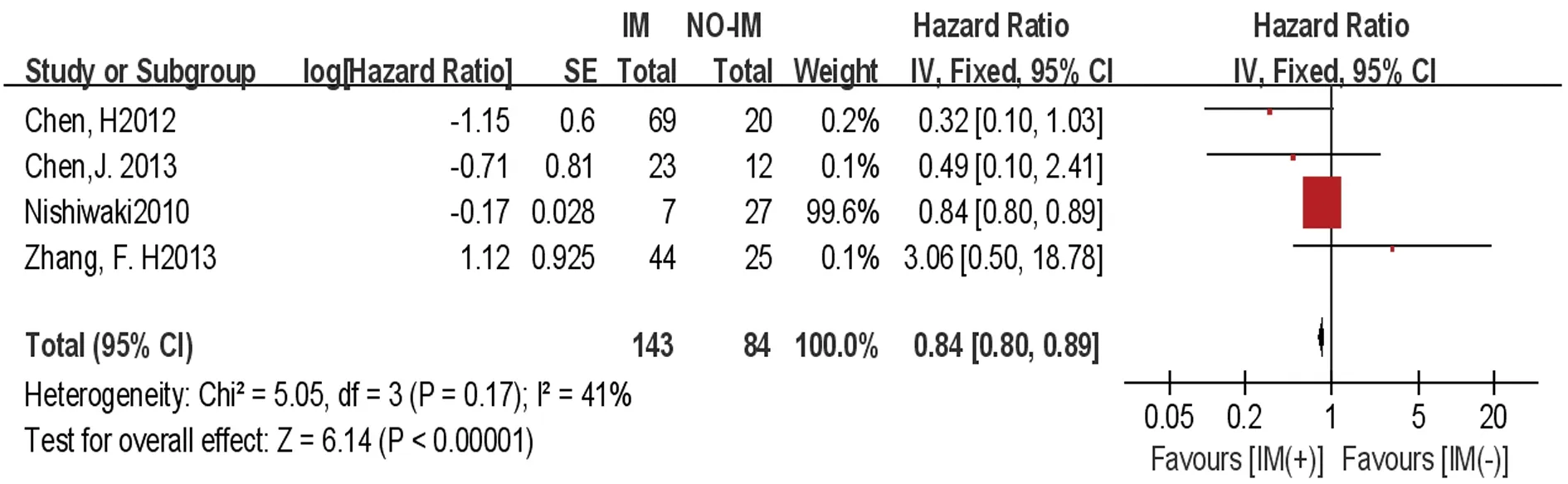
图2 移植后IM(+)组与IM(-)组无病生存率比较的Meta 分析
2.3.3非复发死亡率 2篇研究[20,22]报道了移植后是否使用IM的非复发死亡率的数据。异质性检验结果P=0.480,I2=0,采用固定效应模型。Meta分析结果显示移植后IM(+)组与IM(-)组间非复发死亡率比较的效应统计量HR及其95%CI为0.41(0.20~0.82),差异有统计学意义(P<0.05),见图3。
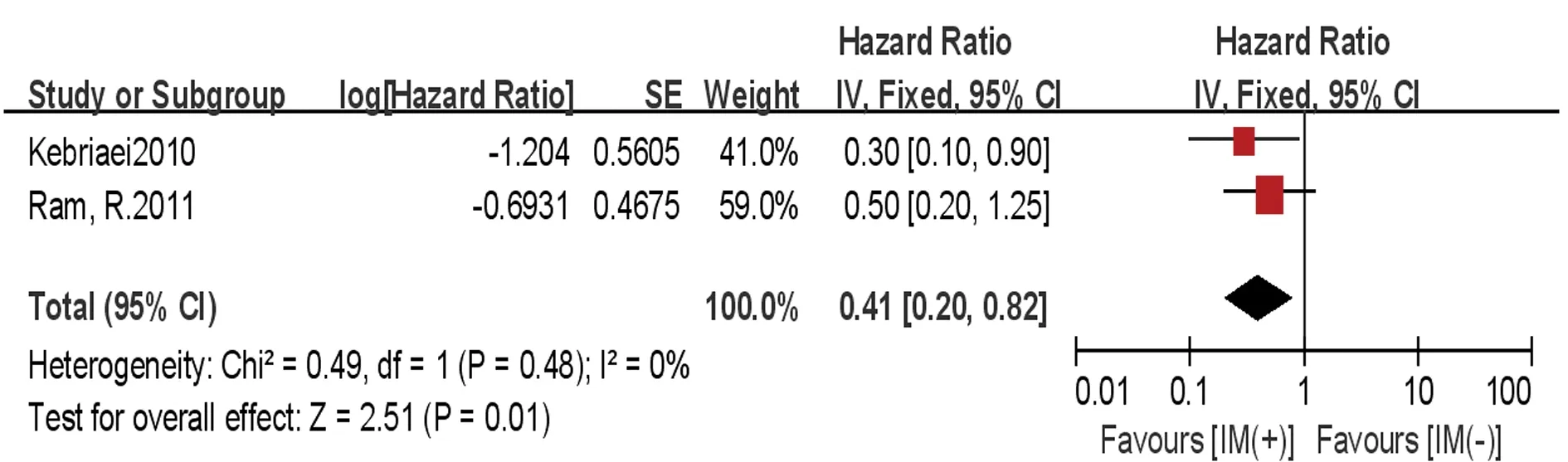
图3 移植后IM(+)组与IM(-)组非复发死亡率比较的Meta分析
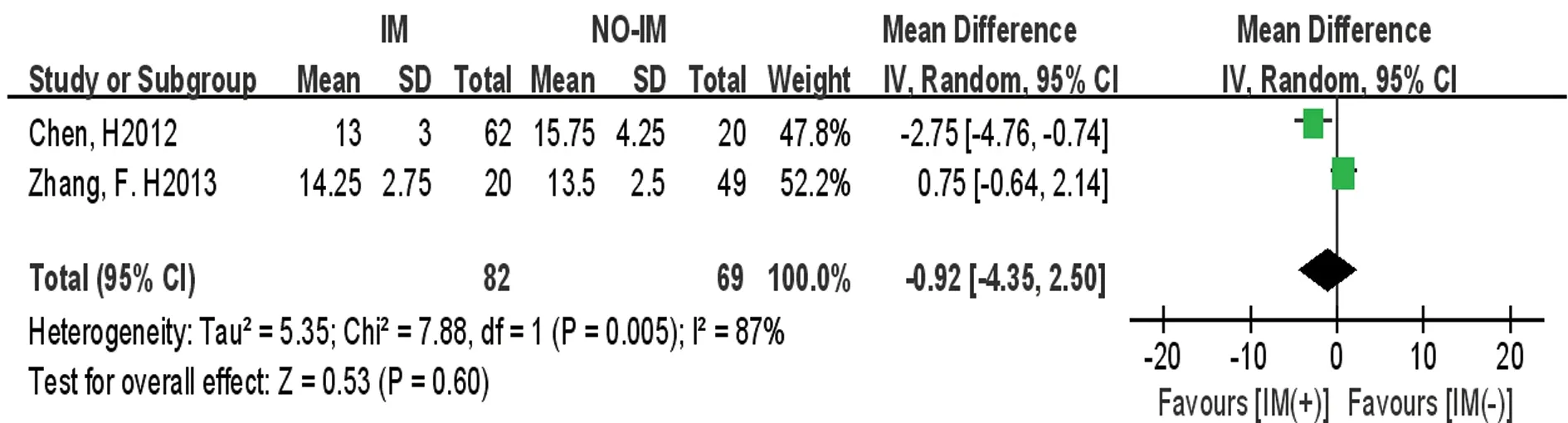
图4 移植后IM(+)组与IM(-)组白细胞植入时间比较的Meta分析
2.3.4白细胞植入时间 共2篇研究[23,25]报道了移植后是否使用IM的白细胞植入时间的数据。异质性检验结果P=0.005,I2=87%,采用随机效应模型进行合并。Meta分析结果显示移植后IM(+)组与IM(-)组之间白细胞植入时间比较的效应统计量MD及其95%CI为-0.92(-4.35~2.50),差异无统计学意义(P>0.05),见图4。
2.3.5血小板植入时间 共2篇研究[23,25]报道了移植后是否使用IM的血小板植入时间的数据。异质性检验结果P=0.920,I2=0,采用固定效应模型。Meta分析结果显示移植后IM(+)组与IM(-)组之间血小板植入时间比较的效应统计量MD及其95%CI为0.78(-1.59~3.16),差异无统计学意义(P>0.05),见图5。
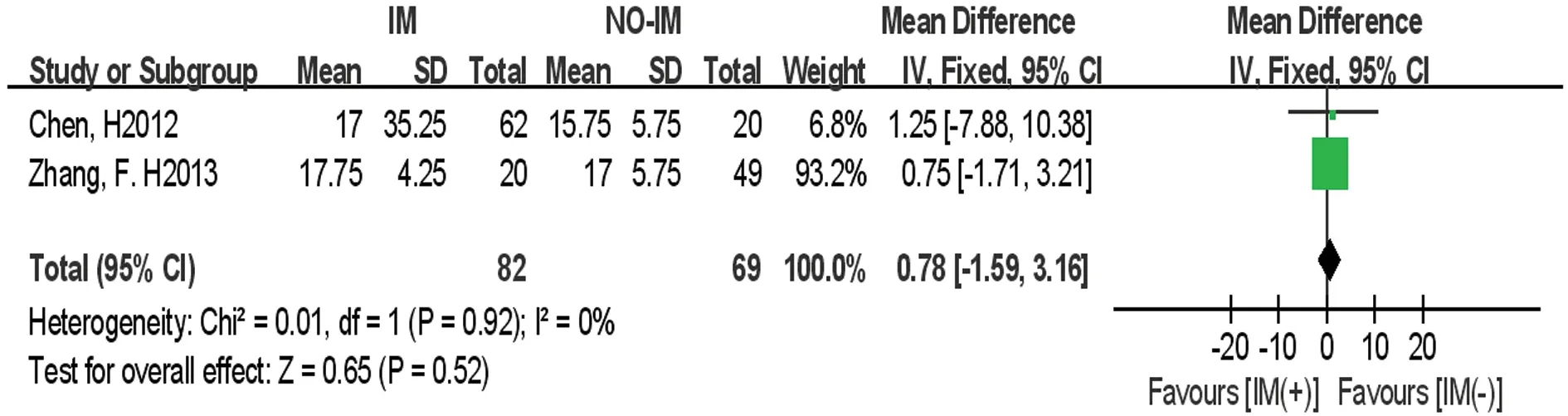
图5 移植后IM(+)组与IM(-)组血小板植入时间比较的Meta分析
2.3.6复发率 仅Ram等[22]研究报告了复发率的数据,分析表明移植后IM(+)组与IM(-)组之间复发率比较的效应统计量HR及其95%CI为0.4(0.1~1.5),差异无统计学意义(P>0.05)。
2.3.7移植后IM不同治疗起点对疗效的影响 Pfeifer等[26]的研究将55名移植后Ph+ALL患者随机分组,IM治疗起点分别为“预防性应用”及“检测到微小残留病变(MRD)之后应用”。观察这两种不同方法治疗移植后Ph+ALL患者的疗效差异。结果提示,预防性应用IM与检测到MRD后应用IM相比,可以显著降低移植后的分子学复发率,并延长BCR/ABL检测持续阴性的时间。但两组在缓解持续时间、无病生存期、总生存率及无事件生存率等方面无明显差异。两组均可降低血液学复发率,获得持久的缓解,长期预后良好。该试验同时提示,移植后早期(100 d内)检测到MRD,与预后不良有关。
2.4发表偏倚评价 由于纳入的研究数量限制,未采用漏斗图分析来评估发表偏倚。
3 讨 论
Ph+染色体最早发现于CML中,见于约98%的CML患者。此后,在ALL中同样发现Ph+染色体存在。Ph+ALL存在染色体(9;22)异位并可形成BCR/ABL融合基因,提示临床预后不良[4-5],其临床治疗有别于其他类型的ALL。目前认为在CR1期行Allo-HSCT是有望治愈Ph+ALL的主要方法。Allo-HSCT相对单纯化学治疗的优势已被多项研究证实[27-28],但长期疗效仍有限,研究显示即使在CR1期行Allo-HSCT仍有近30%的患者复发[7]。IM能有效抑制Ph+染色体编码的BCR/ABL融合基因,选择性抑制Ph+ALL的增殖与抗凋亡作用,其与多种化学治疗方案联合用于治疗Ph+ALL被证实可获得显著疗效,降低诱导化学治疗期的病死率及并发症,并获得了超过90%的完全缓解率[12,16,29]。
Allo-HSCT联合IM治疗Ph+ALL为近年研究热点。移植后IM维持治疗被认为可预防复发并促进长期生存[17-18]。文献[30]报道联合应用IM和Allo-HSCT,其3年总生存率为60%~72%,较不联合应用IM明显升高。Mizuta等[31]的研究表明联合IM与Allo-HSCT,相比于历史对照病例,提高了3年总生存率及无病生存率,降低了复发率,差异有统计学意义(P<0.05),但对非复发死亡率影响不大(P>0.05)。Nakasone等[32]认为移植后IM可降低慢性移植物抗宿主病(cGVHD)的发生及严重程度。但Kebriaei等[33]的研究却持不同观点,其研究结果显示在移植前、后使用IM对总生存率、无病生存率、非复发死亡率及维持MRD等方面均无明显影响,提示IM未能显著改善移植前后Ph+ALL患者生存。但不同研究间的患者年龄、诱导时间、移植时疾病状态、干细胞来源及预处理方案等的差异均有可能会影响到IM的作用效果。到目前为止,Allo-HSCT后IM维持治疗对Ph+ALL作用及疗效仍存在争议[17-18]。
关于移植后IM最佳治疗起点尚无定论。现有研究主张根据移植后BCR/ABL转录本水平决定IM维持治疗开始的时机[18,34-35]。
针对IM对移植后Ph+ALL疗效影响的临床争议,本研究共纳入6项回顾性比较研究及1项RCT研究,包括366例移植后Ph+ALL患者,以移植后是否使用IM或IM的不同治疗起点作为切入点进行比较研究,对总生存率、无病生存率、非复发死亡率、白细胞植入时间、血小板植入时间、复发率等测量指标进行系统评价和Meta分析。研究结果显示,移植后Ph+ALL使用IM维持治疗,可提高移植后Ph+ALL患者总体生存率,改善其无病生存率,降低移植后非复发死亡率,上述差异均有统计学意义(P<0.05),但IM维持治疗对白细胞及血小板植入时间及移植后复发率无明显影响。对于移植后IM治疗起点方面,预防性应用IM与检测到MRD后应用相比,可降低移植后的分子学复发率,并延长BCR/ABL检测持续阴性的时间。但对于缓解持续时间、无病生存期、总生存率及无事件生存率等方面均无明显影响。而移植后早期检测到BCR/ABL阳性,往往预后较差。
由于受纳入病例数及质量的限制,本系统评价具有一定的局限性。(1)由于原始研究限制,纳入了1项RCT及6项回顾性研究,故不能提供基于RCT的较高质量Meta分析。(2)虽然对纳入文献的质量进行了严格的评价,但由于非RCT论证强度较低,设计的偏倚可能会导致结论受限。(3)本研究共纳入7篇文献,其中3篇样本量偏小,可能会增加犯Ⅰ类或Ⅱ类错误的概率。
目前关于IM治疗Ph+ALL的争议问题很多。本文仅针对移植后IM维持治疗对Ph+ALL的疗效问题进行了Meta分析,得出的结论为,移植后IM维持治疗可一定程度上提高总体生存率,改善其无病生存率,降低移植后非复发死亡率,但对移植后血细胞植入时间无明显影响,对复发率的影响仍存在争议。受现有研究数量及质量限制,移植后最佳IM治疗起点尚无定论。
由于本系统评价存在的局限性,对结果的解析需谨慎,需要进一步开展高质量RCT,对该临床问题进行更深入的探索,为IM维持治疗在移植后Ph+ALL中的应用问题提供更可靠的依据。
[1]Faderl S,Kantarjian HM,Talpaz M,et al.Clinical significance of cytogenetic abnormalities in adult acute lymphoblastic leukemia[J].Blood,1998,91(11):3995-4019.
[2]Schlieben S,Borkhardt A,Reinisch I,et al.Incidence and clinical outcome of children with BCR/ABL-positive acute lymphoblastic leukemia(ALL).A prospective RT-PCR study based on 673 patients enrolled in the German pediatric multicenter therapy trials ALL-BFM-90 and CoALL-05-92[J].Leukemia,1996,10(6):957-963.
[3]Moorman AV,Harrison CJ,Buck GA,et al.Karyotype is an Independent prognostic factor in adult acute lymphoblastic leukemia(ALL):analysis of cytogenetic data from patients treated on the Medical Research Council(MRC)UKALLⅫ/Eastern Cooperative Oncology Group(ECOG)2993 trial[J].Blood,2007,109(8):3189-3197.
[4]Fielding AK.Current treatment of Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Haematologica,2010,95(1):8-12.
[5]Ribera JM.Optimal approach to treatment of patients with Philadelphia chromosome-positive acute lymphoblastic leukemia:how to best use all the available tools[J].Leuk Lymphoma,2013,54(1):21-27.
[6]Fielding AK,Rowe JM,Richards SM,et al.Prospective outcome data on 267 unselected adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia confirms superiority of allogeneic transplantation over chemotherapy in the pre-imatinib era:results from the International ALL Trial MRC UKALLⅫ/ECOG2993[J].Blood,2009,113(19):4489-4496.
[7]Laport GG,Alvarnas JC,Palmer JM,et al.Long-term remission of Philadelphia chromosome-positive acute lymphoblastic leukemia after allogeneic hematopoietic cell transplantation from matched sibling donors:a 20-year experience with the fractionated total body irradiation-etoposide regimen[J].Blood,2008,112(3):903-909.
[8]Barrett AJ,Horowitz MM,Ash RC,et al.Bone marrow transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Blood,1992,79(11):3067-3070.
[9]Sierra J,Radich J,Hansen JA,et al.Marrow transplants from unrelated donors for treatment of Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Blood,1997,90(4):1410-1414.
[10]Wei GQ,Rafiyath S,Liu DL.First-line treatment for chronic myeloid leukemia:dasatinib,nilotinib,or imatinib[J].J Hematol Oncol,2010,3(1):3.
[11]Druker BJ,Talpaz M,Resta DJ,et al.Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia[J].N Engl J Med,2001,344(14):1031-1037.
[12]De Labarthe A,Rousselot P,Huguet-Rigal F,et al.Imatinib combined with induction or consolidation chemotherapy in patients with de novo Philadelphia chromosome-positive acute lymphoblastic leukemia:results of the GRAAPH-2003 study[J].Blood,2007,109(4):1408-1413.
[13]Lee S,Kim YJ,Min CK,et al.The effect of first-line imatinib interim therapy on the outcome of allogeneic stem cell transplantation in adults with newly diagnosed Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Blood,2005,105(9):3449-3457.
[14]Wassmann B,Pfeifer H,Goekbuget N,et al.Alternating versus concurrent schedules of imatinib and chemotherapy as front-line therapy for Philadelphia-positive acute lymphoblastic leukemia(Ph+ALL)[J].Blood,2006,108(5):1469-1477.
[15]Delannoy A,Delabesse E,Lhéritier V,et al.Imatinib and methylprednisolone alternated with chemotherapy improve the outcome of elderly patients with Philadelphia-positive acute lymphoblastic leukemia:results of the GRAALL AFR09 study[J].Leukemia,2006,20(9):1526-1532.
[16]Yanada M,Takeuchi J,Sugiura I,et al.High complete remission rate and promising outcome by combination of imatinib and chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia:a phase Ⅱ study by the Japan Adult Leukemia Study Group[J].J Clin Oncol,2006,24(3):460-466.
[17]Carpenter PA,Snyder DS,Flowers ME,et al.Prophylactic administration of imatinib after hematopoietic cell transplantation for high-risk Philadelphia chromosome-positive leukemia[J].Blood,2007,109(7):2791-2793.
[18]Wassmann B,Pfeifer H,Stadler M,et al.Early molecular response to posttransplantation imatinib determines outcome in MRD+Philadelphia-positive acute lymphoblastic leukemia(Ph+ALL)[J].Blood,2005,106(2):458-463.
[19]Tierney JF,Stewart LA,Ghersi D,et al.Practical methods for incorporating summary time-to-event data into Meta-analysis[J].Trials,2007,8:16.
[20]Kebriaei P,Chiattone A,Saliba R,et al.Imatinib maintenance following allogeneic hematopoietic cell transplantation(HCT)for patients with Philadelphia chromosome positive(PH+)acute lymphoblastic leukemia(ALL)[J].Biol Blood Marrow Transplant,2010,16(2,Supplement 2):S230.
[21]Nishiwaki S,Miyamura K,Kato C,et al.Impact of post-transplant imatinib administration on Philadelphia chromosome-positive acute lymphoblastic leukaemia[J].Anticancer Res,2010,30(6):2415-2418.
[22]Ram R,Storb R,Sandmaier BM,et al.Non-myeloablative conditioning with allogeneic hematopoietic cell transplantation for the treatment of high-risk acute lymphoblastic leukemia[J].Haematologica,2011,96(8):1113-1120.
[23]Chen H,Liu KY,Xu LP,et al.Administration of imatinib after allogeneic hematopoietic stem cell transplantation May improve disease-free survival for patients with Philadelphia chromosome-positive acute lymphobla stic leukemia[J].J Hematol Oncol,2012,5:29.
[24]Chen J,Wu DP,Chen F,et al.Efficacies of hematopoietic stem cell transplantation plus imatinib in the treatment of Philadelphia chromosome-positive acute lymphoblastic leukemia:a comparative study[J].Zhonghua Yi Xue Za Zhi,2013,93(8):583-587.
[25]Zhang FH,Ling YW,Zhai X,et al.The effect of imatinib therapy on the outcome of allogeneic stem cell transplantation in adults with Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Hematology,2013,18(3):151-157.
[26]Pfeifer H,Wassmann B,Bethge W,et al.Randomized comparison of prophylactic and minimal residual disease-triggered imatinib after allogeneic stem cell transplantation for BCR-ABL1-positive acute lymphoblastic leukemia[J].Leukemia,2013,27(6):1254-1262.
[27]Kovacsovics T,Maziarz RT.Philadelphia chromosome-positive acute lymphoblastic leukemia:impact of imatinib treatment on remission induction and allogeneic stem cell transplantation[J].Curr Oncol Rep,2006,8(5):343-351.
[28]Pfeifer H,Wettner C,Wassmann B,et al.Long term follow-up of 121 elderly patients with philadelphia-positive acute lymphoblastic leukaemia(PH+ALL)treated in prospective gmall trials supports a greater emphasis on allogeneic SCT as definitive postremission therapy[J].Blood 2012,120(21):1391-1399.
[29]Thomas DA,Faderl S,Cortes J,et al.Treatment of Philadelphia chromosome-positive acute lymphocytic leukemia with hyper-CVAD and imatinib mesylate[J].Blood,2004,103(12):4396-4407.
[30]Fielding AK.Current treatment of Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Haematologica,2010,95(1):8-12.
[31]Mizuta S,Matsuo K,Yagasaki F,et al.Pre-transplant imatinib-based therapy improves the outcome of allogeneic hematopoietic stem cell transplantation for BCR-ABL-positive acute lymphoblastic leukemia[J].Leukemia,2011,25(1):41-47.
[32]Nakasone H,Kanda Y,Takasaki H,et al.Prophylactic impact of imatinib administration after allogeneic stem cell transplantation on the incidence and severity of chronic graft versus host disease in patients with Philadelphia chromosome-positive leukemia[J].Leukemia,2010,24(6):1236-1239.
[33]Kebriaei P,Saliba R,Rondon G,et al.Long-term follow-up of allogeneic hematopoietic stem cell transplantation for patients with Philadelphia chromosome-positive acute lymphoblastic leukemia:impact of tyrosine kinase inhibitors on treatment outcomes[J].Biol Blood Marrow Transplant,2012,18(4):584-592.
[34]Ribera JM,Oriol A,González M,et al.Concurrent intensive chemotherapy and imatinib before and after stem cell transplantation in newly diagnosed Philadelphia chromosome-positive acute lymphoblastic leukemia.Final results of the CSTIBES02 trial[J].Haematologica,2010,95(1):87-95.
[35]Lee S,Kim YJ,Chung NG,et al.The extent of minimal residual disease reduction after the first 4-week imatinib therapy determines outcome of allogeneic stem cell transplantation in adults with Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Cancer,2009,115(3):561-570.
