雌激素对异丙肾上腺素诱导的大鼠心肌损伤及心肌细胞凋亡的影响*
2014-02-06王红军刘功俭
张 洋,武 煜,王红军,孟 晶,刘功俭△
(1.徐州医学院麻醉学院,江苏徐州 221002;2.江苏省徐州市第一人民医院内科 221000)
研究显示心肌收缩功能降低是各种心血管疾病造成心脏泵血能力降低的主要原因。流行病学调查发现,男性和女性的心血管疾病发病率和严重程度存在明显差异,且绝经前妇女心血管疾病的发生率明显低于同年龄男性[1-2],这表明雌激素对于维持心血管健康起重要作用[3-4]。然而,这种心肌保护作用的机制尚不清楚。
心血管疾病致病因素当中,交感肾上腺髓质系统活动增强在中老年患者当中尤为重要,过度增加的儿茶酚胺分泌会造成急性或慢性心肌损伤,对于绝经后妇女儿茶酚胺的作用更为明显[5]。有实验证据表明,细胞凋亡是心肌损伤的重要原因[6],损伤后的心肌收缩功能明显下降。已有研究发现,凋亡相关蛋白Bax的高表达和Bcl-2的低表达与凋亡的活化有关[7-8],而儿茶酚胺过多会造成心肌细胞凋亡,心肌损伤,心功能下降[9]。因此,药物方法抑制心肌细胞凋亡可能是保护因儿茶酚胺过多造成心肌损伤的治疗靶点[10]。因此,本研究旨在阐明雌激素替代治疗对异丙肾上腺素造成心肌损伤的保护作用,并证明雌激素保护心肌的机制为抑制异丙肾上腺素造成的心肌细胞凋亡。
1 材料与方法
1.1实验材料与动物分组 正常健康SD 雌性成年大鼠50只,体质量200~250 g,由徐州医学院实验动物中心提供(使用许可号:SYXK[su]2002-0038)。实验主要试剂:异丙肾上腺素购自Sigma公司(美国),17β 雌二醇购自ABCR公司(德国),一抗Caspase-3、Bcl-2、Bax、GAPDH与二抗均购自Santa Cruz公司(美国)。实验动物由戊巴比妥钠60 mg/kg麻醉,切除双侧卵巢。3 d后皮下注射异丙肾上腺素100 mg·kg-1·d-1,连续5 d[5]。参照本实验室既往研究[11],实验动物分组为假手术组(Sham组)、双侧卵巢切除组(OVX组)、心肌损伤组(OVX+ISO+Vehi组)、雌激素4 μg·kg-1·d-1治疗组(OVX+ISO+ E2a组)、雌激素40 μg·kg-1·d-1治疗组(OVX+ISO+E2b组)。OVX+ISO+Vehiz组和OVX+ISO+E2a组分别皮下注射17β 雌二醇与溶剂连续4周。
1.2方法
1.2.1大鼠血流动力学测定 雌激素替代治疗4周后,测量身长,大鼠戊巴比妥钠60 mg/kg麻醉后,左侧颈总动脉置入微压力传感导管,检测平均动脉血压(MABP)、左心室舒张末期压力(LVEDP)、左心室压力变化速率(±dp/dt)[12]。
1.2.2成年大鼠心肌细胞分离和培养 分离和培养成年大鼠心肌细胞的方法如作者之前的研究[13],简而言之,SD大鼠,麻醉后迅速开胸取心脏,称体质量,Langendorff主动脉逆行灌流无钙酶液(含0.04%胶原酶),循环灌流20~30 min,将心室组织剪成约1 mm×1 mm×1 mm碎块,然后用200目尼龙网过滤,室温下静置20 min,弃上清,反复3次,最后将细胞置于CO2培养箱中。
1.2.3培养心肌细胞存活率的计算 倒置显微镜采集横纹清晰、胞膜完整、长杆状的心肌细胞(放大200倍)测算心肌细胞杆状存活率,心肌细胞肝状存活率=(杆状细胞数量/全部细胞数量)×100%。
1.2.4单个心肌细胞收缩功能的测定 倒置显微镜(Nikon E400)视频记录心肌细胞收缩功能的方法如作者之前的研究[13 ],把培养的心肌细胞置于收缩功能分析装置的细胞浴槽内,2 mmol/L钙和10-7mmol/L 异丙肾上腺素的KH液灌流,0.5 Hz电刺激。采集横纹清晰、胞膜完整、长杆状的心肌细胞(放大200倍)分析其收缩的状况,以及收缩时间(TTP)、舒张90%时间(R90),心肌细胞收缩幅度(%)=(心肌细胞舒张末长度-收缩末长度)/心肌细胞静息长度×100%。
1.2.5流式细胞仪检测细胞凋亡 Annexin V-PI双染色法标记分离培养的心肌细胞,经流式细胞仪检测细胞凋亡率。每样本细胞数控制为(1~5)×106/mL,500~1 000 r/min离心5 min,弃去培养液。加入荧光(SA-FLOUS)溶液4 ℃下孵育20 min,流式细胞仪检测。在双变量流式细胞仪的散点图上,左下象限显示活细胞;右上象限是非活细胞,即坏死及凋亡细胞。
1.2.6Western blot检测蛋白表达 凋亡相关蛋白Caspase 3、Bcl-2和Bax蛋白通过Western blot方法检测。等量蛋白样品(20 μg)加入10% 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳 (SDS-PAGE)分离,转膜后加入一抗(1∶1 000)4 ℃过夜,二抗(1∶3 000)室温孵育2 h。Image J3.0软件分析。

2 结 果
2.1外源性雌激素替代治疗对大鼠一般指标的影响 为了检测雌激素在心泵功能中的作用,将雌性大鼠双侧卵巢切除,该模型可以明显降低血中雌激素水平,随后注射异丙肾上腺素,子宫切除后的雌性大鼠,血浆中雌激素水平(图1A)、子宫体质量(图 1B)显著降低,但是大鼠身长没有改变(本文没有显示该数据)。与Sham组和OVX组比较,OVX+ISO+Vehi组心脏质量与心脏质量/身长比率增加(图 1C、D)。而OVX+ISO+E2b组较OVX+ISO+Vehi组血浆雌激素水平与子宫质量显著增加(图 1A、B),并且降低了由于ISO刺激而引起的心脏质量与心脏质量/身长比率(图 1C、D)。但是较低剂量的雌激素(4 μg·kg-1·d-1)对血浆雌激素水平升高不明显(图 1A),而且对恢复子宫质量的作用非常有限(图 1B)。在实验中,还发现较低剂量的雌激素(4 μg·kg-1·d-1)对于异丙肾上腺素所导致的心脏质量和心脏质量/身长比率的增加几乎没有作用(图 1C、D)。

A:血浆雌激素水平;B:子宫质量;C:心脏质量;D:心脏质量/身长。*:P<0.05,与Sham组比较;#:P<0.05,与OVX+ISO+Vehi组比较。

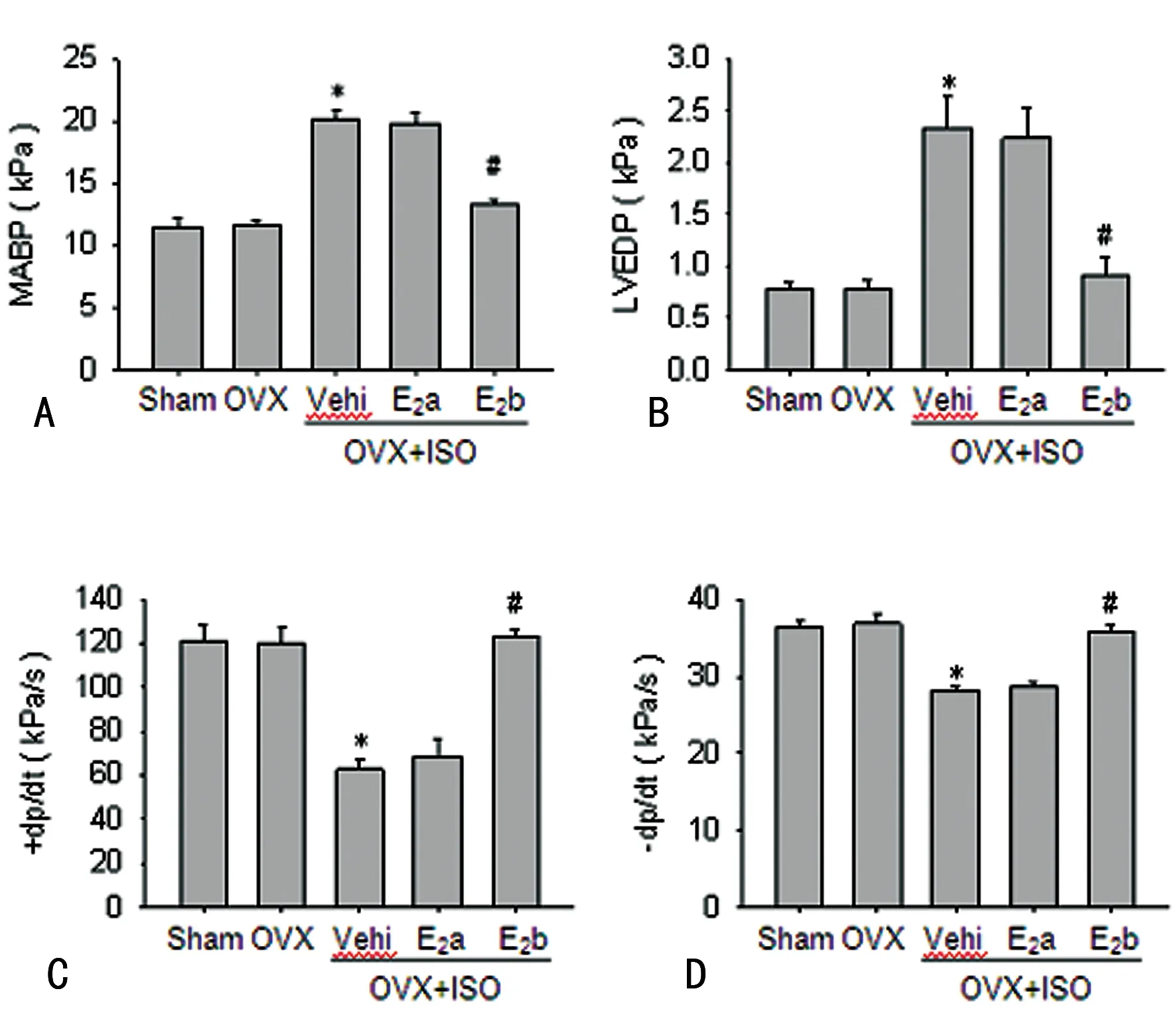
A:MABP水平;B:LVEDP水平;C:±dp/dt水平;D:-dp/dt水平。*:P<0.05,与sham组比较;#:P<0.05,与OVX+ISO+Vehi组比较。

2.2外源性雌激素替代治疗改善异丙肾上腺素造成的心肌收缩功能降低 经大鼠左侧颈总动脉置管,并逆行进入左心室记录各组大鼠的血流动力学指标。与Sham组和OVX组比较,OVX+ISO+Vehi组平均动脉血压(MABP)与左室舒张末压(LVEDP)明显升高(图 2A、B),但是±dp/dt显著降低(图2C、D)。而OVX+ISO+E2b组较OVX+ISO+Vehi组MABP与LVEDP明显降低(图 2A、B),±dp/dt升高(图2C、D)。但是OVX+ISO+Vehi组对于ISO所导致的MABP、LVEDP升高,±dp/dt降低几乎无作用(图 2A~D)。
2.3外源性雌激素替代治疗对单个心肌细胞的影响 通过倒置显微镜观察记录各组分离培养的单个成年大鼠心肌细胞,在体外经电刺激收缩搏动的影像。Sham组与OVX组单个心肌细胞横纹清晰、包膜完整,细胞长度与直径正常,而OVX+ISO+Vehi组心肌细胞明显肥大,不规则,细胞长度与直径明显增加,而OVX+ISO+E2b组心肌细胞形态明显改善,但OVX+ISO+E2a组心肌细胞形态恢复的极为有限。见图3。
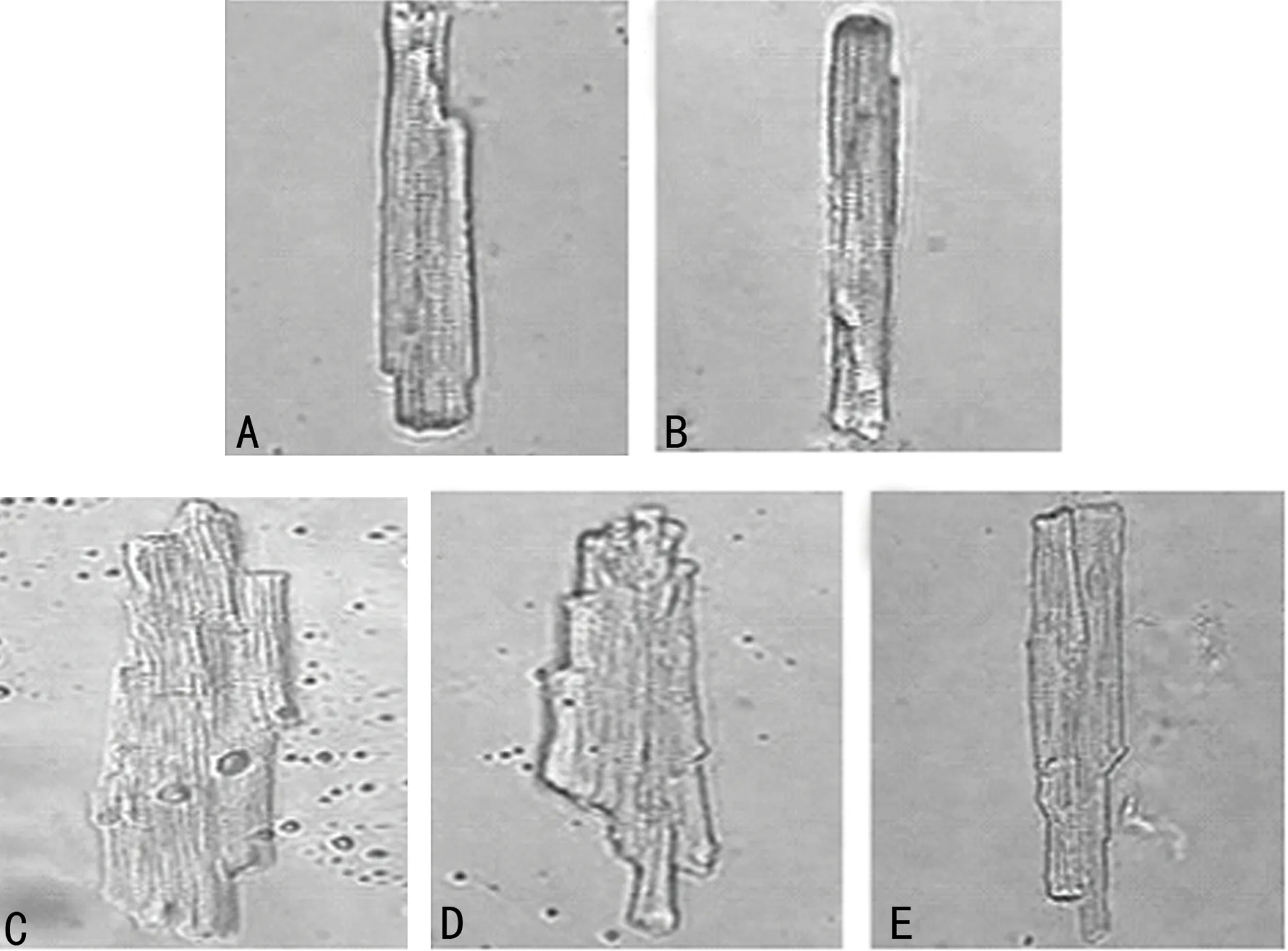
A:Sham组;B:OVX组;C:OVX+ISO+Vehi组;D:OVX+ISO+E2a组;E:OVX+ISO+E2b组。A、B、E放大倍数为400倍;C、D放大倍数为200倍。
图3各组大鼠单个心肌细胞光学显微镜观察
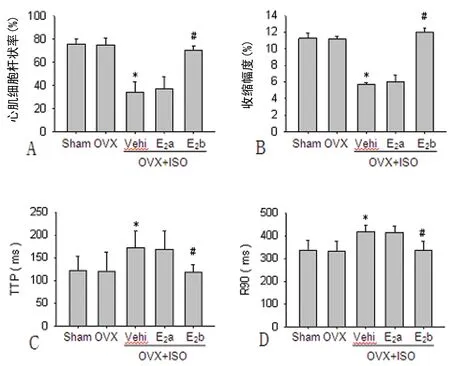
A:心肌细胞杆状率;B:收缩幅度;C:TTP;D:R90。*:P<0.05,与sham组间比较;#:P<0.05,与OVX+ISO+Vehi组间比较。

同时也发现,与Sham组或OVX组相比,OVX+ISO+Vehi组心肌细胞杆状率、收缩幅度明显降低(图 4A、B),TTP及R90明显延长(图 4C、D)。而OVX+ISO+E2b组相对于OVX+ISO+Vehi组心肌细胞的杆状率、收缩幅度显著增加(图 4A、B),而TTP与R90则明显下降(图 4C、D)。但是OVX+ISO+E2a组心肌细胞的这种恢复作用几乎没有(图 4A~D)。
2.4外源性雌激素替代治疗对心肌细胞凋亡的影响 分离培养的心肌细胞经Annexin V-PI双染色法标记,流式细胞仪检测细胞凋亡率(图 5A~E),与Sham组或OVX组相比,OVX+ISO+Vehi组心肌细胞凋亡率显著增加(图 5F),而OVX+ISO+E2b组相对于OVX+ISO+Vehi组心肌细胞凋亡率显著下降,但是OVX+ISO+E2a组心肌细胞凋亡率下降没有OVX+ISO+E2b组明显,且与OVX+ISO+Vehi组相比差异无统计学意义(P>0.05)(图 5F)。

A~E:双染色标记法;F:流式细胞仪检测细胞凋亡率。*:P<0.05,与sham组间比较;#:P<0.05,与OVX+ISO+Vehi组间比较。


A:Caspase 3表达;B:Bax表达;C:Bcl-2表达。*:P<0.05,与sham组间比较;#:P<0.05,与OVX+ISO+Vehi组间比较。

2.5外源性雌激素替代治疗对心肌细胞Caspase 3、Bcl-2、Bax表达的影响 利用Western blot分析心肌细胞中凋亡相关蛋白Caspase 3、Bcl-2、Bax的表达情况。与Sham组或OVX组相比,OVX+ISO+Vehi组心肌细胞Caspase 3、Bax表达显著增加(图 6A、B),而Bcl-2表达降低(图 6C)。与OVX+ISO+Vehi组比较,OVX+ISO+E2b组心肌细胞Caspase 3、Bax表达明显降低(图 6A、B),而Bcl-2表达增高(图 6C)。但是OVX+ISO+E2a组心肌细胞Caspase 3、Bcl-2、Bax的表达与OVX+ISO+Vehi组相比,差异无统计学意义(P>0.05)(图 6A~C)。
3 讨 论
绝经前女性心血管疾病的发病率较低,但更年期后这种优势明显降低,这表明雌性激素,尤其是雌激素在减少心血管疾病风险中起到举足轻重的作用[14]。而且,随着绝经后女性年龄的增长,其心血管疾病的发病风险也逐步增加,这与逐渐减少的血浆雌激素水平直接相关。而无论女性还是男性,雌激素均可改善血管舒张反应,降低缺血造成的心肌损伤[15]。所以,雌激素也许对心肌具有直接的保护作用。
在心肌损伤大鼠的离体心脏中,没有太多的证据可以表明心肌收缩功能的改变与细胞凋亡间的关系。而目前的研究表明,雌激素环境对心脏非常重要,在异丙肾上腺素刺激造成心肌损伤之后进行雌激素替代治疗,通过测量在体心脏MABP、LVEDP和±dp/dt,发现心脏收缩功能明显改善。而且通过维持卵巢切除后雌性大鼠的血浆雌激素水平,可以增加单个心室肌细胞收缩功能,减少心肌细胞凋亡蛋白的表达。同时验证了雌性大鼠卵巢切除动物模型血浆雌激素水平和子宫质量降低,是可以通过雌激素连续替代治疗得以恢复的。通过视频记录了分离培养的成年大鼠单个心室肌细胞受电刺激而收缩的动态图像,从中截取了照片观察心肌细胞形态改变,结果发现异丙肾上腺素连续大剂量刺激可引起心肌细胞肥大,长度与直径均有不同程度的增加,而收缩幅度与速率则明显降低。通过连续皮下注射雌激素后,心肌细胞的形态与功能均有不同程度的改善,尤以高剂量雌激素(40 μg·kg-1·d-1)替代治疗改善显著,而低剂量雌激素(4 μg·kg-1·d-1)的恢复效果不甚明显。这表明雌激素在40 μg·kg-1·d-1剂量可以明显改善异丙肾上腺素引起的心肌受损。
此外,本研究利用Annexin V-PI双染法标记分离培养的成年大鼠心肌细胞,经流式细胞仪分析发现,大剂量异丙肾上腺素连续刺激明显增加心肌细胞凋亡数量,但经雌激素40 μg·kg-1·d-1替代治疗4周后凋亡数量明显减少,而4 μg·kg-1·d-1作用不明显。心肌细胞凋亡是心肌损伤的主要原因之一[16]。有研究表明,Bcl-2家族蛋白在调节生理和病理性细胞凋亡中发挥关键作用,这些蛋白质包括促进细胞死亡的Bax、Bad和抑制细胞死亡的Bcl-2、Bcl-x等[17]。诱导和抑制细胞凋亡的蛋白相互作用,形成一个复杂的调控网络,而细胞的存活或者死亡的调控基于这个网络中促凋亡和抗凋亡蛋白的比率[18]。已经明确的是Bax/Bcl-2蛋白比率增高可以明显促进细胞凋亡[19]。本研究证实经雌激素40 μg·kg-1·d-1剂量持续4周的替代治疗可以上调Bcl-2,同时下调Bax的表达,而4 μg·kg-1·d-1的治疗剂量并没有明显作用。这些结果显示,雌激素替代治疗可以防治儿茶酚胺类激素过多而引起的心肌细胞凋亡,从而保护受损的心肌细胞。因此,作者认为补充雌激素可能是通过上调抗凋亡蛋白,下调促凋亡蛋白的表达而发挥心肌保护作用的。雌激素替代治疗调节Bcl-2和Bax蛋白的机制尚不清楚,雌激素调节细胞凋亡相关基因的机制亦不明确。但是雌激素替代治疗会引起许多抗氧化剂影响细胞凋亡基因的表达,所以,雌激素的抗氧化与抗脂质过氧化的作用可能是其主要机制[20]。
综上所述,雌激素替代治疗,尤其是40 μg·kg-1·d-1剂量,可以明显改善由于异丙肾上腺素刺激增加心肌细胞凋亡而造成的心肌损伤、心肌收缩功能下降。而且此浓度的雌激素替代治疗可能对卵巢功能不足而引起的心肌收缩功能降低起到保护作用。本研究还表明,增加Bcl-2蛋白、减少Bax蛋白的表达在雌激素心脏保护作用中起到了至关重要的作用。所以,适宜剂量的雌激素替代治疗对于儿茶酚胺类激素异丙肾上腺素增加造成的心肌细胞凋亡、心肌收缩功能降低具有明显的保护作用。
[1]Dubey RK,Imthurn B,Zacharia LC,et al.Hormone replacement therapy and cardiovascular disease:what went wrong and where do we go from here[J].Hypertension,2004,44(6):789-795.
[2]Regitz-Zagrosek V.Therapeutic implications of the gender-specific aspects of cardiovascular disease[J].Nat Rev Drug Discov,2006,5(5):425-438.
[3]Khalil RA.Estrogen,vascular estrogen receptor and hormone therapy in postmenopausal vascular disease[J].Biochem Pharmacol,2013,86(12):1627-1642.
[4]Le TY,Ashton AW,Mardini M,et al.Role of androgens in sex differences in cardiac damage during myocardial infarction[J].Endocrinology,2014,155(2):568-575.
[5]Brooks WW,Conrad CH.Isoproterenol-induced myocardial injury and diastolic dysfunction in mice:structural and functional correlates[J].Comp Med,2009,59(4):339-343.
[6]Zhuo XZ,Wu Y,Ni YJ,et al.Isoproterenol instigates cardiomyocyte apoptosis and heart failure via AMPK inactivation-mediated endoplasmic reticulum stress[J].Apoptosis,2013,18(7):800-810.
[7]Sun H,Zhou F,Wang Y,et al.Effects of beta-adrenoceptors overexpression on cell survival are mediated by Bax/Bcl-2 pathway in rat cardiac myocytes[J].Pharmacology,2006,78(2):98-104.
[8]Dong JW,Zhu HF,Zhu WZ,et al.Intermittent hypoxia attenuates ischemia/reperfusion induced apoptosis in cardiac myocytes via regulating Bcl-2/Bax expression[J].Cell Res,2003,13(5):385-391.
[9]Sahu BD,Anubolu H,Koneru M,et al.Cardioprotective effect of embelin on isoproterenol-induced myocardial injury in rats:possible involvement of mitochondrial dysfunction and apoptosis[J].Life Sci,2014,107(1/2):59-67.
[10]Fan Y,Wang C,Zhang Y,et al.Genistein ameliorates adverse cardiac effects induced by Arsenic trioxide through preventing cardiomyocytes apoptosis[J].Cell Physiol Biochem,2013,31(1):80-91.
[11]Wu Q,Zhao Z,Sun H,et al.Oestrogen changed cardiomyocyte contraction and beta-adrenoceptor expression in rat hearts subjected to ischaemia-reperfusion[J].Exp Physiol,2008,93(9):1034-1043.
[12]Jiang X,Gao L,Zhang Y,et al.A comparison of the effects of ketamine,chloral hydrate and pentobarbital Sodium anesthesia on isolated rat hearts and cardiomyocytes[J].J Cardiovasc Med (Hagerstown),
2011,12(10):732-735.
[13]孙红,常爱民,张洋,等.增加β1-肾上腺素受体表达对心力衰竭大鼠心肌细胞收缩功能的影响[J].南京医科大学学报:自然科学版,2007,27(12):1398-1402.
[14]Renoux C,Dell′aniello S,Suissa S.Hormone replacement therapy and the risk of venous thromboembolism:a population-based study[J].J Thromb Haemost,2010,8(5):979-986.
[15]Emre A,Sahin S,Erzik C,et al.Effect of hormone replacement therapy on plasma lipoproteins and apolipoproteins,endothelial function and myocardial perfusion in postmenopausal women with estrogen receptor-alpha IVS1-397 C/C genotype and established coronary artery disease[J].Cardiology,2006,106(1):44-50.
[16]Chen HM,Hsu JH,Liou SF,et al.Baicalein,an active component of Scutellaria baicalensis Georgi,prevents lysophosphatidylcholine-inducedcardiac injury by reducing reactive oxygen species production,calcium overload and apoptosis via MAPKpathways[J].BMC Complement Altern Med,2014,14:233.
[17]Huang C,Gu H,Zhang W,et al.Testosterone-down-regulated Akt pathway during cardiac ischemia/reperfusion:a mechanism involving BAD,Bcl-2 and FOXO3a[J].J Surg Res,2010,164(1):e1-11.
[18]Penna C,Pasqua T,Amelio D,et al.Catestatin increases the expression of anti-apoptotic and pro-angiogenetic factors in the post-ischemic hypertrophied heart of SHR[J].PLoS One,2014,9(8):e102536.
[19]Zhang Y,Li H,Zhao G,et al.Hydrogen sulfide attenuates the recruitment of CD11b+Gr-1+ myeloid cells and regulates Bax/Bcl-2 signaling in myocardial ischemia injury[J].Sci Rep,2014,4:4774.
[20]Wang F,Xiao J,Shen Y,et al.Estrogen protects cardiomyocytes against lipopolysaccharide by inhibiting autophagy[J].Mol Med Rep,2014,10(3):1509-1512.
