烯丙基山梨醇凝胶因子的合成及凝胶性能研究
2014-02-05孙海军段元超
孙海军,宋 健,段元超
(天津大学化工学院,天津 300072)
低相对分子质量有机凝胶因子(Low Relative Molecular Mass Organic Gelators)是指在相对较低质量分数下(一般小于3%)使一些有机溶剂凝胶化的小分子有机化合物[1-3]。在其所形成的凝胶中,LMOG分子通过氢键、π-π键、疏水键、范德华力等非共价键作用,自聚形成杆状、带状、纤维状结构,进而形成三维网状结构而成凝胶[4-5]。低相对分子质量有机凝胶因子有着广泛的应用价值:制备化学传感器、手性无机材料、固体燃料与电解质、液晶材料、介孔材料、增稠触变剂等,以及在药物缓释、色谱分离方面的应用[6-10]。
山梨醇缩醛化合物大量用于聚丙烯成核剂,也可用作有机凝胶因子。20世纪90年代,Yamasaki等[11]仅对 1,3∶2,4-二(苄叉)-D-山梨醇的凝胶性能进行了研究,研究了 1,3∶2,4-二苄叉-D-山梨醇(DBS)及 1,3∶2,4-三苄叉-D-山梨醇(TBS)在乙二醇(EG)中的凝胶行为,指出由于5,6-O卞基对1,3-及2,4-苄基的作用,使得 TBS-EG的凝胶性能弱于DBS-EG的凝胶性能.宋健等[12-13]合成了 1,3∶2,4-二(对甲基苄叉)-D-山梨醇(MDBS)等一系列山梨醇缩醛类凝胶因子,通过研究发现苯环上取代基的位置、数量、大小等都对凝胶性能有影响.但目前对山梨醇缩醛类其他衍生物的合成及凝胶性能研究较少。
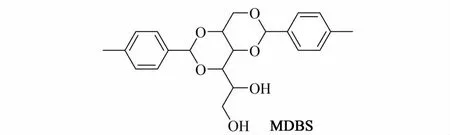
本研究在MDBS基础上进行分子修饰,合成了4种烯丙基山梨醇缩醛,对其在多种具有代表性的有机溶剂中的凝胶性能进行了测定。比较了烯丙基的引入及苯环上取代基位置对其凝胶性能的影响,测定了它们在几种溶剂中的最低凝胶浓度,并通过紫外光谱及SEM研究了其凝胶形成过程中自组装机理,为山梨醇缩醛衍生物分子设计,以及超分子化学、分子自组装行为等理论研究进行了有益探索。
1 实验部分
1.1 试剂及仪器
D-葡萄糖、烯丙基溴、锡粉、苯甲醛、邻甲基苯甲醛、间甲基苯甲醛、对甲基苯甲醛、3,4-二甲基苯甲醛、对异丁基苯甲醛、对异丙基苯甲醛、对甲氧基苯甲醛均为市售CP试剂,氮气为高纯氮气,十二烷基苯磺酸,其他溶剂均为市售AR试剂。
AVANCE III型液体共振核磁谱仪,S-4800型场发射电子扫描显微镜,Carry50紫外-可见分光光度计。
1.2 反应方程式
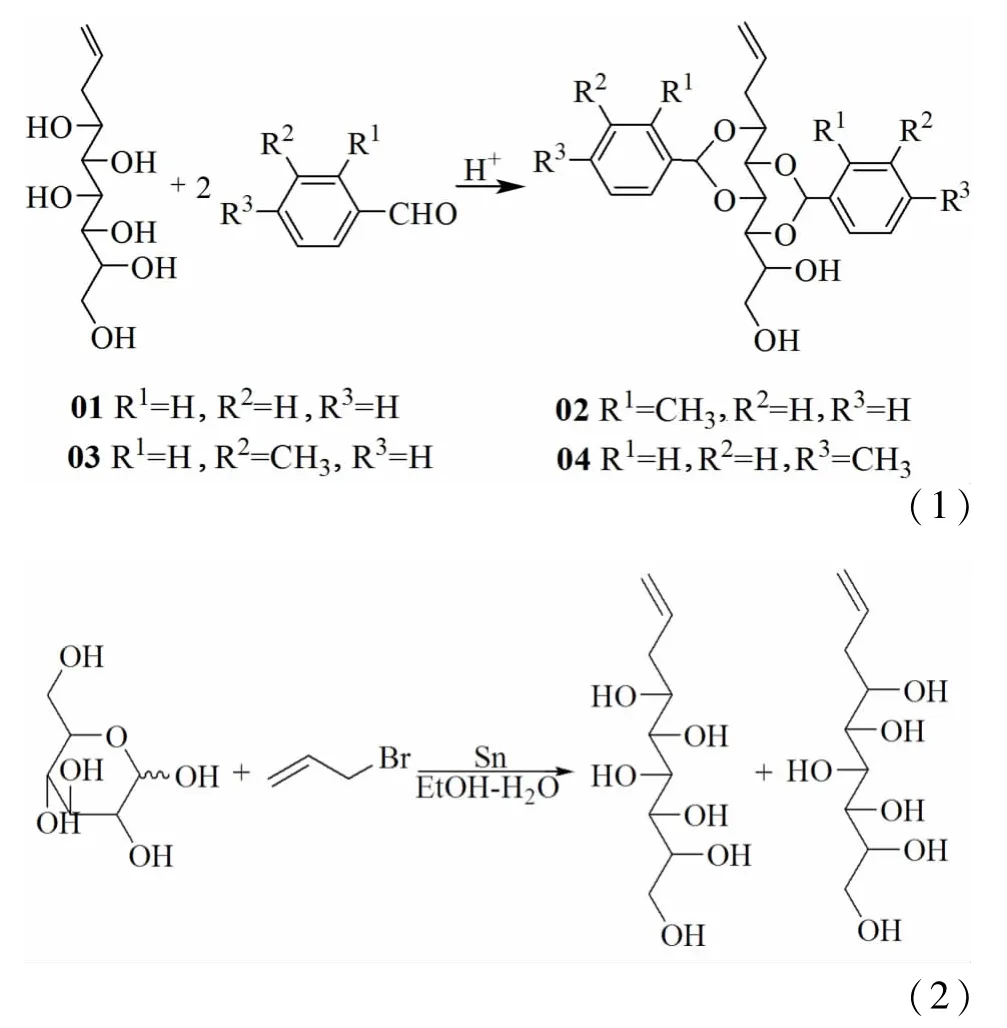
以D-葡萄糖、烯丙基溴为原料,锡粉为催化剂,在醇水混合溶解中经烯丙基化反应制备1-烯丙基山梨醇,其反应方程式如(1)。
以合成的1-烯丙基山梨醇及取代的芳香醛为主要原料合成了烯丙基山梨醇缩醛化合物,其反应方程式如(2)。
1.3 反应步骤
1.3.1 1-烯丙基山梨醇的制备
向装有机械搅拌、温度计、回流装置及氮气保护装置的250 m L四口瓶中加入90 m L无水乙醇,搅拌下依次加入 18.00 g(0.10 mol)D-葡萄糖,23.80 g 200目锡粉(0.20 mol),15 m L蒸馏水,搅拌30 min左右后加入10.00 g(0.080 mol)烯丙基溴,氮气保护下缓慢升温至60℃,反应1.5 h。6.0 h内分3次加入剩余30.00 g(0.25 mol)烯丙基溴,保温反应20~24 h。
反应结束后静置冷却,加约2~3倍体积的蒸馏水稀释后用氢氧化钠溶液调节至pH值约为1.0~1.5后,过滤后取滤液继续调节pH值至3.0左右,过滤后滤液继续调节pH值至7.0,旋蒸至黏稠液,加入适量乙醇溶解,过滤,将滤液旋蒸后得粗产品1-烯丙基山梨醇。粗产品不经进一步提纯,直接用于下步反应。
1.3.2 烯丙基山梨醇缩醛的制备
向装有机械搅拌、回流装置及温度计的三口烧瓶中依次加入15 m L甲醇,4.44 g(0.02 mol)烯丙基山梨醇及0.19 g(0.001 mol)对甲苯磺酸,待固体全部溶解后加入0.03 mol取代苯甲醛,室温反应12.0 h。反应结束后,将反应液中加入30 m L水,搅拌30 min后过滤。将滤饼分别用乙酸乙酯和碳酸钠溶液洗涤至中性,烘干得产品。
各化合物核磁数据如下。
1-烯丙基-1,3∶2,4-二(苄叉)-D-山梨醇(A01):1H-NMR(500 MHz,DMSO-d6):δ7.50~7.33(m,10 H,Ar-H),5.93 ~5.85(m,1H,CH=),5.58(s,1H,OCHO),5.63(s,1H,OCHO),5.19~5.08(m,2H,OH),4.12~4.08(m,2H,=CH2),3.84~3.35(m,7H,CH,CH2),2.54~2.45(d,2H,CH2)。
1-烯丙基-1,3∶2,4-二(邻甲基苄叉)-D-山梨醇(A02):1H-NMR(500 MHz,DMSO-d6): δ7.52 ~7.15(m,8H,Ar-H),5.88~5.80(m,1H,CH=),5.75(s,1H,OCHO),5.71(s,1H,OCHO),5.13~5.04(m,2H,=CH2),4.73~4.72(m,1H,OH),4.37(m,1H,OH),4.10~3.32(m,7H,CH,CH2),2.49~2.29(d,8H,CH2,CH3)。
1-烯丙基-1,3∶2,4-二(间甲基苄叉)-D-山梨醇(A03):1H-NMR(500 MHz,DMSO-d6): δ7.30 ~7.15(m,8H,Ar-H),5.90~5.83(m,1H,CH=),5.62(s,1H,OCHO),5.58(s,1H,OCHO),5.17~5.07(m,2H,=CH2),4.83~4.79(d,2H,OH),4.07~3.34(m,7H,CH,CH2),2.49~2.29(d,8H,CH2,CH3)。
1-烯丙基-1,3∶2,4-二(对甲基苄叉)-D-山梨醇(A04):1H-NMR(500MHz,DMSO-d6): δ7.34 ~7.15(m,8H,Ar-H),5.90~5.83(m,1H,CH=),5.62(s,1H,OCHO),5.58(s,1H,OCHO),5.17~5.07(m,2H,=CH2),4.83~4.79(d,2H,OH),4.07~3.34(m,7H,CH,CH2),2.49~2.29(d,6H,CH3)。
1.4 凝胶性能测试
在具塞试管中称取一定量的凝胶因子和溶剂,酒精灯加热至固体物质全部溶解,静置数小时后,检测凝胶是否形成。将试管倒置,如果试管没有液体流动,则判断凝胶已经形成。
2 结果与讨论
2.1 烯丙基山梨醇缩醛化合物凝胶性能的测定结果
将4种烯丙基山梨醇缩醛凝胶因子及MDBS对30种溶剂进行凝胶性能的测试,凝胶因子的质量分数为2%(下同),结果见表1。
由表1可知,烯丙基山梨醇缩醛具有非常优良的凝胶性能,这4种凝胶因子能凝胶的溶剂主要是芳香族化合物、醇类化合物以及长碳链烷烃溶剂。一方面在这些溶剂中凝胶因子有适当的溶解度,溶剂与凝胶因子之间作用力不足以破环凝胶因子间自组装驱动力;另一方面,烯丙基双键的引入会促进凝胶弱驱动力π-π堆积作用,而醇类溶剂则有助于凝胶作用力氢键的形成。低碳链烷烃溶剂因其对凝胶因子溶解能力达不到形成凝胶所需的最低凝胶浓度,所以凝胶性能较差,而对长碳链烷烃有一定凝胶性能。对凝胶因子溶解度大的溶剂如DMSO、DMF等也未能形成凝胶。
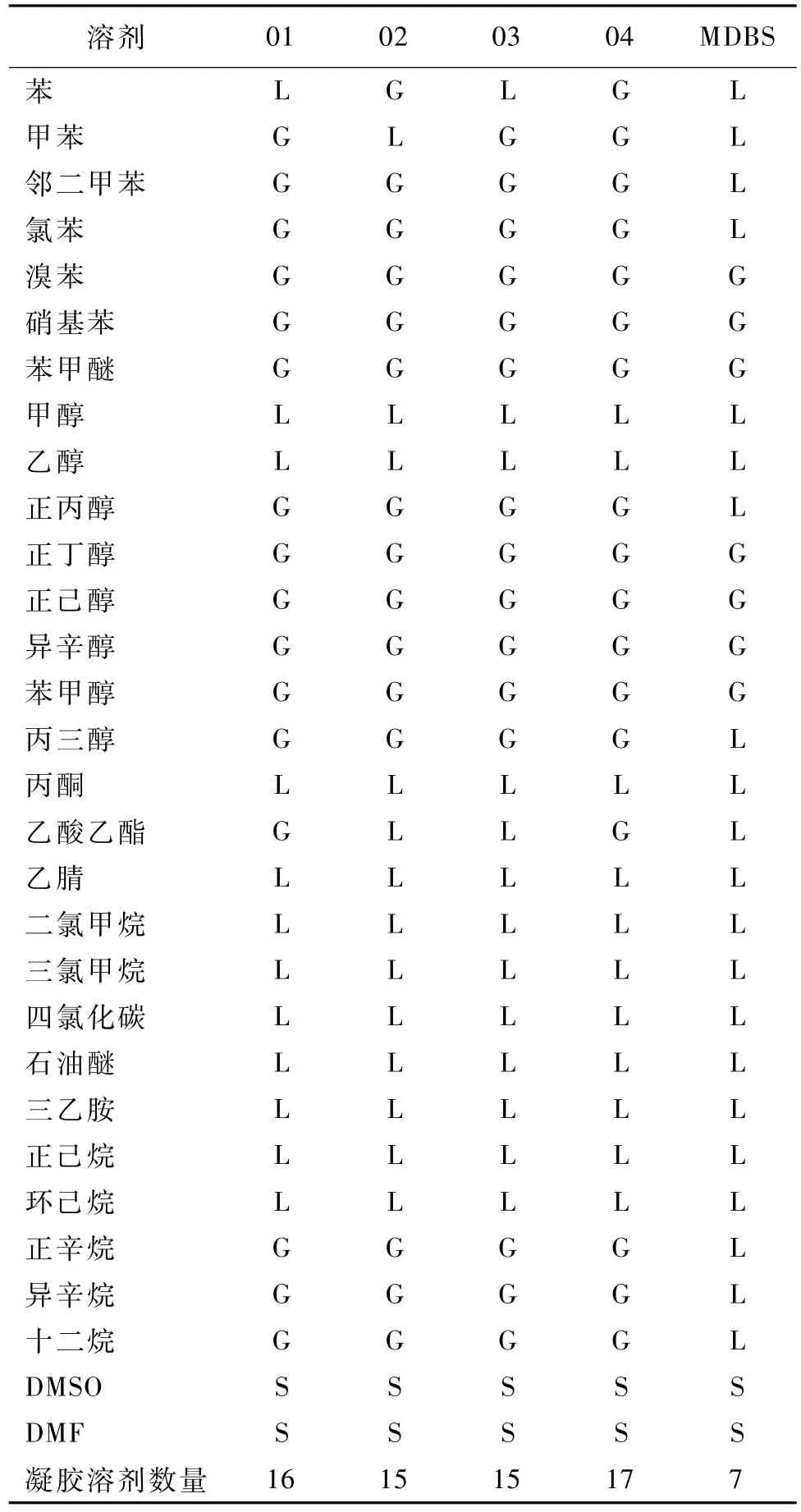
表1 不同苯环取代基的烯丙基山梨醇化合物凝胶性能Table 1 Gel p roperties of d ifferent allyl benzene substituents sorbitol com pounds
以化合物04及MDBS为例比较了山梨醇缩醛化合物和烯丙基山梨醇缩醛化合物在凝胶性能上的差异。结果表明:1)对芳香族溶剂,烯丙基山梨醇缩醛化合物凝胶性能好于山梨醇缩醛化合物,表明在该类溶剂中,烯丙基团双键的引入促进了凝胶的形成。这可归因为双键的引入促进了溶剂与凝胶因子间π-π堆积作用。2)在凝胶长链的烷烃溶剂时,烯丙基山梨醇缩醛化合物的性能明显优于山梨醇缩醛化合物。说明母体上烯丙基的加入增加了凝胶形成过程中的分子组装的作用力(疏水作用力),使凝胶形成较为容易,同时也说明了在凝胶的形成过程中溶剂分子参与凝胶的形成。
2.2 最低凝胶浓度的测定
实验测试了化合物01、02、03和04在一元直链醇类溶剂中的最低凝胶浓度,最低凝胶浓度随溶剂分子中碳原子个数的变化曲线如图1所示。

图1 凝胶因子最低凝胶浓度随直链一元醇碳链长度的变化Fig.1 The change of gelator m inim um concentration with carbon chain length of straight chain m onohyd ric alcohol
由图1可得,化合物01、02、03在醇类溶剂中的最低凝胶浓度随溶剂分子中碳原子的个数的增加而减少,即凝胶因子的凝胶能力增强,而碳原子数大于6后最低凝胶浓度基本不变。这是因为溶剂分子中所含的碳原子数越多,所能提供的疏水作用力越大,凝胶因子在自组装时的驱动力越大,致使所需的凝胶浓度越低,在碳原子数达到6后疏水作用力继续增大破坏了亲水-疏水平衡。而凝胶的形成是一个复杂的过程,在这个过程中存在多种影响因素的叠加,化合物04与此规律恰好相反,可以解释为溶剂亲疏水作用的影响弱于其他影响因素,具体影响因素有待后续研究。
2.3 凝胶机理
2.3.1 紫外-可见吸收光谱
根据Kasha规则,紫外吸收光谱可以反映出分子间的相互作用情况。图2为凝胶因子01所测得的紫外-可见吸收光谱图,a为凝胶因子01在正己醇稀溶液中的吸收曲线,其吸收峰在231 nm,b为正己醇凝胶的吸收曲线,其吸收峰红移至269 nm,说明分子间发生了 π-π堆积形成了 J聚体。这一结果表明分子间π-π相互作用是凝胶形成的驱动力之一。
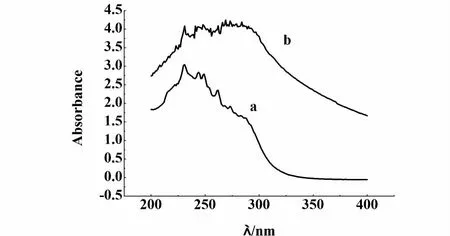
图2 凝胶因子01的紫外-可见吸收光谱Fig.2 UV-VIS absorption spectra of gelator 01
2.3.2 凝胶的微观结构
为了考察凝胶因子在凝胶中的聚集态结构,通过SEM考察了凝胶因子01、02、03、04在正己醇中的聚集形貌,如图3所示,凝胶因子质量分数均为1%。图3a)和图3d)为凝胶因子01和04在正己醇中干凝胶的形貌凝胶因子形成的纤维全部胶连在一起形成三维网状结构。图3b)和图3c)为凝胶因子03在正己醇中干凝胶的形貌。可以看出,凝胶因子形成比较粗的纤维,在溶剂中散乱罗列。由此可以说明凝胶因子的分子结构不同会造成凝胶的性质的差异,且凝胶因子分子结构上的对称性更加有利于凝胶网状结构的形成。

图3 干凝胶SEM谱图Fig.3 SEM im ages of xerogels
3 结论
设计合成了一系列烯丙基山梨醇凝胶因子,并系统考察了凝胶因子对常见溶剂的凝胶能力,以及部分凝胶因子在不同溶剂的最低凝胶浓度,并通过凝胶因子之间的作用力、分子的几何构型及亲疏水作用等方面研究了凝胶因子在溶剂中的自组装及凝胶机理。结果表明,凝胶因子的凝胶能力依赖于凝胶因子的分子结构,烯丙基的引入显著提高了凝胶因子的凝胶能力。紫外吸收光谱表明分子间π-π相互作用是凝胶形成的驱动力之一。场发射扫描电镜表明凝胶呈纤维状和三维网状微观结构,且分子结构的差异会造成凝胶纤维排列的不同。
[1]George M,Weiss R G.Molecular organogels,softmatter comprised of low-molecular-mass organic gelators and organic liquids[J].Accounts of Chemical Research,2006,39(8):489-497
[2]Bhattacharya S,Acharya S N G.Impressive gelation in organic solvents by synthetic,low molecular mass,selforganizing urethane amides of L-phenylalanine[J].Chem istry of Materials,1999,(11):3 121-3 132
[3]Xue M,Liu K,Peng J,et al.Novel dimeric cholesteryl-based A(LS)2low-molecular-mass gelators with a benzene ring in the linker[J].Journal of Colloid and Interface Science.2008,(327):94-101
[4]Chen L,Wu J,Yuwen L,et al.Inclusion of tetracycline hydrochloride within supramolecular gels and its controlled release to bovine serum albumin[J].Langmuir,2009,25(15):8 434-8 438
[5]Zhang X,Deng P,Feng R,et al.Novel gelatinous shape-stabilized phase change materials with high heat storage density[J].Solar Energy Materials&Solar Cells,2011,(95):1 213-1 218
[6]George M,Weiss R G.Urea and thiourea derivatives as low molecular-mass organogelators[J].European Journal of Chemistry,2005,11(11):3 243-3 254
[7]Sun S,Song J,Feng R,et al.Ionic liquid gel electrolytes for quasi-solid-state dye-sensitized solar cells[J].Electrochimica Acta,2012,(69):51-55
[8]Clegg R S,Hutchison J E.Hydrogen-Bonding,self-assembled monolayers:Ordered molecular films for study of through-peptide electron transfer[J].Langmuir,1996,22(12):5 239-5 243
[9]Chen Q,Wu L,Sun W,et al.Synthesis and gelation behavior of a novel bithiazole based low-molecular-mass organic gelator[J].Journal of Chemical Engineering of Chinese Universities,2010,24(4):688-693
[10]George M,Tan G,John V T,et al.Urea and thiourea derivatives as low molecular-mass organogelators[J].Chemistry-A European Journal,2005(11):3 243-3 254
[11]Yamasaki S,Tsutsumi H.The thermal behavior of 1,3∶2,4-Di-O-benzylidene-D-sorbitol/ethylene glycol gel,Bull[J].Chem Soc Jpn,1996,69(3):561-564
[12]Song J,Cheng Q,Kopta S,et al.Modulating artificial membranemorphology:pH-induced chromatic transition and nanostructural transformation of a bolaamphiphilic conjugated polymer from blue helical ribbons to red nanofibers[J].J Am Chem Soc,2001,123(14):3 205-3 213
[13]Feng R,Chen L,Hou Z,et al.Synthesis of dibenzylidene sorbitol series compound[J].Transactions of Tianjin University,2007,13(1):35-41
