草鱼鱼鳞胶原蛋白肽的制备及分析
2014-01-31鉏晓艳熊光权李新耿胜荣于巍江洪有廖涛
鉏晓艳,熊光权,李新,耿胜荣,于巍,江洪有,廖涛
(湖北省农业科技创新中心/湖北省农业科学院农产品加工与核农技术研究所/湖北省农产品辐照工程技术中心,湖北武汉430064)
我国是世界上最大的淡水鱼养殖国,随着淡水鱼类加工业的快速发展,加工过程中产生大量的废弃物,如鱼鳞。通常鱼鳞加工利用程度很低,绝大部分被直接丢弃,不仅严重污染了环境,而且造成了资源的浪费。其实,鱼鳞富含胶原蛋白,从中提取胶原蛋白肽不仅能够充分利用资源,提高鱼类加工的附加值,而且可以减少环境污染,对促进鱼类加工业的良性发展具有重要意义。
胶原蛋白,是结缔组织中极其重要的一种结构蛋白,是动物体内含量最多、分布最广的蛋白质,约占体内蛋白质总量的25%~30%[1]。胶原蛋白分子量很大需经过生物技术降解至分子量到500 D~2500D 范围,人体才能有效吸收[2]。目前,国内鱼鳞胶原蛋白肽的开发尚处于起步阶段,相关研究主要集中在胶原蛋白肽的提取工艺和提取方法等方面。胶原蛋白肽的提取和降解,依据提取介质的不同可以分为3 种:即热水提取[3-4]、酸法提取[5]、碱法提取[6]等。此外,还有酸、碱结合热水提取等。上述方法普遍存在提取周期长,提取率不高,以及酸、碱等废液排放对环境造成影响等问题。因此,本研究旨在利用淡水鱼副产品-鱼鳞,通过优化酶解提取过程,减少酸碱使用量,制备小分子胶原蛋白肽产品,并获得其相关性状指标。
1 材料与方法
1.1 材料
1.1.1 原料
草鱼鱼鳞由武汉市武商量贩提供。
1.1.2 试剂
木瓜蛋白酶(sigma 分装,酶活0.1 kat/g),蛋白质标样(分子量为10 ku~100 ku)购自德国Thermo Scientific公司,其他试剂为国药分析纯。
1.1.3 主要仪器与设备
微量移液器:德国eppendorf;DYCZ-24DN 型双垂直电泳槽、DYY-6C 稳压稳流电源:北京六一;氨基酸自动分析仪:日立L-8800;2695 型凝胶渗透色谱仪:美国waters。
1.2 方法
1.2.1 鱼鳞胶原蛋白肽的提取工艺
草鱼鱼鳞→清洗阴干→脱杂蛋白→脱钙→酶解→脱腥脱苦→分级纳滤→冷冻干燥→胶原蛋白肽干粉
1.2.2 草鱼鱼鳞的脱钙与羟脯氨酸溶出率的测定
准确称取1.0 g 脱杂清洗烘干的鱼鳞于250 mL 锥形瓶中,平行3 份,以1 ∶60(g/mL)料液比分别加入0.6 mol/L 醋酸溶液、0.6 mol/L 盐酸溶液、0.6 mol/L 柠檬酸溶液,放在摇床上25 ℃恒温脱钙24 h,摇床转速150 r/min。脱钙充分后,参考GB-T 5009.92-2003《食品中钙的测定》[8]的方法测定溶液中的钙含量,并按如下公式计算脱钙率:法进行计算。脱钙充分后,羟脯氨酸按照GB/T 9695.23-2008《肉与肉制品羟脯氨酸含量测定》[9]中的方法进行测定,得到溶液中溶出的羟脯氨酸含量(μg/mL)。

1.2.3 草鱼鱼鳞酶解条件的优化
为了获得酶解最佳条件,我们设计了5 因素4 水平的正交试验。分别为酶解温度(℃)50、55、60、65;酶添加量(%,质量分数)2、4、6、8;酶解时间(h)1、2、3、4;pH5、5.5、6、6.5;料液比1 ∶10、1 ∶20、1 ∶30、1 ∶40。取2 g鱼鳞,按表1 进行处理。得到的酶解液根据甲醛滴定法[10]进行水解度的测定。

1.2.4 草鱼鱼鳞胶原蛋白肽的分子量测定
我们采用Tricine-SDS-PAGE 凝胶电泳法[11-12],对得到的胶原蛋白肽的分子量范围进行测定。采用垂直板式电泳槽,12%的分离胶与4%浓缩胶,标准蛋白质加样量为10 μL,待测样加样量为20 μL。先在60 mV的电压下电泳,待样品进入分离胶后,再将电压调整至100 mV 左右,当溴酚兰指示带接近胶底1 cm 时,停止电泳。小心将凝胶取下,用5%戊二醛固定1 h,置于染色容器中染色5 h~6 h,再用脱色液脱色1 h。
为进一步明确其分子量,我们用凝胶渗透色谱法[13]具体测定了获得的胶原蛋白肽的分子量。配制1 000 mL的0.1 mol/L 磷酸氢二钠溶液,其中含8 g 叠氮化钠,用磷酸二氢钠调节pH 至8.0,取500 mL 作为储备液。另取500 mL 储备液稀释至2 000 mL 作为淋洗液。进样量为100 μL,溶剂为水-0.2M 硝酸钠,淋洗液流速为0.6 mL/min。标样为聚乙烯乙二醇,柱子温度40 ℃,检测器温度40 ℃。
1.2.5 草鱼鱼鳞胶原蛋白肽氨基酸测定
根据GB/T 5009.124-2003《食品中氨基酸的测定》[14]方法进行鱼鳞胶原蛋白肽的前处理,自动氨基酸分析仪测定其水解氨基酸种类及含量。
2 结果与分析
2.1 不同试剂对鱼鳞脱钙效果及羟脯氨酸溶出率的影响
不同试剂对鱼鳞脱钙效果及羟脯氨酸溶出率的影响见图1。
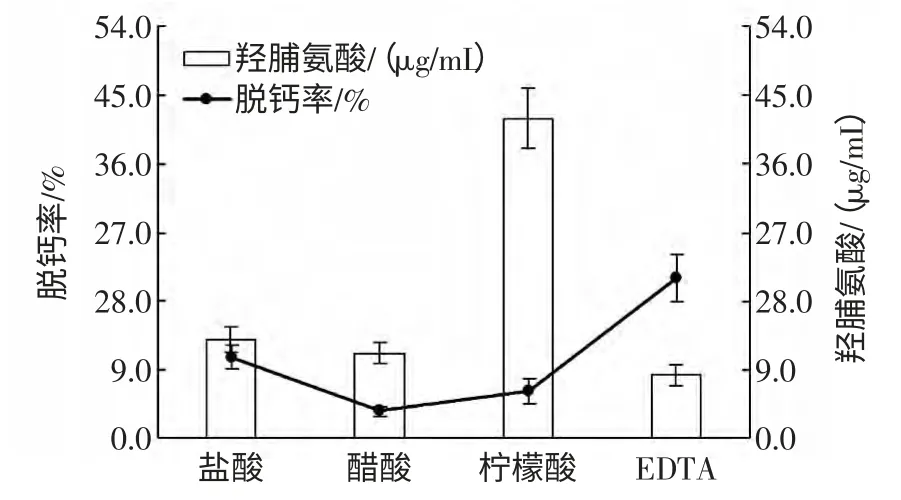
图1 不同试剂处理鱼鳞的脱钙率及羟脯氨酸溶出率Fig.1 Effect of different reagents on decalcification rate and hydroxyproline dissolution rate of fish scales
由图1 结果可知,3 种酸比较,盐酸脱钙效果最好,柠檬酸次之,醋酸再次之。但是此结果与EDTA 二钠的脱钙结果相比,没有优势。醋酸和柠檬酸的脱钙效果较差,不适合工业生产。另一方发面,羟脯氨酸是鱼鳞胶原蛋白肽中的特征氨基酸,它在上清液中的浓度表征胶原蛋白的溶出及损失。图1 结果显示,柠檬酸处理鱼鳞后,上清液中羟脯氨酸浓度最高,即胶原蛋白损失最多。醋酸处理的鱼鳞虽然溶液中羟脯氨酸浓度较低,胶原蛋白损失较少,但其脱钙效果差,所以不适用于生产。就实验结果而言,使用EDTA 二钠处理鱼鳞,不但脱钙效果最好,且上清液种羟脯氨酸浓度较低,说明处理过程中胶原蛋白损失较少,是较好的脱钙试剂。
2.2 草鱼鱼鳞酶解条件的优化(5 因素4 水平正交试验)
草鱼鱼鳞酶解条件优化结果见表1。
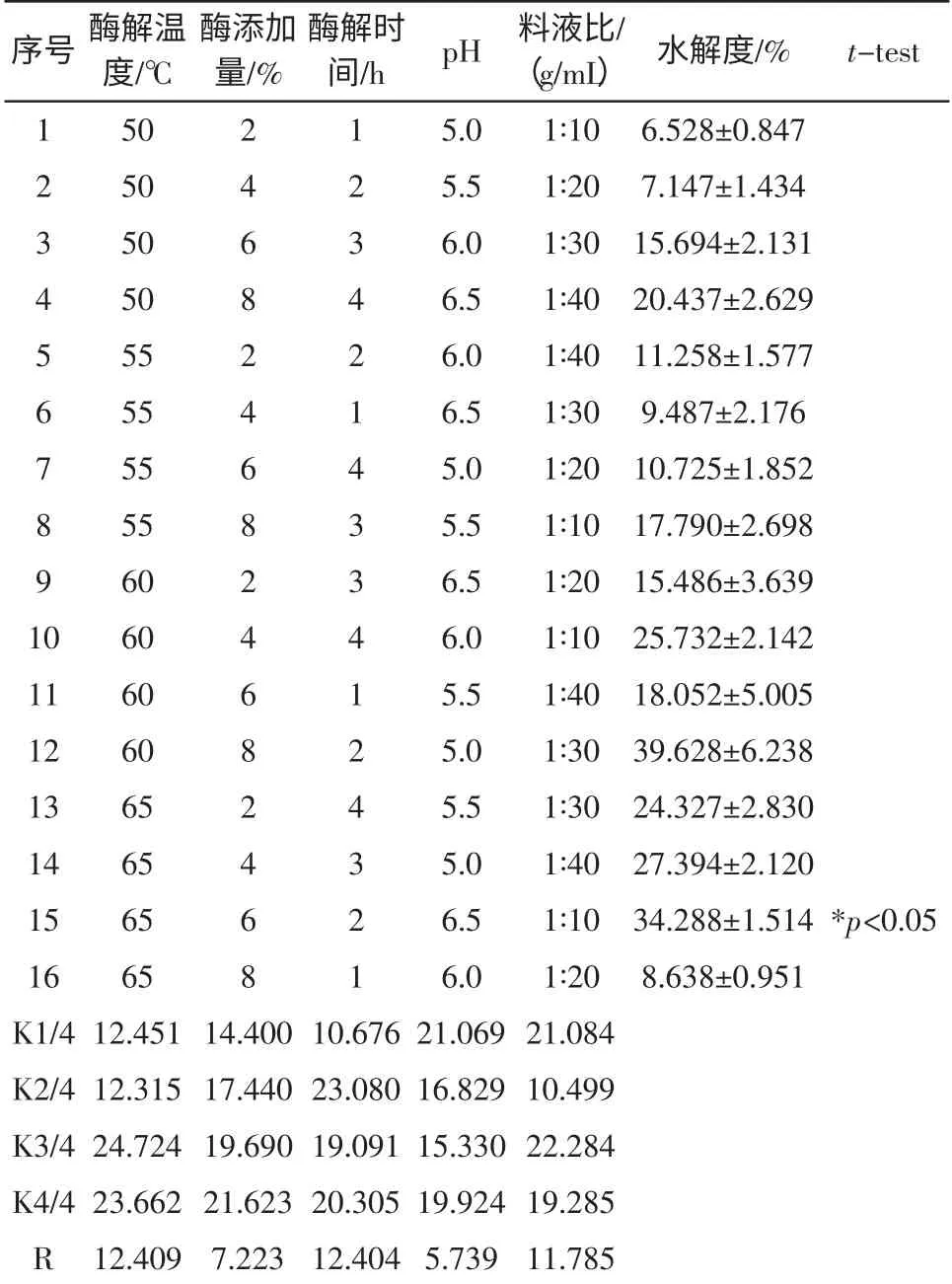
表1 酶解正交试验L16(54)及结果Table 1 Orthogonal experiment L16(54)of enzymolysis and results
根据表1 水解度和K 值结果,酶解温度60 ℃、酶添加量8%、酶解时间2 h、pH 5.0、料液比1 ∶30(g/mL)时,水解度最高。R 值结果显示,酶解温度、酶解时间、料液比是影响酶解效果的主要因素,酶添加量和pH为次要因素。此外,对水解度较高的三组数据进行了t-test 成对检验,结果表明,实验15 的处理结果与优于实验10 的处理结果,差异显著(p<0.05)。实验12 的处理结果虽然平均值较高,但与实验15 和实验10 的结果相比,无显著性差异,可能由于其本身结果偏差较大的缘故。
2.3 草鱼鱼鳞胶原蛋白肽分子量的测定
胶原蛋白肽分子量结果见图2~图3 和表2。
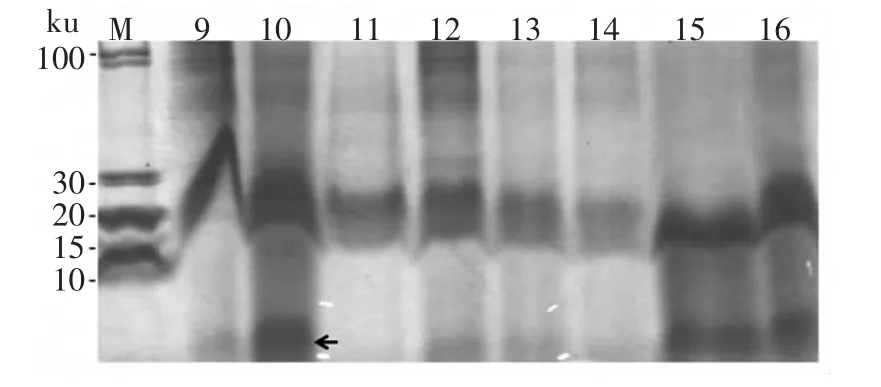
图2 正交试验中实验9-15 所得酶解液的Tricine-SDS-Page电泳结果Fig.2 Tricine-SDS-Page electrophoresis results of enzymatic hydrolyzates of test 9-15 in Orthogonal experiment L16(54)

图3 凝胶渗透色谱的测定结果Fig.3 Results from Gel permeation chromatography measurement

表2 草鱼鱼鳞胶原蛋白肽的分子量结果Table 2 Molecular weight of fish scale collagen peptide from Grass carp
我们对正交实验(表1)中所得到的胶原蛋白肽进行了Tricine-SDS-Page 电泳,其中实验9-16 的电泳结果见图2,结果表明,有基团较小的蛋白质条带出现(图2 箭头处),其分子量远低于10 ku。为了进一步明确这个蛋白质基团的分子量,我们用凝胶渗透色谱进行具了体测定,表2 结果显示,酶解后粉末中主要是这种小分子蛋白,分散度小、分子量均一,其峰值分子量和数匀分子量均低于500 u。图3(横坐标为出峰时间,纵坐标为电信号值表征出峰强度)结果显示,胶原蛋白肽出峰良好,峰形对称,无拖尾和鼓包现象,主要分子量集中在454 u。
2.4 草鱼鱼鳞胶原蛋白肽的氨基酸分析
为了弄清鱼鳞胶原蛋白肽的氨基酸组成,我们进行了水解氨基酸分析,结果见表3。
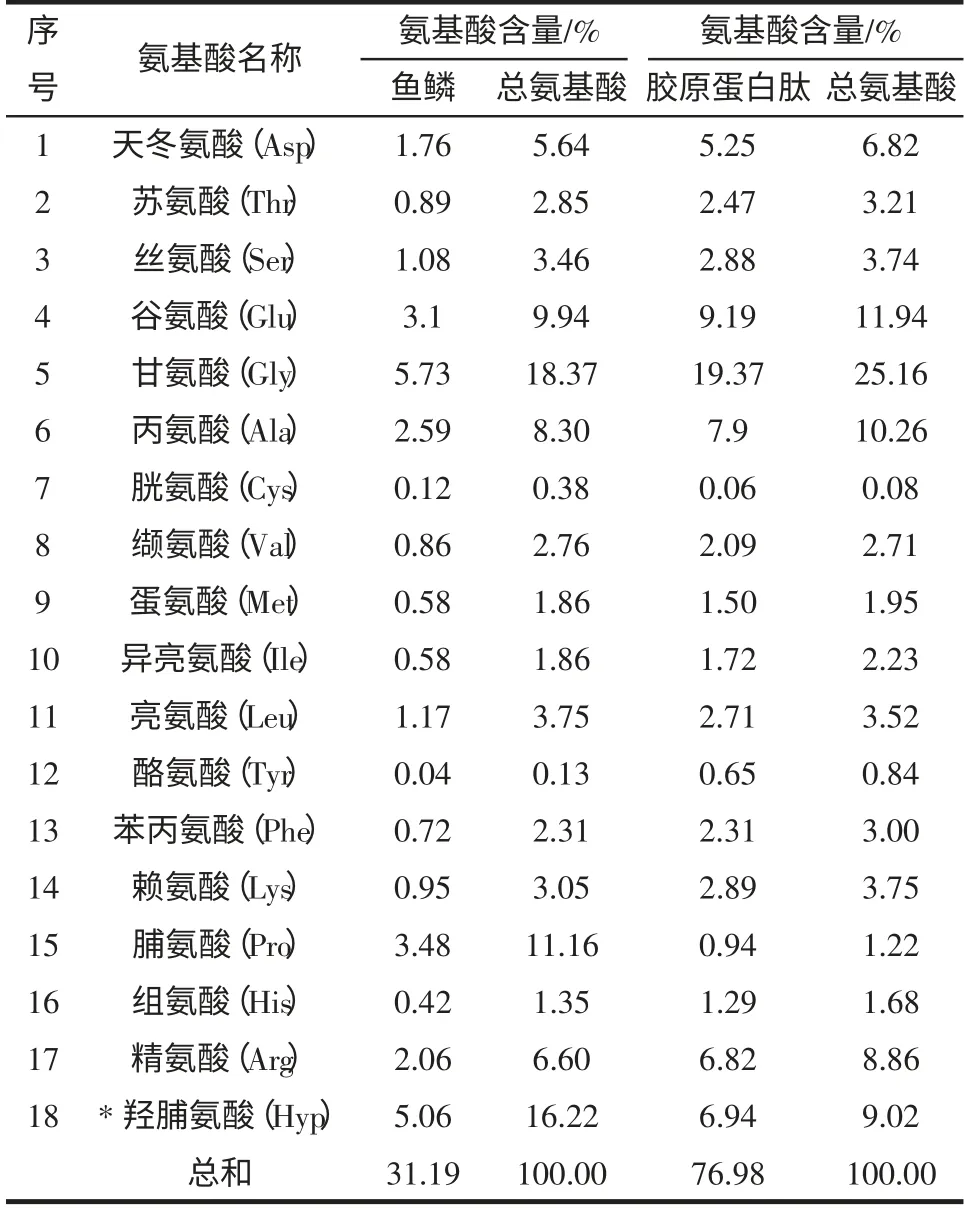
表3 草鱼鱼鳞及其胶原蛋白肽的氨基酸含量及比例Table 3 Amino acid content and proportion of Grass carp fish scale and its collagen peptide
表3 显示,鱼鳞胶原蛋白肽中甘氨酸、丙氨酸、羟脯氨酸、精氨酸、天冬氨酸的含量较高。除了酪氨酸和胱氨酸的含量较低外,其余16 中氨基酸均超过胶原蛋白肽总重的1%,共占氨基酸含量的99.07%。草鱼鱼鳞中氨基酸的含量占鱼鳞总重的31.19%,其中甘氨酸、羟脯氨酸、脯氨酸、谷氨酸、丙氨酸,精氨酸、天冬氨酸、丝氨酸、亮氨酸的含量较高,均超过鱼鳞总重的1 %,占鱼鳞氨基酸总含量的83.44%。
3 讨论与结论
由于酸碱脱钙处理会造成环境负担,因此本研究采用EDTA 二钠处理鱼鳞。EDTA 二钠是优良的络合剂(螯合剂),可以有效螯合多种金属离子(如,钙、镁、铁、铅、铜、锰等)。本实验结果表明相对于酸处理来说,EDTA 二钠不但能高效脱钙还能减少鱼鳞胶原蛋白肽的特征氨基酸-羟脯氨酸的溶出率,是鱼鳞脱钙前处理的较理想试剂。
在酶种类的选择上,本研究前期结果显示,胃蛋白酶由于作用pH 较低,导致制备的胶原蛋白肽酸苦味重,后处理困难。因此本研究以木瓜蛋白酶作为实验用酶,优化酶解条件,将人体难以消化吸收的鱼鳞胶原蛋白定向剪切成小分子活性肽。结果表明,最佳酶解条件为:酶解温度60 ℃、酶添加量8%、酶解时间2 h、pH 5.0、料液比1 ∶30(g/mL)。获得的胶原蛋白肽分子量均一,分散度小,平均分子量在500 u 左右。鱼鳞经木瓜蛋白酶酶解后,氨基酸绝对含量上升,但组成变化不大,其中主要含有甘氨酸、丙氨酸、羟脯氨酸等。
[1] Rui Duan, Junjie Zhang, Xiuqiao Du, et al. Properties of collagen from skin,scale and bone of carp (Cyprinus carpio)[J].Food chemistry,2009,112:702-706
[2] 郭玉华,刘扬瑞,李钰金.鱼类胶原蛋白及胶原活性多肽的研究进展[J].中国食品添加剂,2010(3):175-179
[3] M C Go'mez-Guille'n,B Gime'nez,P Montero.Extraction of gelatin from fish skins by high pressure treatment[J].Food hydrocolloids,2005,19:923-928
[4] H Y Liu, D Li, S D Guo. Extraction and properties of gelatin from channel catfish (Ietalurus punetaus) skin[J]. LWT, 2008, 41: 414-419
[5] 傅燕凤, 沈月新, 杨承刚. 淡水鱼鱼皮胶原蛋白的提取[J].上海水产大学学报,2004,13(2):146-150
[6] Keiji Yoshimura,Mariko Terashima,Daiki Hozan,et al.Preparation and Dynamic Viscoelasticity Characterization of Alkali-Solubilized Collagen from Shark Skin[J].J Agric Food Chem,2000,48(3):685-690
[7] 吴琦,胡建平,刘书亮,等.鲢鱼鳞胶原多肽的酶法制备及性质研究[J].食品与发酵工业,2010,36(2)119-122
[8] 周兴汉,门建华,王光亚.GB/T 5009.92-2003 食品中钙的测定[S].中华人民共和国卫生部,中国国家标准化管理委员会,2003
[9] 郭新东,邓穗兴,罗海英,等.GB/T 9695.23-2008 肉与肉制品羟脯氨酸含量测定[S].中华人民共和国卫生部,中国国家标准化管理委员会,2008
[10] 赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,(11):65-67
[11] 曹健,李卫林,张磊,等.酶解胶原蛋白产物分子量的控制研究[J].食品工业科技,2006,27(8):85-88
[12] 王旭,何冰芳,李霜,等.Tricine-SDS-PAGE 电泳分析小分子多肽[J].南京工业大学学报,2003,25(2):79-81
[13] 贾建萍,周彦钢,鲁健章,等.凝胶渗透色谱法测定胶原肽分子质量及其分布[J].中国卫生检验杂志,2010(5):968-969
[14] 贾健斌,赵熙和.GB/T 5009.124-2003 食品中氨基酸的测定[S].中华人民共和国卫生部,中国国家标准化管理委员会,2003
