一个中枢炎性免疫诱发长时程抑郁样行为的新模型*
2014-01-31汤明明潘玉芹林文娟
汤明明 潘玉芹 林文娟
(1中国科学院心理健康重点实验室, 中国科学院心理研究所, 北京 100101)
(2中国科学院大学, 北京 100049)
1 引言
抑郁症中伴有免疫功能异常的观点提出已经有20年, 但这些异常在抑郁症的发病机理中如何发挥作用, 仍然没有得到清晰阐释(Maes et al.,2009; Miller, Maletic, & Raison, 2009)。在众多研究中, 比较一致的发现是抑郁症患者血浆中炎性细胞因子的水平升高, 包括IL-1β、IL-6、TNF-α以及IFN-γ等(Himmerich et al., 2008; Howren, Lamkin,& Suls, 2009; Schiepers, Wichers, & Maes, 2005)。全系统暴露于炎性刺激物, 例如革兰氏阴性细菌细胞壁的主要成分脂多糖, 不仅能够诱发外周炎症过程,也能引起中枢神经系统炎症反应, 表现为脑内小胶质细胞激活并产生更多的前炎性细胞因子, 如IL-1β、IL-6和TNF-α等(Miller et al., 2009)。LPS引起的脑内神经炎症反应以及升高的前炎性细胞因子, 可以诱导特异性症状, 称为病态行为综合征(Maes et al., 2012)。症状包括厌食、嗜睡、活动能力和探索能力下降、快感缺乏以及认知障碍等, 与抑郁症有很强的相似性, 同时抑郁症患者情绪症状与炎症反应的存在也具有很强的相关性(Dantzer,2009)。这些证据提示LPS诱发炎症反应并引起抑郁症状, 因此常用于建立免疫激活诱发抑郁样行为的动物模型。
目前国际上的研究主要应用外周LPS处理建立抑郁动物模型, 为探索炎症反应如何参与抑郁症病理机制提供实验依据(O'Connor et al., 2008; Qin et al., 2007)。但常见的外周LPS处理所引起的抑郁样行为表现通常持续仅数小时, 少有超过24 h(Dantzer, 2004; Inoue, Somay, Poole, & Luheshi,2008; Silverman et al., 2013, Wang et al., 2011 )。例如单次腹腔注射LPS后2 h到8 h, 动物出现摄食下降、社会退缩、强迫游泳和悬尾不动时间增加等抑郁样行为, 但到注射后24 h行为基本恢复正常水平(Frenois et al., 2007; Park, Lawson, Dantzer, Kelley,& McCusker, 2011; 池少鹏, 戚智, 姬广聚, 邝雪莹,林文娟, 2012)。这些LPS注射后24 h内出现的抑郁样行为可能受到病态行为的干扰 (Dantzer,O'Connor, Freund, Johnson, & Kelley, 2008; Frenois et al., 2007; Maes et al., 2012)。而且LPS注射后2~4 h与24~48 h这两个时段存在不同的神经元激活机制(Frenois et al., 2007; O'Connor et al., 2009)。外周单次LPS处理的这种短效特点无法为有针对性地探索抑郁样行为背后的神经免疫机制提供适当的动物模型, 限制了对炎性反应诱发抑郁的病理机制的深入研究。因此迫切需要建立能够诱发较长时程抑郁样行为的免疫激活动物模型。
为克服单次外周LPS注射模型存在的上述不足, 一些研究者曾尝试采用外周LPS重复注射的方法, 以期诱导持续时间更长的抑郁样行为。结果发现外周LPS重复注射导致动物明显药物耐受, 并不能诱发显著的抑郁样行为(潘玉芹, 王东林, 林文娟, 2007)。与外周炎性免疫反应相比, 中枢免疫激活引起的脑内细胞因子水平变化更可能是抑郁样行为产生的直接原因(Sharpley & Agnew, 2011)。从中枢途径激活免疫炎性反应可能是建立抑郁动物模型更为有效的手段。本工作由此假设, 从中枢途径注射LPS可能更有效、更稳定地诱发达到甚至超过24 h的长时程抑郁样行为。本实验以大鼠为模型动物, 通过脑室立体定位注射LPS, 考察单次和重复注射后中枢免疫激活导致的行为改变以及行为改变的时程效应。希望建立一种新的中枢炎性免疫诱发抑郁模型, 为研究抑郁症炎性免疫机制提供更为可靠的动物模型。
2 实验材料和方法
2.1 动物
实验选用无特定病原体级(Specific pathogen free, SPF级)雄性Sprague-Dawley大鼠, 体重260~280g, 购自北京维通利华实验动物技术有限公司。所用动物饲养于12 h / 12 h昼夜周期(上午7:00开灯, 晚19:00关灯), 温度22 ±1℃,湿度40~60%的环境中。单笼饲养, 不锈钢笼具25cm×22.5cm×30cm, 自由采食饮水。实验开始前,每天抓取抚摸5 min, 维持7天, 使其适应实验室环境和实验人员操作。实验程序获得中国科学院心理研究所伦理审查委员会批准, 并符合国家动物管理和使用规则。
2.2 手术和注射
适应期过后, 对大鼠实施脑部立体定位手术。1%戊巴比妥钠(Merck, Germany)溶液腹腔注射麻醉大鼠, 麻药剂量为35 mg/Kg。将麻醉后的动物置于脑立体定位仪上(STOELTING, USA), 耳插固定。整个手术过程通过加热垫(RWD Life Science Co.,Ltd, China)维持动物体温在37℃。
依据注射药物需要, 采用单侧脑室插管。不锈钢材质植入导管(外径0.64 mm, 长16 mm; RWD Life Science Co., Ltd, China)植入左侧侧脑室。根据大鼠脑立体定位图谱(Paxinos & Watson, 2006)确定位置坐标为:前囟后0.9 mm, 外侧1.1 mm, 颅骨表面下3.2 mm。在植入导管周围拧入两颗螺丝钉, 用丙烯酸树脂将导管和螺丝钉固定在头骨上。以阻塞内管封闭植入导管, 防止异物进入引起导管堵塞。手术后在大鼠后腿肌肉注射抗生素(5万单位青霉素钠溶液, 0.25 ml), 防止术后感染。随后将大鼠放回干净的笼子, 恢复7天后再进行药物注射和行为测试。
通过微量注射泵(HARVARD APPARATUS,USA)进行药物注射。LPS (Sigma, USA)溶于无菌生理盐水(山东齐都药业有限公司)中, 配置成浓度为100 ng/ul的注射液。药物注射剂量参考先前研究报道(Fu et al., 2010; Pan et al., 2013)。对照组注射等量无菌生理盐水。注射前将注射内管(外径0.41 mm,插入后长度超过植入导管末端1 mm, RWD Life Science Co., Ltd, China)插入植入导管, 由微量注射泵将1 µl的LPS溶液或者生理盐水以1 µl/min速度注射入侧脑室。注射结束后停留注射内管1 min以确保药物足量扩散入侧脑室。给药时间为早上9:00, 隔日进行。
2.3 实验程序
实验一:脑室LPS单次、重复注射诱导大鼠抑郁样行为。
为建立大鼠中枢炎性免疫激活抑郁模型, 本实验尝试单次脑室LPS注射和重复脑室LPS注射两种方式。单次注射程序如图1A所示, 在恢复期结束后, 向脑室注射一次LPS (或无菌生理盐水), 注射后24 h进行糖水偏好、悬尾和旷场测试。重复注射程序如图2A所示, 在恢复期后注射三次LPS或盐水, 每次间隔48 h, 末次注射后24 h进行与单次程序中相同的行为测试。
实验二:考察重复LPS脑室注射诱导大鼠抑郁样行为的时程效应。
根据实验一结果, 进一步探索中枢炎性免疫激活抑郁模型中行为改变的时程效应。流程如图3A,恢复期后, 测量行为数据基线。注射程序结束后,选择末次注药后1天(24 h), 3天(72 h), 5天和7天时间点测量行为改变时程。以糖水偏好、旷场、悬尾测试等多个指标, 衡量脑室LPS重复注射诱导大鼠抑郁样行为的时程效应。
2.4 行为测试
糖水偏好:
糖水偏好用于评价实验动物快感缺乏程度, 糖水消耗的下降是典型的抑郁样行为(Wann, Audet, Gibb, & Anisman, 2010)。在正式测量前, 大鼠经过4天的适应训练。训练开始于手术恢复期后, 程序为每天12:00断水, 20 h后, 即次日8:00适应训练4 h。训练时同时给大鼠一瓶清水和一瓶0.5%的糖精钠(天津北方食品有限公司)溶液。训练前后给水瓶称重, 以计算糖水和水的消耗量。糖水偏好用糖水消耗量(实验一)或者糖水消耗和总液体消耗的比值(实验二)表示。第4次适应训练后,撤掉糖水保留清水, 动物继续自由饮水。正式测量糖水偏好, 程序为同时给予清水和糖精钠溶液, 测量1 h (8:00~9:00)内动物对糖水和水的消耗量。训练和测试过程, 两种水瓶的位置随机摆放。旷场测试:
糖水偏好测量结束后, 进行旷场测试。旷场测试用于评价动物的自发活动能力和探索行为能力, 能够反映抑郁状态下的活动能力下降(Silverman et al., 2013; Song, Zhang, & Manku,2009)。实验装置为直径180 cm的圆形开场, 墙壁高50 cm, 底部和侧壁均为黑色, 置于低照度房间中(采用40 W灯泡照明)。测试开始时将大鼠放在旷场中间, 记录5 min中内大鼠自发活动行为视频。实验结束后通过EthoVision XT动物运动轨迹跟踪系统(Noldus Information Technology, Netherland)统计动物在旷场中的行进距离。大鼠直立行为次数人工统计,以大鼠两前爪离地头向上身体直立姿势为判断标准。每只大鼠测试完成后清理旷场, 以防止气味对下一只的影响。悬尾测试:
测试装置为悬尾架, 高1.5 m, 正中悬挂长80 cm可360度自由转动的挂钩。测试时将大鼠尾部通过胶布固定在悬尾架挂钩上, 用摄像机记录大鼠5 min内的活动视频。采用EthoVision XT动物运动轨迹跟踪系统分析大鼠悬尾5 min内的不动时间。不动时间的延长是动物绝望情绪的表现,也是典型的抑郁样行为指标(Zeni, Zomkowski,Maraschin, Rodrigues, & Tasca, 2012)。完成所有行为测试后, 通过植入导管和注射内管向大鼠脑室注入1 μl染色剂(Chicago Sky Blue,Sigma, USA)。断头取脑后在插管位置做冠状切面, 观察染色剂是否进入侧脑室以判断插管位置是否正确,只有插管正确的大鼠的行为数据进入后续统计分析。
2.5 统计分析
数据以“均值±标准误” (M
±SEM
)表示。实验一中两组间对比采用独立样本t
检验进行。实验二中时程效应的检验以药物处理(盐水和LPS)作为组间变量, 时间为组内变量, 进行两因素重复测量方差分析。事后检验进行各时间点上两组均值差异的比较, 以p
< 0.05为差异显著标志。3 结果
3.1 实验一:脑室LPS单次和重复注射诱导的抑郁样行为
3.1.1 单次脑室LPS注射
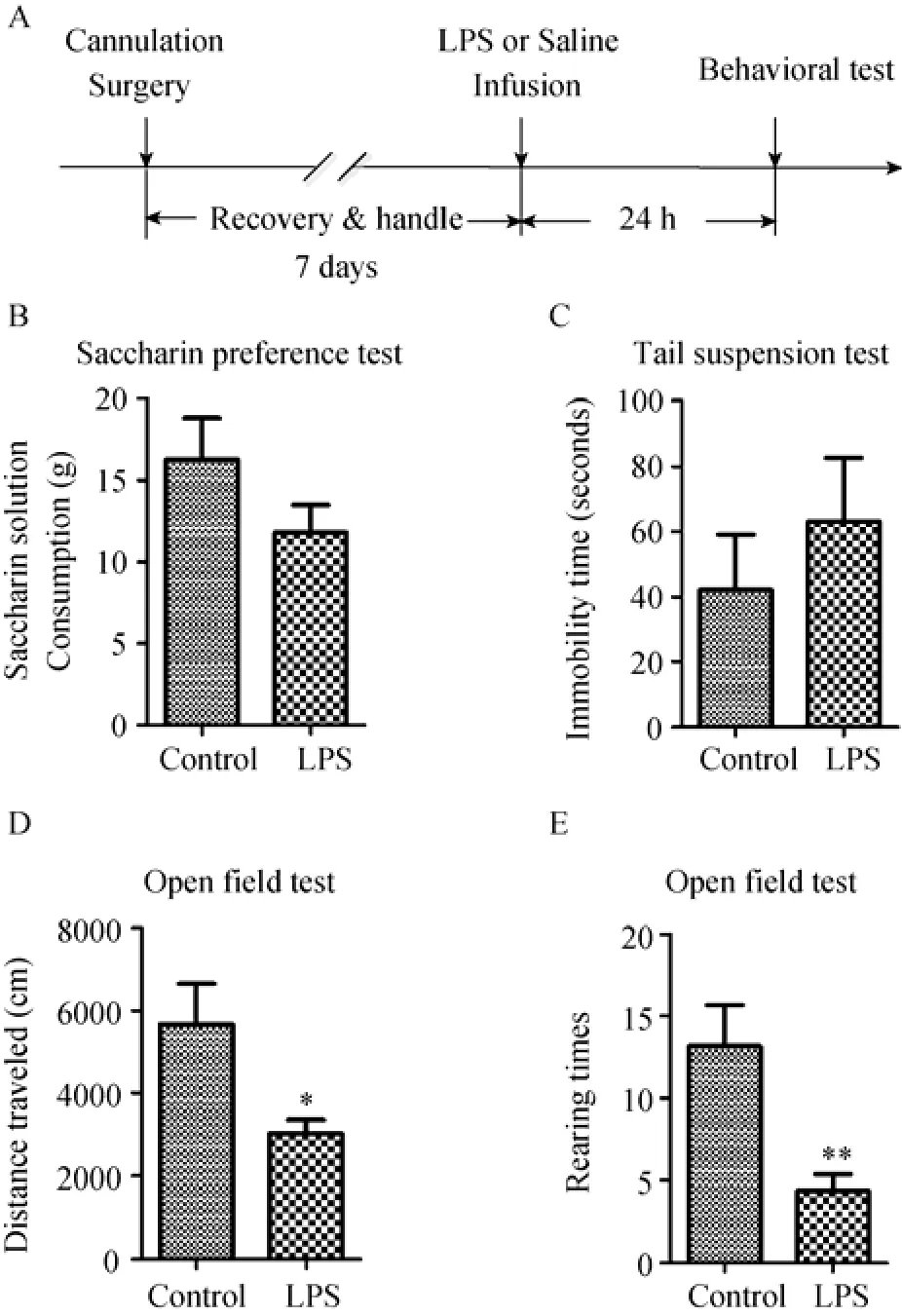
图1 单次脑室LPS注射对大鼠行为的影响
结果如图1。与对照组相比, 单次脑室LPS注射对注射后24 h时糖水偏好的影响不显著:t
(14) =1.45,p
> 0.05。对悬尾不动时间的影响亦不显著:t
(12) = 0.81,p
> 0.05。而对大鼠在旷场中的行为具有显著影响, 抑制了自发活动, 降低旷场行进距离:t
(13) = 2.42,p
< 0.05; 减少旷场直立次数, 抑制了探索行为:t
(14) = 3.22,p
< 0.01。由此可知单次脑室LPS只能诱发部分抑郁样行为。3.1.2 重复脑室LPS注射
结果如图2。与对照组相比, 脑室LPS重复注射诱导末次注射后24 h时糖水偏好下降:t
(14) = 3.00,p
< 0.01; 悬尾不动时间增加:t
(12) = 3.43,p
< 0.01; 旷场行进距离减少:t
(14) = 3.56,p
< 0.01; 旷场直立次数减少:t
(14) = 2.37,p
< 0.05。三次隔日注射程序成功诱导了末次注射后24 h时的快感缺乏, 绝望情绪,自发活动减少, 探索行为减少等抑郁样行为。
图2 重复脑室LPS注射对大鼠行为的影响
3.2 实验二:脑室LPS重复注射诱导抑郁样行为的时程效应
3.2.1 糖水偏好下降的时程效应
中枢LPS处理后, 大鼠表现出显著的糖水偏好下降。LPS药物主效应显著:F
(1,12) = 17.60,p
<0.01; 时间主效应显著:F
(4,48) = 3.33,p
< 0.05;药物×时间交互效应显著:F
(4,48) = 2.8,p
< 0.05。事后检验表明末次注射后24 h两组糖水偏好差异显著(p
< 0.001)。从末次注射后72 h至7天, LPS组糖精水消耗比例有所恢复, 逐渐接近前测基线水平, 但仍低于对照组, 见图3B。3.2.2 悬尾测试不动时间增加的时程效应
悬尾不动时间的重复测量方差分析显示, LPS药物主效应显著:F
(1,10) = 11.44,p
< 0.01; 时间主效应不显著:F
(4,40) = 2.06,p
> 0.05; 药物×时间交互效应显著:F
(4,40) = 2.90,p
< 0.05。事后检验表明, 重复LPS注射对不动时间的影响从末次注射后24 h持续到72 h (p
< 0.001,p
< 0.05), 见图3C。3.2.3 自发运动和探索行为减少的时程效应
脑室LPS重复注射对大鼠在旷场中自发运动的影响见图3D。LPS药物主效应显著:F
(1,14) =16.12,p
< 0.01; 时间主效应显著:F
(4,56) = 7.66,p
< 0.001; 药物×时间交互效应显著:F
(4,56) = 3.28,p
< 0.05。事后检验表明LPS组大鼠末次注射后24 h和72 h行进距离显著低于对照组(p
< 0.001,p
<0.01)。中枢LPS注射显著抑制了动物的自发活动能力, 并且这种显著差异具有一定的长时程效应。对旷场直立行为次数的重复测量方差分析见图3E, LPS药物主效应显著:F
(1,14) = 6.02,p
<0.05; 时间主效应不显著:F
(4,56) = 1.72,p
> 0.05;药物×时间交互效应显著:F
(4,56) = 2.88,p
< 0.05。事后检验表明LPS组直立行为在24 h和72 h测试点上显著低于对照组(p
< 0.05), 表明中枢炎性免疫反应抑制了动物的探索行为, 这种抑制效果具有一定的长时程效应。4 讨论
本研究通过侧脑室注射LPS, 直接激活中枢神经系统的炎性免疫反应, 成功诱导了大鼠的抑郁样行为。并通过分别执行单次和重复注射程序, 发现重复脑室LPS注射方法能够建立一种稳定的免疫激活抑郁动物模型, 诱导的抑郁样行为具有一定的长时程效应。中枢免疫激活大鼠在多种行为测试中表现出了抑郁样行为, 糖水偏好下降表明动物出现快感缺乏行为, 旷场行进距离和直立次数减少表明动物的自发活动和探索活动受到抑制, 悬尾测试中LPS注射增加了动物的绝望情绪导致不动时间延长(Maes et al., 2012; Zeni et al., 2012)。不同于以往的LPS诱导的短时程行为改变, 本工作报道的抑郁样行为持续时间超过末次注射后24 h, 大多数在72 h时仍显著, 是具备长时程效应的LPS诱导抑郁样行为的新模型。
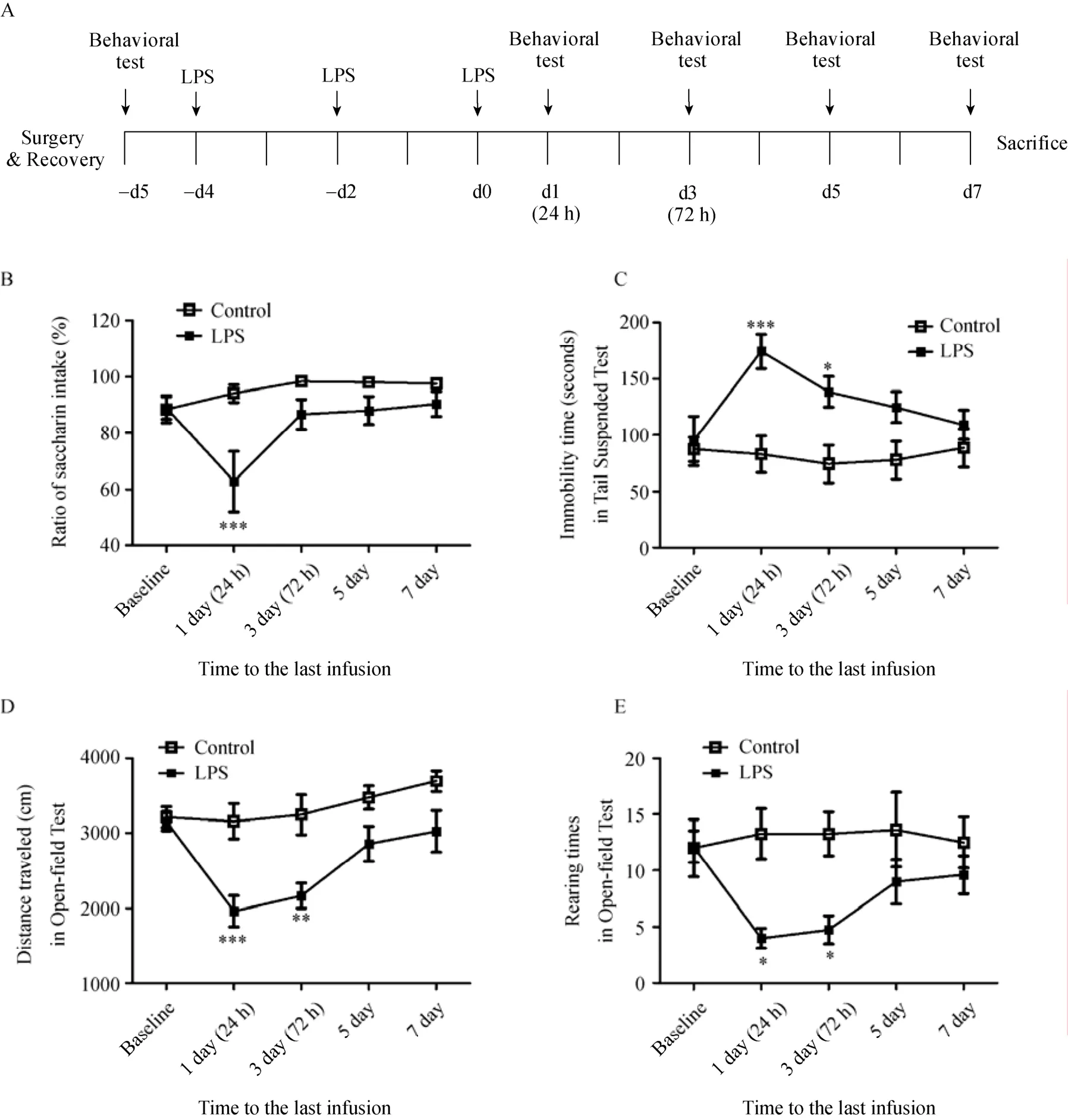
图3 脑室LPS重复注射诱导的抑郁样行为及其时程效应
本研究发现单次脑室LPS注射后只有部分抑郁样行为能够持续至24 h, 即旷场测试中的自发活动行为有显著差异; 而抑郁样行为的核心指标——糖水偏好以及反映动物绝望情绪的悬尾不动时间—— 无显著差异。这与早先 Bluthé等人(1999)报道基本一致。他们的工作表明, 单次脑室LPS注射在6 h后可表现出抑郁样行为, 在24 h内恢复。有研究认为注射LPS后24 h内的抑郁样行为可能受到病态行为干扰。在啮齿类动物身上, LPS注射后2~6 h是发热等病态行为最显著的阶段, 而注射后24 h病态行为消退到最小值(Frenois et al., 2007)。抑郁是慢性的适应不良行为, 与病态行为产生机制不同, 不具有发热的症状, 发病缓慢, 病程长期且反复发作, 伴有以前炎性细胞因子水平长期升高为标志的慢性炎症反应, 以及慢性的细胞介导的免疫激活和氧化应激反应等(Leonard & Maes, 2012;Maes, 2009)。虽然病态行为和抑郁行为都与前炎性细胞因子在LPS注射后表达升高有关, 但细胞因子引起的以c-Fos为标志的神经元快速免疫反应和以FosB/ΔFosB为标志的神经元慢性免疫反应存在时间上的分离, 即注射LPS后的6到24 h期间, c-Fos表达开始下降, 而FosB/ΔFos表达继续升高(Frenois et al., 2007)。这说明LPS引起的抑郁行为和病态行为具有不同的神经生理机制, LPS注射后24 h的抑郁样行为可认为是排除了病态行为的影响。而本研究实验一结果中, 重复脑室LPS注射所诱发的抑郁样行为在注射后24 h仍显著, 可知重复注射程序成功诱导了持续至24 h的抑郁样行为, 排除了病态行为的干扰, 是一种新的更为有效的免疫激活抑郁动物模型。
一些研究者曾尝试采用外周重复LPS注射诱发抑郁样行为, 发现多次腹腔注射LPS后动物的行为表现与对照组不存在显著差异(De La Garza,Pedrosa, Stearns, & Asnis, 2004; Prendergast, 2008;潘玉芹等, 2007)。这些尝试失败的原因可能是免疫系统启动耐受机制引起多次外周LPS注射后炎症和免疫反应减弱(Draisma, Pickkers, Bouw, & Van der Hoeven, 2009; Lehner & Hartung, 2002)。耐受与机体受损伤后的保护机制增强有关, 可以减少白细胞和内皮细胞的激活, 降低前炎性细胞因子的分泌,增加抗炎性细胞因子IL-10等的产生。LPS耐受随着注射次数增加而增强, 抑制初期注射引起的免疫激活, 使机体重新回到免疫系统的自我平衡状态,行为改变随之消退。本研究中多次中枢LPS注射能够诱发显著抑郁样行为, 可能与中枢对LPS的耐受低于或不同于外周有关。中枢神经系统中的主要免疫细胞, 如小胶质细胞、巨噬细胞等表面表达大量的Toll样受体, 与LPS结合激活细胞内部的信号转导通路, 合成释放前炎性细胞因子并进一步募集更多的免疫细胞, 扩大免疫激活范围。中枢神经系统由于血脑屏障的存在, 以及脑实质自身的特性, 与外周免疫系统相比, 其免疫激活过程、细胞因子信号传递以及负反馈调节速度都更缓慢(Kettenmann,Hanisch, Noda, & Verkhratsky, 2011; Rivest, 2009)。中枢炎性免疫激活的这些特点可能是脑室LPS重复注射诱发长时程抑郁样行为的原因, 但具体的神经免疫生理机制, 以及耐受机制的启动与效果等尚不清楚, 需要进一步研究。
临床上抑郁症患者常伴有长期的炎症过程, 血液中的前炎性细胞因子IL-1、IL-6以及TNF-α等长期处于高水平(Himmerich et al., 2008; Howren et al., 2009), 长期的免疫激活可能是抑郁症尤其是慢性抑郁的病理基础(Maes, Kubera, Leunis, & Berk,2012)。因此建立能够模拟慢性免疫激活状态的抑郁症动物模型一直为众多研究者所关注, 但鲜有成功的研究见诸报道。最近Kubera等的工作显示, 采用4个月的重复、间隔且多种剂量的LPS腹腔注射,能够诱发雌性小鼠持续7周的快感缺乏行为(Kubera et al., 2013)。但这种方法程序复杂, 耗时很长, 建立模型比较困难; 且同样的方法不能诱发雄性小鼠的持续抑郁样行为, 未能充分证明外周LPS重复处理建立抑郁动物模型的可行性。相比之下,本研究所建立的脑室重复LPS注射抑郁动物模型建立途径更为直接, 方法更为简洁, 是具有良好可操作性的长时程免疫激活抑郁动物模型。本模型的建立提示了直接激活中枢神经系统的免疫反应可能是进一步探索稳定有效的长期免疫激活抑郁动物模型的新途径。
5 结论
本研究通过脑室单次和重复注射LPS, 发现重复注射的方法能够建立一种新的中枢炎性免疫激活诱发的抑郁动物模型, 成功诱导了超过24 h的较长时程快感缺乏、自发活动和探索活动能力下降、悬尾不动时间增加等抑郁样行为。这一模型弥补了以往外周单次LPS注射只能诱发数小时抑郁样行为的不足, 为深入探索抑郁症发病机制中免疫激活所起的作用提供了更有效的动物模型。
Bluthé, R. M., Castanon, N., Pousset, F., Bristow, A., Ball, C.,Lestage, J., … Dantzer R. (1999). Central injection of IL-10 antagonizes the behavioural effects of lipopolysaccharide in rats.Psychoneuroendocrinology, 24
,301–311.Chi, S. P., Qi, Z., Ji, G. J., Kuang, X. Y., & Lin, W. J. (2012).Upregulation of K+ current in hippocampal neurons from rat with depressive-like behavior induced by lipopolysaccharide.Acta Psychologica Sinica, 44
, 459–468.[池少鹏, 戚智, 姬广聚, 邝雪莹, 林文娟. (2012). 脂多糖激活所致大鼠抑郁样行为及对海马神经细胞钾电流变化的影响.心理学报, 44
, 459–468.]Dantzer, R. (2004). Cytokine-induced sickness behaviour: A neuroimmune response to activation of innate immunity.European Journal of Pharmacology, 500
, 399–411.Dantzer, R. (2009). Cytokine, sickness behavior, and depression.Immunology and Allergy Clinics of North America, 29
, 247–264.Dantzer, R., O'Connor, J. C., Freund, G. G., Johnson, R. W., &Kelley, K. W. (2008). From inflammation to sickness and depression: when the immune system subjugates the brain.Nature Reviews Neuroscience, 9
, 46–56.De La Garza, R. I., Pedrosa, E., Stearns, C., & Asnis, G. M.(2004). Chronic lypopolysaccharide results in tolerance to alterations to basic reward behavior, body weight, and food and water consumption.Biol Psychiatry, 55,
112S.(请核对本条文献格式)Draisma, A., Pickkers, P., Bouw, M., & van der Hoeven, J. G.(2009). Development of endotoxin tolerance in humansin vivo
.Critical Care Medicine, 37
, 1261–1267.Frenois, F., Moreau, M., O’Connor, J., Lawson, M., Micon, C.,Lestage, J., … Castanon, N. (2007). Lipopolysaccharide induces delayed FosB/DeltaFosB immunostaining within the mouse extended amygdala, hippocampus and hypothalamus,that parallel the expression of depressive-like behavior.Psychoneuroendocrinology, 32
, 516–531.Fu, X., Zunich, S., O'Connor, J., Kavelaars, A., Dantzer, R., &Kelley, K. (2010). Central administration of lipopolysaccharide induces depressive-like behavior in vivo and activates brain indoleamine 2,3 dioxygenase in murine organotypic hippocampal slice cultures.Journal of Neuroinflammation, 7
, 43.Himmerich, H., Fulda, S., Linseisen, J., Seiler, H., Wolfram,G., Himmerich, S., … Pollmächer, T. (2008). Depression,comorbidities and the TNF-α system.European Psychiatry,23
, 421–429.Howren, M. B., Lamkin, D. M., & Suls, J. (2009).Associations of depression with c-reactive protein, IL-1,and IL-6: A meta-analysis.Psychosomatic Medicine, 71
,171–186.Inoue, W., Somay, G., Poole, S., & Luheshi, G. N. (2008).Immune-to-brain signaling and central prostaglandin E2 synthesis in fasted rats with altered lipopolysaccharideinduced fever.American Journal of Physiology-Regulatory,Integrative and Comparative Physiology, 295
, R133–R143.Kettenmann, H., Hanisch, U.K., Noda, M., & Verkhratsky, A.(2011). Physiology of microglia.Physiological Reviews,91
(2), 461–553.Kubera, M., Curzytek, K., Duda, W., Leskiewicz, M.,Basta-Kaim, A., Budziszewska, B., … Maes, M. (2013). A new animal model of (chronic) depression induced by repeated and intermittent lipopolysaccharide administration for 4 months.Brain, Behavior, and Immunity, 31
, 96–104.Lehner, M. D., & Hartung, T. (2002). Endotoxin tolerance —Mechanisms and beneficial effects in bacterial infection.Reviews of Physiology, Biochemistry and Pharmacology,144
, 95–141.Leonard, B., & Maes, M. (2012). Mechanistic explanations how cell-mediated immune activation, inflammation and oxidative and nitrosative stress pathways and their sequels and concomitants play a role in the pathophysiology of unipolar depression.Neuroscience & Biobehavioral Reviews, 36
, 764–785.Maes, M. (2009). "Functional" or "psychosomatic" symptoms,e.g. a flu-like malaise, aches and pain and fatigue, are major features of major and in particular of melancholic depression.Neuro Endocrinology Letters, 30
, 564–573.Maes, M., Berk, M., Goehler, L., Song, C., Anderson, G.,Galecki, P., … Leonard, B. (2012). Depression and sickness behavior are Janus-faced responses to shared inflammatory pathways.BMC Medicine, 10
, 66.Maes, M., Kubera, M., Leunis, J.C., & Berk, M. (2012).Increased IgA and IgM responses against gut commensals in chronic depression: Further evidence for increased bacterial translocation or leaky gut.Journal of Affective Disorders, 141
, 55–62.Maes, M., Yirmyia, R., Noraberg, J., Brene, S., Hibbeln, J.,Perini, G., … Maj, M. (2009). The inflammatory &neurodegenerative (I&ND) hypothesis of depression: leads for future research and new drug developments in depression.Metabolic Brain Disease, 24
, 27–53.Miller, A. H., Maletic, V., & Raison, C. L. (2009).Inflammation and its discontents: The role of cytokines in the pathophysiology of major depression.Biological Psychiatry, 65
, 732–741.O'Connor, J. C., Andre, C., Wang, Y., Lawson, M. A., Szegedi,S. S., Lestage, J., … Dantzer, R. (2009). Interferon-gamma and tumor necrosis factor-alpha mediate the upregulation of indoleamine 2,3-dioxygenase and the induction of depressive-like behavior in mice in response to bacillus Calmette-Guerin.Journal of Neuroscience, 29
, 4200–4209.O'Connor, J. C., Lawson, M. A., Andre, C., Moreau, M.,Lestage, J., Castanon, N.,…Dantzer, R. (2008).Lipopolysaccharide-induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice.Molecular Psychiatry, 14
, 511–522.Pan, Y., Lin, W., Wang, W., Qi, X., Wang, D., & Tang, M.(2013). The effects of central pro-and anti-inflammatory immune challenges on depressive-like behavior induced by chronic forced swim stress in rats.Behavioural Brain Research, 247
, 232–240.Pan, Y. Q., Wang, D. L., & Lin, W. J. (2007). Animal research on immunity activation -induced depressive-like behavior:Doses and time effects.Acta Psychologica Sinica, 39
,1041–1047.[潘玉芹, 王东林, 林文娟. (2007). 脂多糖免疫激活导致抑郁性行为的动物研究:剂量和时程效应.心理学报, 39
,1041–1047.]Park, S.E., Lawson, M., Dantzer, R., Kelley, K., & McCusker,R. (2011). Insulin-like growth factor-I peptides act centrally to decrease depression-like behavior of mice treated intraperitoneally with lipopolysaccharide.Journal of Neuroinflammation, 8
, 179.Paxinos, G., & Watson, C. (2006).The rat brain in stereotaxic coordinates: Hard cover edition
. New York: Academic Press.Prendergast, B. J. (2008). Behavioral tolerance to endotoxin is enhanced by adaptation to winter photoperiods.Psychoneuroendocrinology, 33
, 540–545.Qin, L., Wu, X., Block, M. L., Liu, Y., Breese, G. R., Hong,J.S., … Crews, F. T. (2007). Systemic LPS causes chronic neuroinflammation and progressive neurodegeneration.Glia, 55
, 453–462.Rivest, S. (2009). Regulation of innate immune responses in the brain.Nature Reviews Immunology, 9
(6), 429–439.Schiepers, O. J. G., Wichers, M. C., & Maes, M. (2005).Cytokines and major depression.Progress in Neuro-Psychopharmacology and Biological Psychiatry, 29
,201–217.Sharpley, C. F., & Agnew, L. L. (2011). Cytokines and depression: Findings, issues, and treatment implications.Reviews in the Neurosciences, 22
, 295–302.Silverman, M. N., Mukhopadhyay, P., Belyavskaya, E., Tonelli,L. H., Revenis, B. D., Doran, J. H., … Sternberg, E. M.(2013). Glucocorticoid receptor dimerization is required for proper recovery of LPS-induced inflammation, sickness behavior and metabolism in mice.Mol Psychiatry, 18
,1006–1017.Song, C., Zhang, X. Y., & Manku, M. (2009). Increased phospholipase A2 activity and inflammatory response but decreased nerve growth factor expression in the olfactory bulbectomized rat model of depression: Effects of chronic ethyl-eicosapentaenoate treatment.The Journal of Neuroscience, 29
, 14–22.Wann, B. P., Audet, M.C., Gibb, J., & Anisman, H. (2010).Anhedonia and altered cardiac atrial natriuretic peptide following chronic stressor and endotoxin treatment in mice.Psychoneuroendocrinology, 35
, 233–240Wang, D., Lin, W., Pan, Y., Kuang, X., Qi, X., & Sun, H. (2011).Chronic blockade of glucocorticoid receptor by RU486 enhances lipopolysaccharide-induced depressive-like behavior and cytokine production in rats.Brain, Behavior, and Immunity, 25
, 706–714.Zeni, A. L. B., Zomkowski, A. D. E., Maraschin, M.,Rodrigues, A. L. S., & Tasca, C. I. (2012). Involvement of PKA, CaMKII, PKC, MAPK/ERK and PI3K in the acute antidepressant-like effect of ferulic acid in the tail suspension test.Pharmacology Biochemistry and Behavior,103
, 181–186.