硒化乳酸菌胞外多糖对小鼠腹腔巨噬细胞及肿瘤细胞内游离Ca2+的影响
2014-01-30潘道东曾小群
刘 鹭,潘道东*,丁 琳,曾小群
(宁波大学海洋学院食品系,浙江 宁波 315211)
多糖是一种由单糖聚合而成的天然高分子化合物,广泛存在于植物、动物和微生物中[1]。乳酸菌是食品级的益生菌,其在生长过程中产生大量胞外多糖。乳酸乳球菌乳亚种(Lactococcus lactissubsp.lactis)是一种革兰氏阳性菌,常被用于干酪生产。大量研究证实乳酸菌胞外多糖(exopolysaccharide,EPS)具有免疫激活、抗肿瘤、降低血清胆固醇等作用[2-4]。硒是人体必需微量元素,适量补充硒元素可增强人体免疫能力[5]。通过化学修饰方法,亚硒酸钠和多糖反应后形成一种含有亚硒酸酯键的硒化多糖。该多糖低毒且可提高小鼠免疫能力[6]。
Ca2+作为细胞内信号参与信息传递,在生物体内具有广泛的作用,如突触适应、神经递质释放、肌肉收缩、细胞分化和死亡等。细胞内游离Ca2+浓度的变化可引发细胞内一系列的生理生化反应[7-9]。巨噬细胞作为机体免疫系统的重要组成部分,在特异性免疫应答及非特异性免疫防御中起着关键的作用[10]。为进一步探讨硒化乳酸菌胞外多糖的免疫功能,本实验利用激光共聚显微镜及Fluo-3/AM探针研究该多糖对巨噬细胞、SGC-7901胃癌细胞及Hela细胞内游离Ca2+浓度的变化,以期为开发一种多糖补硒添加剂提供理论依据。
1 材料与方法
1.1 材料、试剂与培养基
精制EPS及硒化EPS(硒含量169.228μg/g) 本实验室制备。
SGC-7901胃癌细胞、Hela细胞 武汉博士德生物工程有限公司;小牛血清 杭州四季青生物工程材料研究所;细菌脂多糖、Fluo-3/AM 美国Sigma公司;青霉素、链霉素、HEPES缓冲液 北京索莱宝科技有限公司;其余化学试剂均为分析纯。
RPMI 1640培养基、RPMI 1640无酚红培养基 美国Gibco公司。
1.2 动物
ICR小鼠,体质量18~22g,雄性,8周,由宁波大学动物中心提供。
1.3 仪器与设备
370 FT-IR型傅里叶红外光谱仪 美国Nicolet公司;MCO-18AIC CO2培养箱 日本Sanyon公司;飞鸽TDL-40C低速离心机 上海安亭仪器厂;倒置显微镜 日本Olympus公司;TCS SP5II激光共聚显微镜 德国莱卡公司。
1.4 方法
1.4.1 红外光谱扫描
取适量硒化前或硒化后多糖粉末和溴化钾混合研磨压片,在4000~400cm-1范围内扫描。
1.4.2 巨噬细胞分离与培养
每只小鼠提前3d注射体积分数为3%的巯基乙酸肉汤,3d后眼球放血,断脊椎猝死小鼠。用体积分数为75%的酒精浸泡后,剖开腹部皮肤,注射8mL预冷的1640培养基,2min后来回抽取腹水两次,收集细胞。1000r/min离心5min,细胞沉淀用RPMI 1640培养基清洗两遍。用台盼蓝染色确定活细胞大于95%,调整细胞浓度为4×105cells/mL。在37℃、体积分数为5%的CO2培养箱中贴壁3h后洗去非贴壁细胞得小鼠腹腔巨噬细胞[11-12]。
1.4.3 SGC-7901胃癌细胞培养
SGC-7901胃癌细胞为贴壁细胞,用含有体积分数为10%的FBS-RPMI1640培养,并用质量分数为0.25%的胰蛋白酶和0.02% EDTA混合液消化传代,隔天换液,4d传代一次。加药物刺激前细胞处于稳定生长状态。
1.4.4 Hela 细胞培养
Hela细胞为贴壁细胞,用DMEM+10% FBS培养,并用0.25%胰蛋白酶和0.02% EDTA混合液消化传代,每天换液,2d传代一次。加药物刺激前细胞处于稳定生长状态。
1.4.5 细胞内游离钙离子[Ca2+]i测定
细胞贴壁后用Fluo-3/AM(终浓度5μmol/L)孵育45min,含钙镁离子的HEPES液清洗两遍。置于激光共聚显微镜下,单通道激发波长488nm,吸收波长530nm。待稳定后分别加入HEPES液或多糖(终质量浓度为100μg/mL)。每5s测定一次荧光强度,连续测定12min[13-14]。
2 结果与分析
2.1 红外光谱扫描结果
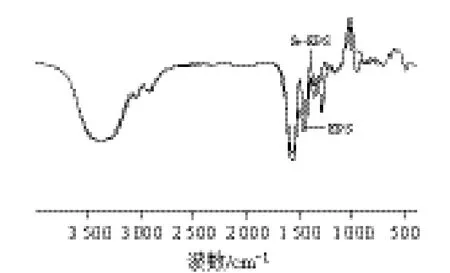
图1 乳酸菌胞外多糖硒化前后红外光谱扫描对比图Fig.1 Infrared spectra of EPS and Se-EPS
2.2 硒化乳酸菌胞外多糖对小鼠腹腔巨噬细胞内游离Ca2+的影响
由图2可知,激光共聚显微镜下巨噬细胞稳定后加入Se-EPS溶液,细胞内Ca2+荧光值缓慢升高并呈现动荡变化趋势;加入同浓度EPS后有微弱动荡而加入HEPES液的对照组细胞内Ca2+荧光值无明显变化。加入Se-EPS后巨噬细胞内的荧光强度明显大于未加Se-EPS前巨噬细胞内的荧光强度。图3为荧光显微镜下巨噬细胞的形态特征。
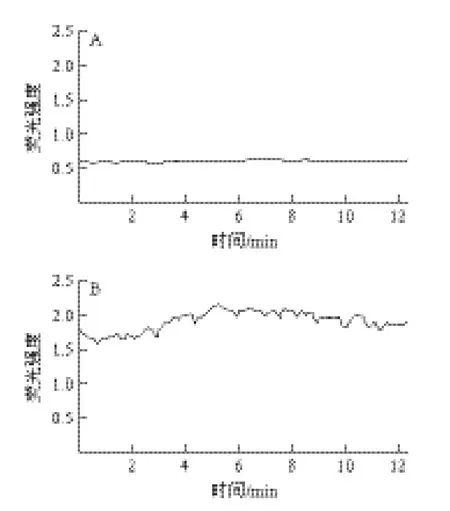
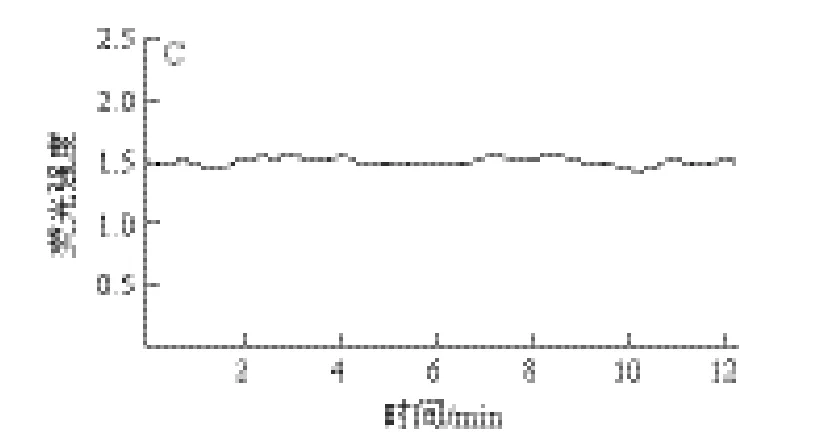
图2 硒化多糖对小鼠巨噬细胞内Ca2+浓度影响Fig.2 Effect of Se-EPS from Lactococcus lactis subsp. lactis on [Ca2+]i in mouse macrophages

图3 荧光显微镜下的巨噬细胞形态Fig.3 Effect of Se-EPS from Lactococcus lactis lactis subsp. on [Ca2+]i in mouse macrophages examined by fluorescence microscope
2.3 硒化乳酸菌胞外多糖对SGC7901胃癌细胞内游离Ca2+的影响
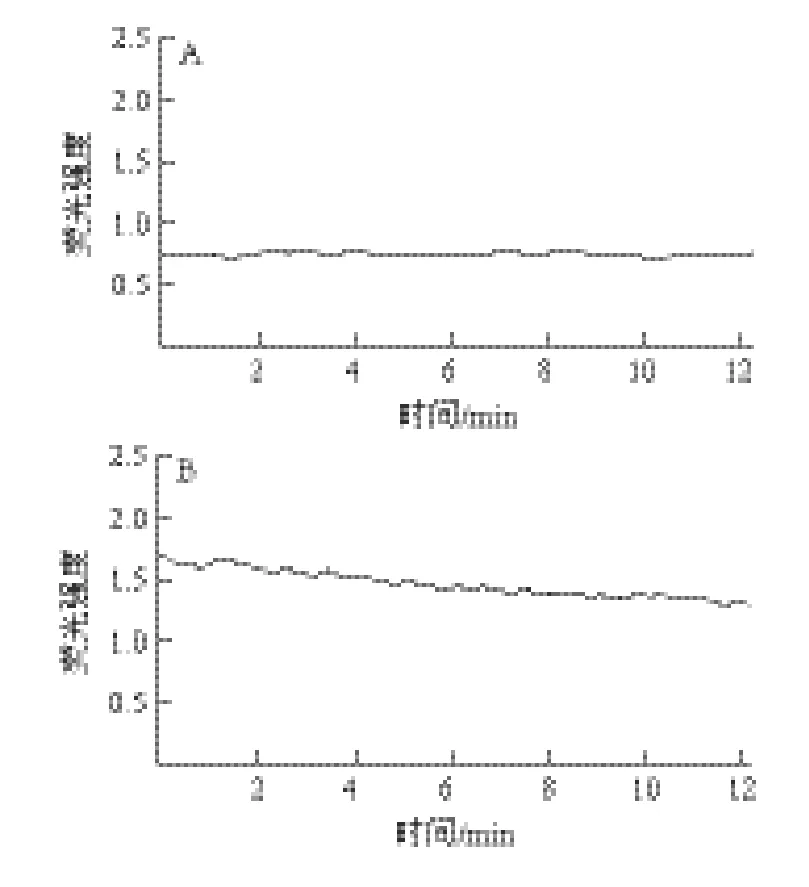
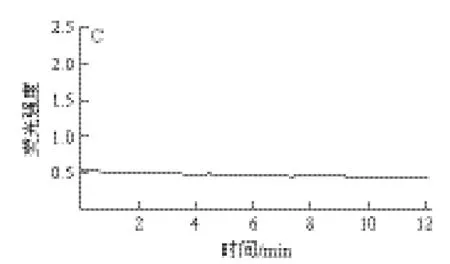
图4 硒化多糖对SGC7901胃癌细胞内Ca2+浓度影响Fig.4 Effect of Se-EPS from Lactococcus lactis subsp. lactis on [Ca2+]i in gastric cancer cells SGC-7901
如图4所示,对照组和多糖组细胞12min内Ca2+荧光强度无明显变化。胃癌细胞加入Se-EPS后细胞内Ca2+荧光强度呈现持续动态下降趋势。
2.4 硒化乳酸菌胞外多糖对Hela细胞内游离Ca2+的影响
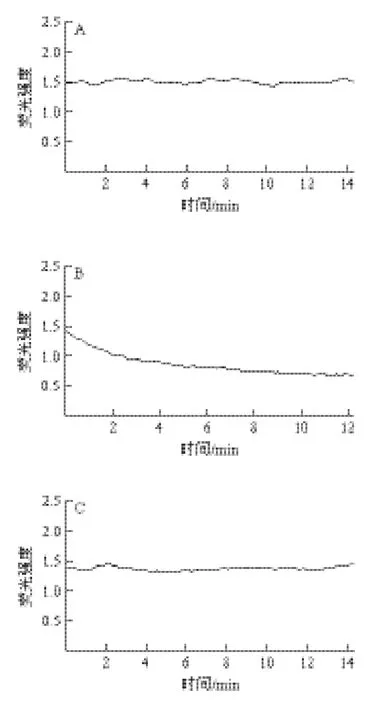
图5 硒化多糖对Hela细胞内Ca2+浓度影响Fig.5 Effect of Se-EPS from Lactococcus lactis subsp. lactis on [Ca2+]i in Hela cells
如图5所示,Hela细胞加入Se-EPS后细胞内Ca2+荧光强度呈现持续动态下降趋势,且下降幅度较大,接近60%,反应后阶段细胞处于持续低钙状态。对照组和多糖组细胞内Ca2+荧光强度呈现动荡变化,但幅度较小。
3 讨 论
在机体内,Ca2+保持稳态,对维持正常生理活动有重要作用。作为细胞内重要的第二信使,Ca2+参与多种细胞活动[12]。Ca2+浓度的升高是巨噬细胞激活的一个早期表现,进而引起细胞分化并分泌多种细胞因子,从而发挥其免疫细胞功能。对于肿瘤细胞而言,钙内流的减少可使细胞生长终止[16]。Fluo-3/AM是一种Ca2+探针,其在细胞内被酯酶水解形成Fluo-3,后者与细胞内Ca2+结合后荧光强度增强[17-18],因此,荧光强度的变化可相应地反映[Ca2+]i浓度的改变。本实验利用Fluo-3/AM标记巨噬细胞及两种肿瘤细胞,利用激光共聚显微镜技术测定硒化多糖的添加对这3种细胞内Ca2+浓度变化的影响。结果显示硒化多糖可使巨噬细胞内Ca2+浓度缓慢升高,这提示通过对乳酸菌胞外多糖进行硒化修饰可增强其刺激巨噬细胞的能力,这可能是由于通过修饰改变了多糖的结构,使其可与细胞表面受体相结合,因而发挥其免疫功效。Ca2+作为细胞内的第二信使之一,通过检查细胞内Ca2+浓度的大小可间接反映细胞的生理状况。实验中胃癌细胞与Hela细胞添加硒化多糖后,细胞内Ca2+水平均有不同程度的下降。这可能是硒化多糖与肿瘤细胞表面受体结合后引起细胞内Ca2+浓度减少,细胞长期处于低钙水平细胞机能将受到严重影响。提示硒化后的多糖可引起肿瘤细胞不同程度的细胞凋亡。细胞内Ca2+浓度的变化与细胞外Ca2+的流动及细胞内钙泵的作用有关[19-20],硒化多糖引起免疫细胞及肿瘤细胞Ca2+变化的作用机制还需要更加深入的研究。
多糖通过硒化修饰得到的硒与多糖化合物结合了两种物质的优点,增加了多糖的免疫功能,并且提供了一种高效低毒的补硒剂。乳酸菌胞外多糖的硒化修饰在一定程度上改变了其生物活性以及作用机制,然而其对免疫功能的影响以及作用机制还需要进行更深层次的研究。
[1]王统一, 赵兵, 王玉春.多糖免疫调节和抗肿瘤研究进展[J]. 过程工程学报, 2006, 6(4): 274- 268.
[2]刘宇孟, 祥晨. 乳酸菌胞外多糖及其抗肿瘤活性[J]. 中国乳品工业,2008, 36(1): 39-43.
[3]顾笑梅, 王富生, 孔健, 等. 乳酸菌Z222产胞外多糖(EPSI)对免疫细胞功能的影响[J]. 中华微生物学和免疫学杂志, 2003, 23(6): 442- 445.
[4]杨洁彬. 乳酸菌: 生物学基础及应用[M]. 北京: 中国轻工业出版社,1996: 105-107.
[5]RAYMAN M P. The importance of selenium to human health[J]. The Lancet, 2000, 356: 233-241.
[6]GUO Yuxing, PAN Daodong, LI Hua, et al. Antioxidant and immuno modulatory activity of selenium exopolysaccharide produced byLactococcus lactissubsp.lactis[J]. Food Chemistry, 2013, 138(1):84-89.
[7]胡庭俊, 程富胜, 陈炅然, 等. 黄芪多糖对小鼠免疫细胞信号转导相关分子的影响[J]. 畜牧兽医学报, 2005, 36(6): 616-619.
[8]QUINTANA A, HOTH M. Apparent cytosolic calcium gradients in T-lymphocytes due to fura-2 accumulation in mitochondria[J]. Cell Calcium, 2004, 36(2): 99-109.
[9]OH-HORA M, RAO A. Calcium signaling in lymphocytes[J]. Current Opinion in Allergy and Clinical Immunology, 2008, 20(3): 250-258.
[10]程安玮, 金征宇, 万发春. 甘草多糖对小鼠腹腔巨噬细胞NO、iNOS及iNOS mRNA表达的影响[J]. 食品科学, 2009, 30(21): 351-354.
[11]翟钦辉, 荣岳光, 董晓芳, 等. 苜草素对巨噬细胞吞噬活性和NO、IL-6、TNF-α分泌的影响[J]. 营养学报, 2012, 34(2): 181-185.
[12]黄迪南, 侯敢, 祝其锋. 猪苓多糖对小鼠腹腔巨噬细胞诱导型一氧化氮合酶活性及mRNA表达的影响[J]. 中西医结合学报, 2004, 2(5):350-352.
[13]王鹏雁, 安建多, 王池. 槲芪散及槲寄生提取物对肝癌细胞内游离钙离子浓度的影响[J]. 首都医科大学学报, 2012, 33(3): 291-296.
[14]QIN Yong, PAN Xiang, TANG Tiantian, et al. Anti-proliferative effects of the novel squamosamide derivative (FLZ) on HepG2 human hepatoma cells by regulating the cell cycle-related proteins are associated with decreased Ca2+/ROS levels[J]. Chemico-Biological Interactions, 2011, 193(3): 246-253.
[15]王晓梅, 顾涛, 张忠山. 硒化坛紫菜多糖的制备、结构表征和活性的研究[J]. 食品工程, 2012, 12(4): 113-115.
[16]LI Sun, ZHAO Zhengyan, ZHOU Xielai, et al. The effect of lead on intracellular Ca2+in mouse lymphocytes[J]. Toxicology in Vitro, 2008,22: 1815-1819.
[17]何建林, 郑仕中, 陆茵, 等. 癌细胞中钙离子通道的研究进展[J]. 中国 药理学通报, 2012, 28(7): 1027-1029.
[18]王海燕, 何韶衡, 林珏龙, 等. 激光扫描共聚焦显微镜观察胰蛋白酶对肺上皮细胞游离钙离子的影响[J]. 激光生物学报, 2005, 14(5):377-379.
[19]郭琼杰, 孙淑. 细胞内游离钙离子的测定方法[J]. 食品与药品, 2006,8(12): 25-27.
[20]BREITBRT H. Intracellular calcium regulation in sperm capacitation and acrosomal reaction[J]. Molecular and Cellular Endocrinology,2002, 187(1/2): 139-144.
