米糠甾醇对非酒精性脂肪性肝炎大鼠的治疗作用
2014-01-30王一然刘进辉刘湘新贺建华
王一然,贺 兰,刘进辉,徐 芳,刘湘新,贺建华*
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南农业大学动物科学技术学院,湖南 长沙 410128;3.益阳市赫山区沧水铺人民医院,湖南 益阳 413064; 4.湖南农业大学动物医学院,湖南 长沙 410128)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种由肝细胞脂肪变性发展到炎症、肝纤维化的一组疾病。随病程进展表现不一,包括单纯性脂肪肝(nonalcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化及其肝硬化和隐源性肝硬化3个阶段[1]。其中N ASH降低了同患心血管疾病的NASH患者的存活率,升高了同患Ⅱ型糖尿病的NASH患者罹患肝癌的风险[2],NAFL和NASH是一个连续病变过程,如在NASH形成前积极干预,可预防NASH的形成及减少肝纤维化及其相关肝硬化的发生。
植物甾醇及其衍生物广泛应用于食品与美容行业,因其明显的降脂降胆固醇作用,近年来更作为营养添加剂得到人们关注[3-4]。大量研究结果显示,植物甾醇具有预防和治疗心血管疾病作用,而非酒精性脂肪性肝病是导致心血管疾病的危险因素[5-6]。Xu Zuyuan等[7]研究发现apoE(-/-)小鼠在长期的植物甾醇处理下,能改变apoE(-/-)小鼠肝脏的基因表达,其作用机制可能与植物甾醇抑制胆固醇的吸收有关。Calpe-Berdiel等[8]用全基因组测序和聚合酶链式反应法研究了植物甾醇对apoE(-/-)小鼠的小肠和肝脏的作用,结果发现,所有类型小鼠的肠胆固醇吸收都有降低,而血浆胆固醇的降低只发生于apoE(-/-)和LDLR(-/-)小鼠。Hirai等[9]用雌性大鼠研究了膳食脂肪和植物甾醇对血清脂肪酸成分和脂蛋白胆固醇的影响,结果显示,添加5%植物甾醇到含10%黄油-胆固醇膳食里,减少了原有总胆固醇水平,升高了高密度脂蛋白与低密度脂蛋白+极低密度脂蛋白的比值。
米糠是稻谷加工的副产品,我国年产量约1000万t,居世界之首,但比起发达国家,我国米糠的经济利用效率仍有一定差距。米糠油比大豆油含有更丰富的植物甾醇,主要成分为谷甾醇、豆甾醇和菜油甾醇[10-11],米糠油提取的米糠植物甾醇具有众多生物活性作用,糠甾醇片也是我国特殊的牙科用药,可治疗牙周炎等牙疾病,具有良好消炎功效。鉴于米糠的上述作用和特性,课题组认为米糠甾醇(rice bran sterol,RBS)可能对非酒精性脂肪性肝炎大鼠具有干预治疗作用。
1 材料与方法
1.1 材料与试剂
体质量160~190g的健康成年雄性SD大鼠50只,购自长沙市开福区东创实验动物科技服务部(编号HNACSDC20120324;许可证号SCXK(湘)2009-0012)。
米糠甾醇(纯度:75%) 济宁安康制药有限责任公司。
造模用高脂饲料配方原料:基础饲料78.9%、猪油10%、全脂奶粉5%、蛋黄粉5%、胆固醇1%、猪胆盐0.1%。
基础饲料 长沙东创实验动物科技服务部;猪油自制;全脂奶粉 伊利实业集团股份有限公司;蛋黄粉:50%自制,50%购自吉林金翼蛋业有限责任公司;胆固醇(分析纯)、猪胆盐 北京索莱宝科技有限公司。
超氧化物歧化酶(superoxide dismutase,SOD)、一氧化氮合酶(nitric oxide synthase,NOS)试剂盒 南京建成生物工程研究所;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)检测试剂盒 深圳迈瑞生物医疗电子股份有限公司;谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)测试盒(自制)。
1.2 仪器与设备
KQ2200DV超声波仪 昆山市超声仪器有限公司;Thermo1510酶标仪 赛默飞世尔科技(中国)有限公司;BS200全自动生化分析仪 深圳迈瑞生物医疗电子股份有限公司;5417R低温高速离心机 美国Eppendorf公司。
1.3 方法
1.3.1 动物分组与处理
SD系雄性大鼠,随机分成5组,每组10只:Ⅰ组为正常对照组,Ⅱ组为NASH模型组,Ⅲ组、Ⅳ组和Ⅴ组分别为RBS低、中、高剂量组(65、130、195mg/kg)。美国食品药品监督总局推荐人每天至少摄入1.3g植物甾醇酯(0.8g植物甾醇)[12],实验组米糠甾醇低剂量根据此标准折算(0.8g/70kg×6)。适应性饲喂7d后开始造模,Ⅰ组饲喂普通饲料,Ⅱ、Ⅲ、Ⅳ、Ⅴ组饲喂高脂饲料,于造模日开始,Ⅰ组和Ⅱ组灌服2%吐温-80溶液,米糠甾醇各组灌服含2%吐温-80的米糠甾醇溶液干预,连续13周。
1.3.2 米糠甾醇溶液的制备
米糠甾醇不溶于水和油,为增加大鼠对米糠甾醇的吸收利用,用2%吐温-80溶液作为米糠甾醇溶剂。配制方法:精密称取所需剂量米糠甾醇粉末,放入研钵内不间断研磨20min后,边研磨边缓慢加入2%吐温-80溶剂,继续研磨至充分混匀。将充分研磨混匀的米糠甾醇溶液隔水放入超声波仪,超声0.5h,得米糠甾醇混悬液,冷藏保存,每天给大鼠灌胃前隔水加热至35℃,米糠甾醇溶液每3d配制一批。
1.3.3 标本的采集和处理
第13周周末最后一次灌胃后,禁食12h,称体质量。4%戊巴比妥钠腹腔注射麻醉,使用真空采血管进行心脏采血,解剖取肝脏、脾脏称质量。计算其肝脏指数和脾脏指数。
采集的血液放4℃冰箱冷藏过夜,低温离心机3500r/min离心10min,取上层血清放-70℃冷冻保存备用。肝脏在称质量后立即放入4%甲醛溶液固定保存,数周后用石蜡包埋切片,HE法染色,光镜下观察组织病理学变化。
1.3.4 指标测定
SOD、NOS:实验第13周周末,心脏采血,4℃、3500r/min离心15min,取上层血清,按试剂盒说明操作。
血清血脂指标检测:实验第13周周末,心脏采血,4℃、3500r/min离心15min,取上层血清,用全自动生化分析仪检测TC、TG、LDL-C和HDL-C含量。ALT、AST活力的测定按《基础生物化学实验方法和技术》[13]中方法检测。
1.3.5 数据处理方法
2 结果与分析
2.1 肝脏解剖结构观察
正常对照组肝脏表面光滑,颜色深红,边缘清晰。NASH模型组肝脏体积明显肿大,色泽灰黄,肉眼可见明显粗颗粒感,表面不光滑;米糠甾醇处理各剂量组肝脏的大体解剖结构相对于NASH模型组都有一定程度改善,但与正常对照组比较仍可见脂肪性病变。
2.2 肝脏组织学观察
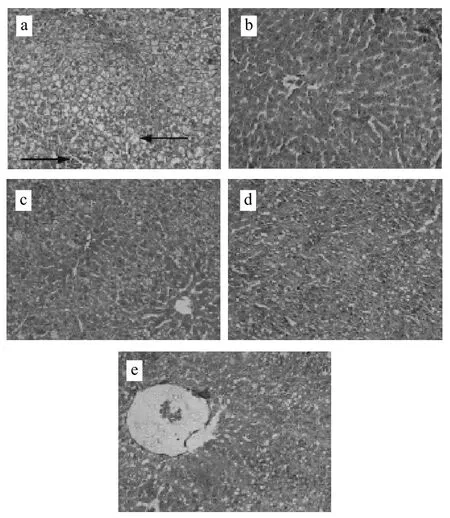
图1 肝脏组织形态结构(×220000)Fig.1 Morphological structure of liver tissue (×200)
如图1所示,图1a中可观察到炎症细胞聚集浸润(→);肝细胞明显变大肿胀,细胞内脂滴形成的空泡呈大囊泡性,且大囊泡已融合形成脂囊,胞浆内脂滴将肝细胞核挤至细胞边缘,部分细胞核裂解并可观察到肝细胞有气球样变形态(←),且细胞间无间隙。图1b中肝脏细胞形态结构正常,细胞核与胞浆完好,肝细胞索结构清晰完整,血窦清晰。图1c中米糠甾醇低剂量组大部分细胞形态正常,大多肝细胞胞浆清晰,可观察到的肝细胞脂肪空泡较少,未观察到炎症的聚集浸润;图1d中米糠甾醇中剂量组肝细胞脂肪变性程度明显低于NASH模型组,未观察到炎症的聚集浸润。图1e中米糠甾醇高剂量组肝细胞脂肪空泡较米糠甾醇低、中剂量组有所增加,但大部分脂肪空泡还未融合,细胞核形态正常可见,与图1a比较有明显差异。
2.3 各组大鼠血清相关酶活性测定结果

表1 米糠甾醇对血清酶活性指标的影响Table 1 Effect of RBS on serum enzyme activities
如表1所示,与正常对照组比较,NASH模型组ALT、AST极显著升高(P<0.001),AST/ALT比值极显著下降(P<0.001);与NASH模型组比较,米糠甾醇各剂量组ALT和米糠甾醇低、中剂量组AST显著降低(P<0.05,P<0.01,P<0.001),米糠甾醇各组AST/ALT比值明显升高(P<0.01,P<0.001)。与正常对照组比较,NASH模型组NOS和SOD酶活性显著升高(P<0.001,P<0.05);与NASH模型组比较,米糠甾醇低剂量组NOS和SOD显著降低(P<0.001,P<0.05)。
2.4 各组大鼠血清血脂含量测定结果
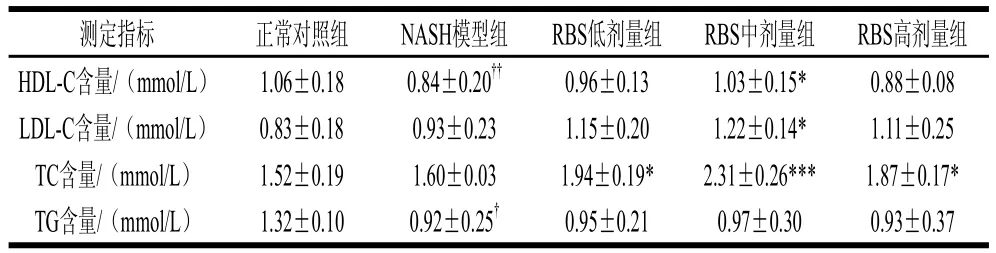
表2 米糠甾醇对大鼠血清血脂水平的影响Table 2 Effect of RBS on serum lipids concentration in rats
如表2所示,与正常对照组比较,NASH模型组HDL-C显著降低(P<0.01),与NASH模型组比较,米糠甾醇各组HDL-C均有升高,中剂量组有统计学意义(P<0.05);实验发现,在大鼠非酒精性脂肪性肝病肝炎阶段,NASH模型组LDL-C和TC水平与正常 对照组相比无统计学差异,而米糠甾醇中剂量组LDL-C水平和米糠甾醇各剂量组TC水平与NASH模型组比较显著升高(P<0.05,P<0.001);NASH模型组TG水平低于正常对照组(P<0.05),米糠甾醇各剂量组与模型组比较稍有升高,但无统计学意义。
2.5 各组大鼠肝脏指数和脾脏指数测定结果
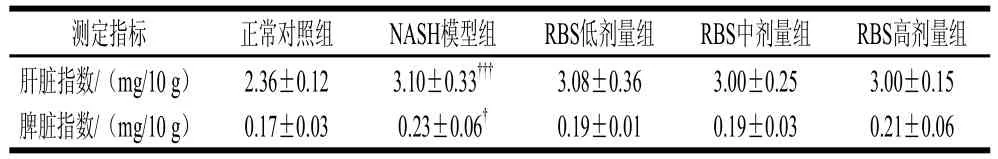
表3 米糠甾醇对大鼠器官指数的影响Table 3 Effect of RBS on organ indexes of rats
如表3所示,NASH模型组肝脏指数和脾脏指数,与正常对照组比较都显著升高(P<0.001和P<0.05),米糠甾醇各剂量组的肝脏指数和脾脏指数与NASH模型组比较均有下降,但无统计学意义。
3 讨 论
3.1 米糠甾醇对高脂饲喂大鼠肝脏组织显微结构的影响
肝脏是脂类代谢的重要器官,它在脂类的吸收、运输、合成、贮存、分解等过程中均起到重要的作用。长期摄入高脂肪、高热量饮食会导致肝脏脂肪代谢紊乱,严重的脂肪肝可发展为脂肪性肝炎、肝纤维化、肝硬变。连续13周给与大鼠高脂饲料后,肝脏组织显微组织结果显示:正常对照组肝脏细胞形态结构正常,细胞核与胞浆完好,肝细胞索结构清晰完整,血窦清晰。NASH模型组肝脏脂肪变性严重,肝细胞明显变大肿胀,细胞内有大量的脂滴形成的空泡,同时有炎症细胞的聚集浸润和部分肝细胞坏死。给予米糠甾醇的各干预组肝细胞脂肪病变明显改善,大部分细胞呈小泡性脂肪变性,无炎症的聚集浸润。说明采用米糠甾醇干预后,可明显减轻由高脂饮食导致的脂肪肝病变,减缓大鼠非酒精性脂肪肝病病程。
3.2 米糠甾醇对高脂饲喂大鼠ALT和AST活性的影响
ALT主要存在于肝细胞浆内,其细胞内浓度高于血清中1000~3000倍。只要有1%的肝细胞坏死,就可以使血清酶增高1倍。因此,ALT被世界卫生组织推荐为肝功能损害最敏感的检测指标[14]。造模13周后,NASH模型组ALT活性大大升高,与正常对照组比较,差异极显著(P<0.001)。米糠甾醇低、中、高剂量组ALT活性虽然都高于正常对照组,但大大低于NASH组,二者差异极显著(P<0.001)。AST主要存在于肝细胞线粒体内,当肝脏发生严重坏死或破坏时,才能引起AST在血清中浓度偏高。造模13周后,NASH模型组AST活性升高,与正常对照组比较差异极显著(P<0.001),说明长期饲喂高脂饲料,可导致肝细胞严重的损伤。米糠甾醇低、中剂量组AST活性低于NASH模型组,二者差异极显著(P<0.01,P<0.001),但米糠甾醇高剂量组AST水平高于NASH模型组(P<0.05),其原因还需进一步讨论。与NASH模型组比较,米糠甾醇各组AST/ALT比值均显著升高(P<0.01,P<0.001),一般认为正常范围内,AST/ALT比值越大,肝脏越健康[15]。实验结果表明:一定剂量范围内的米糠甾醇能显著降低高脂大鼠血清中ALT和AST活性,对高脂饲喂下的大鼠肝脏细胞具有明显的保护作用。
3.3 米糠甾醇对高脂饲喂大鼠肝脏指数和脾脏指数的影响
NASH组大鼠肝脏指数和脾脏指数都比正常对照组显著升高(P<0.001和P<0.05),肝脏质量显著升高,符合NASH病症特点,作为主要免疫器官之一的脾脏,其质量增加原因可能是由肝脏损伤累及或肝脏炎症引起的免疫应答所致,米糠甾醇各剂量组脏器指数比NASH模型组均有下降,但差异无统计学意义。
3.4 米糠甾醇对高脂饲喂大鼠SOD和NOS活性的影响
实验结果表明:NASH模型组血清SOD值与正常对照组比较显著升高(P<0.05),此结果与Zhao Jiasheng等[16]的研究结果一致,NASH大鼠血清SOD值显著升高可能是由肝细胞坏死破损后大量SOD溢出入血所致;同时某些疾病也会导致血清抗氧化指标升高,如机体炎症和免疫反应,会产生大量超氧自由基,诱导抗氧化酶的生成[17],说明在肝炎阶段,机体需要更多抗氧化酶来抵御氧化损伤。米糠甾醇低剂量组血清SOD值比NASH模型组显著降低(P<0.05),中、高剂量组也有所下降,提示米糠甾醇还具有消炎和/或清除自由基作用。NO在免疫系统中发挥对抗细菌、病毒、肿瘤细胞等病原体的作用,但过量的NO也会起到毒性作用。内毒素、细胞因子等能够诱导巨噬细胞等吞噬细胞激活NOS,合成大量NO。NASH模型组血清NOS水平比正常对照组显著上升(P<0.001),说明NOS参与了NASH的形成发展。米糠甾醇低剂量组NOS水平(29.21±5.09)U/mL比NASH组显著降低(P<0.001),甚至低于正常对照组水平(30.18±9.36)U/mL。而血清NOS的升高与降低在NAFLD病程不同阶段对机体具体起到何种作用,还需进一步研究。
3.5 米糠甾醇对高脂饲喂大鼠血脂的影响
HDL-C被称为“好胆固醇”,有抗动脉粥样硬化等作用,NASH模型组血清HDL-C比正常对照组显著降低(P<0.01),HDL-C的降低是糖尿病、肝炎和肝硬化等疾病的典型病症;米糠甾醇中剂量组血清HDL-C比NASH组显著升高(P<0.05),已接近正常对照组水平,说明该组与NASH模型组比较,清除外周胆固醇的能力增加。NASH模型组血清LDL-C水平和TC水平与正常对照组比较无显著差异,NASH模型组血清TG水平比正常对照组显著降低(P<0.05)。理论上来说,高脂饲料饲喂进行造模时,NASH模型组其血清TG和TC指标应该高于正常对照组,但据资料报道[18],高脂高胆固醇饮食模型造模过程中,早期各项血脂指标逐步上升,一般在第28天左右出现高峰值,后期可能保持一段时间的稳定,之后会随着时间的延长而降低。当脂肪性肝病进一步发展到肝硬化时,各项血脂水平下降越明显,说明肝脏病变越严重[19]。本研究结果与张志平等[20]研究结果相似,NASH模型组大鼠血清TG水平与正常对照组比较有所下降。本实验时间为91d,肝脏显微结构观察显示NASH模型组肝脏脂肪变性严重,伴随有炎症细胞的聚集浸润和部分肝细胞坏死,这可能会导 致肝脏其合成TC和TG的能力降低,因此也就导致了NASH模型组TC和TG水平与正常对照组比较无差异甚至反而降低的结果,但具体原因还需要进一步研究。米糠甾醇各剂量组血清TG水平与NASH模型组比较无显著差异,说明米糠甾醇对TG无明显干预作用。米糠甾醇各剂量组LDL-C和TC显著高于NASH模型组(P<0.05,P<0.001),此结果进一步提示米糠甾醇对大鼠非酒精性脂肪性肝病可能起到了延缓病程发展的作用。一定剂量范围内的米糠甾醇能有效预防大鼠非酒精性脂肪性肝炎。
[1]FARRELL G C, LARTER C Z. Nonalcoholic fatty liver disease: from steatosis to cirrhosis[J]. Hepatology, 2006, 43(Suppl 1): 99-112.
[2]DOWMAN J K., TOMLINSON J W, NEWSOME P N. Pathogenesis of non-alcoholic fatty liver disease[J]. QJM, 2010, 103: 71-83.
[3]LING W H, JONES P J H. Dietary phytosterols: a review of metabolism, benefits and side effects[J]. Life Sci, 1995, 57: 195-206.
[4]PIIRONEN V, LINDSAY D G, MIETTINEN T A, et al. Plant sterols:biosyn-thesis, biological function and their importance to human nutrition[J]. Sci Food Agric, 2000, 80: 939-966.
[5]SILBERNAGEL G, GENSER B, NESTEL P, et al. Plant sterols and atherosclerosis[J]. Curr Opin Lipidol, 2013, 24(1): 12-17.
[6]THIRUVAGOUNDER M, KHAN S, SHERIFF D S. Non-alcoholic fatty liver disease (NAFLD) - is it an emerging risk factor for coronary artery disease?: preliminary study in a local indian population[J].Sultan Qaboos Univ Med J, 2010, 10(2): 221-226.
[7]XU Z, LE K, MOHAMMED M H. Long-term phytosterol treatm ent alters gene expression in the liver of apo E-deficient mice[J]. Journal of Nutritional Biochemistry, 2008, 19: 545-554.
[8]CALPE-BERDIEL L, ESCOLÀ-GIL J C, RIBAS V, et al. Changes in intestinal and liver global gene expression in response to a phytosterolenriched diet[J]. Atherosclerosis, 2005, 181(1): 75-85.
[9]HIRAI K, OHNO Y, NAKANO T, et al. Effects of dietary fats and phytosterol on serum fatty acid composition and lipoprotein cholesterol in rats[J]. J Nutr Sci Vitaminol (Tokyo), 1984, 30(2): 101-112.
[10]DERAKHSHAN-HONARPARVAR M, HAMEDI M M, KH M, et al.Rice bran phytosterols of three widespread iranian cultivars[J]. Agr Sci Tech, 2010, 12: 167-172.
[11]周宝兰. 米糠油甾醇组成的研究[J]. 中国粮油学报, 1990, 5(1): 28-35.
[12]Federal register 65 FR food labeling: health claims; plant sterol/stanol esters and coronary heart disease. Interim final rule[S]. 2000.
[13]崔喜艳. 基础生物化学实验方法和技术[M]. 北京: 中国林业出版社,2008: 136-139.
[14]CHANG Y, RYU S, SUNG E, et al. Higher concentrations of alanine amino-transferase within the reference interval predict nonalcoholic fatty liver disease[J]. Clin Chem, 2007, 53: 686-692.
[15]由宏, 郝睿, 赵公玲, 等. 白萝 卜提取物对大鼠非酒精性脂肪肝的药效作用[J]. 食品科学, 2011, 32(7): 300-304.
[16]ZHAO Jiasheng, ZHU Fengshang, LIU Su, et al. Pioglitazone ameliorates nonalcoholic steatohepatitis by down-regulating hepatic nuclear factor-kappa B and cyclooxygenases-2 expression in rats[J].Chin Med J, 2012, 125(13): 2316-2321.
[17]蔡艳俊, 许昶, 牛俊奇, 等. 超氧化物歧化酶在乙型肝炎中的临床意义[J]. 白求恩医科大学学报, 1994, 20(6): 591.
[18]张红星, 王琼, 乐薇, 等. 高脂血症大鼠模型建立的动态研究[J]. 湖北中医药大学学报 2011, 13(1): 19-22.
[19]JIANG Ming, LIU Fei, XIONG Wujun, et al. Combined MELD and blood lipid level in evaluating the prognosis of decompensated cirrhosis[J]. World J Gastroenterol, 2010, 16(11): 1397-1401.
[20]张志平, 尤婷婷, 邹丽宜, 等. 复方丹参合剂对长期脂肪乳剂灌胃诱发的大鼠非酒精性脂肪肝病的影响[J]. 南方医科大学学报, 2008,28(7): 1109-1113.
