非诺贝特保护非酒精性脂肪性肝病小鼠胰岛素抵抗作用机制的探讨
2014-01-30沈馨茹鲁云霞
沈馨茹,鲁云霞,章 秋
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指以除外酒精或其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征。近年来,随着人们生活水平的提高和生活方式的改变,NAFLD的发病率逐年上升,已成为最常见的慢性肝脏疾病[1]。NAFLD除了可直接导致失代偿期肝硬化、肝细胞癌和移植肝复发外,还可影响其他慢性肝病的进展,并参与2型糖尿病和动脉粥样硬化的发病过程[2]。NAFLD的重要病理学特征之一是胰岛素抵抗[3],近年来文献[4]报道其可能与内质网应激(endoplasmic reticulum stress,ERS)有关。非诺贝特是目前临床上较为常用的调脂药物,其作用机制可能与降脂、抗炎和抗氧化应激等有关,但尚无其参与ERS的相关报道[5]。由于非诺贝特的药效学效应较明确,该研究先用模拟人类高热量高胆固醇饮食(high-calorie and high-cholesterol diet,HCD)的比例制作的饲料诱导构建NAFLD小鼠模型,然后给予单一剂量的非诺贝特干预,初步探讨其保护作用是否与改变过氧化物酶体增殖物激活受体α(peroxisome proliferator-acivated receptor α,PPARα)以及ERS标志蛋白葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)和转录因子GADD153(CCAAT/enhancer-binding protein homologous protein,CHOP)的表达有关。
1 材料与方法
1.1 实验动物 8周龄C57BL/6小鼠36只,清洁级,雄性,体重20~25 g,由安徽医科大学实验动物中心提供,每笼6只,温度20~25℃,相对湿度35% ~60%,自由摄食饮水,常规饲养1周后实验。
1.2 主要试剂 非诺贝特(江苏神龙药业有限公司);油红 O(美国 Sigma公司);RNAiso Reagent、Real-time PCR试剂盒(大连宝生物工程有限公司);RT试剂盒(美国Fermentas公司);BCA蛋白定量试剂盒(上海生工生物工程有限公司);3-磷酸甘油醛脱氢酶(GAPDH)鼠单克隆抗体(康为世纪生物技术有限公司);兔抗鼠 PPARα、CHOP一抗(美国 Santa Cruz公司);兔抗鼠 GRP78一抗(美国 Abcam公司);山羊抗兔及山羊抗鼠辣根过氧化物酶抗体(武汉博士德生物技术有限公司);ECL增强型发光剂(美国Pierce公司);RIPA裂解液(碧云天生物技术研究所)。
1.3 造模与分组 将C57BL/6小鼠随机分为正常饮食组(SCD组,n=10)和HCD组(n=26),SCD组给予标准饲料喂养(安徽医科大学动物实验中心提供,总热量14.5 kJ/g,含66.9%碳水化合物,24.8%蛋白质,8.3%脂肪);HCD组给予高热量高胆固醇饲料喂养(由20%猪油,20%蔗糖,10%蛋黄粉,1%胆固醇和49%基础饲料混合压制成型),12周后取体重明显增加的小鼠20只随机分为HCD组(n=10)和HCD+非诺贝特组(HCF组,n=10),HCD组继续予以HCD喂养2周,HCF组在给予HCD的同时予以非诺贝特40 mg/(kg·d)灌胃治疗2周。
1.4 葡萄糖耐量试验(GTT)和胰岛素耐量试验(ITT) 小鼠禁食12 h后,灌胃给予葡萄糖2 g/kg,分别于0、30、60、90、120 min 鼠尾采血测定血糖水平,行GTT;小鼠禁食4 h后,腹腔注射胰岛素0.1 U/kg,分别于 0、30、60、90、120 min 采血测定血糖值,行ITT。采血量约5 μl,采血过程中小鼠生命体征平稳。
1.5 血清学检测 所有小鼠禁食12 h,CO2窒息处死,摘眼球取血,3 000 r/min离心5 min,分离血清,检测血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartic transaminase,AST)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)水平。
1.6 HE和油红O染色 将肝组织经4%多聚甲醛固定后进行石蜡包埋,5 μm切片,HE染色,200倍光镜下观察并采集图像。将肝组织进行冰冻切片,厚约5 μm,60%异丙醇中稍洗,油红O染色约1 h,60%异丙醇洗去多余染液,苏木精染核,甘油明胶封片,400倍光镜下观察并采集图像。
1.7 实时荧光定量PCR TRIzol法抽提肝脏组织总RNA,2 μg总RNA经逆转录合成cDNA第一链,采用Primer 5.0软件设计引物。PPARα上游:5'-ACGATGCTGTCCTCCTTGATG-3',下 游:5'-GTGTGATAAAGCCATTGCCGT-3';GRP78上游:5'-TGTGGTACCCACCAAGAAGTC-3',下游:5'-TTCAGCTGTCACTCGGAGAAT-3';CHOP上游:5'-ATATCTCATCCCCAGGAAACG-3',下游:5'-TCTTCCTTGCTCTTCCTCCTC-3';GAPDH上游:5'-TGTGTCCGTCGTGGATCTGA-3',下游:5'-CCTGCTTCACCACCTTCTTGAT-3'。在StepOnePlus(美国ABI公司)上进行扩增,94℃预变性4 min,94 ℃变性15 s,60 ℃ 40 s,共40个循环,用比较Ct法(ΔΔCt法)分析结果。
1.8 Western blot 各组肝脏组织50 mg,RIPA裂解液抽提总蛋白,BCA法测蛋白浓度,12%SDSPAGE凝胶电泳,转移到PVDF膜上,封闭后分别用抗 GAPDH(1 ∶800)、PPARα (1 ∶800)、GRP78(1∶600)和CHOP(1∶1 000)一抗4℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔或抗鼠二抗室温孵育1 h,加入ECL发光剂反应5~10 min,暗室显影成像,实验重复3次。
1.9 统计学处理 采用SPSS 13.0软件进行统计分析,数据以±s表示,多组间比较采用单因素方差分析,两组间比较用SNK-q检验。
2 结果
2.1 非诺贝特对NAFLD小鼠胰岛素抵抗的影响GTT结果表明:HCD组小鼠空腹血糖值比SCD和HCF组高,注射葡萄糖30 min后血糖达到峰值,且明显高于SCD和HCF组,此后下降缓慢,血糖波动大;与HCD组相比,HCF组血糖波动较平稳,且峰值明显低于HCD组。ITT结果表明:在注射胰岛素30 min内,SCD组小鼠血糖迅速下降,随后缓慢上升,HCD组血糖下降缓慢,且始终维持在较高水平;HCF组各时间点的血糖值介于SCD和HCD组之间,见图1。
表1 3组小鼠的血液生化指标变化(n=10,±s)
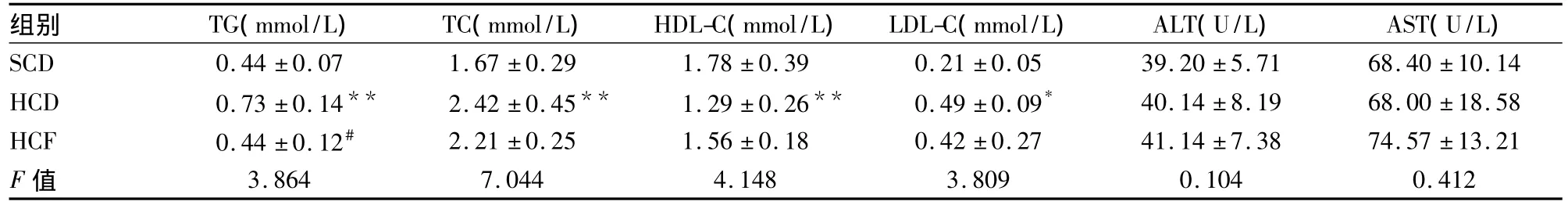
表1 3组小鼠的血液生化指标变化(n=10,±s)
与SCD组比较:*P<0.05,**P<0.01;与HCD组比较:#P<0.05
SCD 0.44 ±0.07 1.67 ±0.29 1.78 ±0.39 0.21 ±0.0539.20 ±5.71 68.40 ±10.14 HCD 0.73 ±0.14** 2.42 ±0.45** 1.29 ±0.26** 0.49 ±0.09* 40.14 ±8.19 68.00 ±18.58 HCF 0.44 ±0.12# 2.21 ±0.25 1.56 ±0.18 0.42 ±0.27 41.14 ±7.38 74.57 ±13.21 F值3.864 7.044 4.148 3.809 0.104 0.412
2.2 非诺贝特对NAFLD小鼠血清生化指标的影响 如表1所示,与SCD组小鼠相比,HCD组小鼠血清TG、TC、LDL-C水平显著升高,HDL-C水平明显下降,差异有统计学意义(P<0.01,P<0.05);与HCD组比较,HCF组中TG下降明显,差异有统计学意义(P<0.05);ALT和AST水平在3组间的差异均无统计学意义(P>0.05)。

图1 各组小鼠GTT和ITT
2.3 非诺贝特对NAFLD小鼠肝脏组织病理学的影响 SCD组小鼠肝细胞形态正常,胞质清晰;HCD组可见肝细胞内有大小不等的脂滴形成,肝细胞有气球样变,中央静脉处有炎性细胞浸润;而HCF组肝细胞脂肪变性程度及炎性细胞浸润较HCD组明显减少;油红O染色同样表明了HCD组肝细胞内的脂滴明显多于SCD组,而HCF组肝细胞内脂滴明显减少。见图2。
2.4 非诺贝特对PPARα、GRP78和CHOP mRNA水平表达的影响 Real-time PCR结果表明,与SCD组比较,HCD组小鼠肝脏组织内 PPARα、GRP78 mRNA表达量明显降低,而CHOP mRNA表达量明显升高(P<0.05);非诺贝特干预后能够显著增加肝脏组织内的PPARα、GRP78 mRNA的表达量,减少CHOP mRNA的表达量(P<0.05),见图3。
2.5 非诺贝特对PPARα、GRP78和CHOP蛋白水平表达的影响 Western blot结果表明,与SCD组相比,HCD组小鼠肝脏组织表达的PPARα、GRP78蛋白水平显著下降,CHOP的蛋白表达量明显升高(P<0.05);非诺贝特干预后PPARα、GRP78的蛋白水平表达显著上升,CHOP的蛋白表达量明显下调(P<0.05),见图4。

图2 各组肝组织病理学情况
3 讨论
NAFLD是一种与胰岛素抵抗和遗传易感性密切相关的代谢应激性肝病,包含了一系列肝脏损伤状态,包括单纯性脂肪肝(simple steatosis,SFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)及其最后的肝硬化和肝纤维化。本次研究采用高热量高胆固醇饲料喂养小鼠12周,HCD组小鼠血清的TG、TC、LDL-C水平显著升高,HDL-C水平明显下降;病理学检测显示HCD组小鼠肝细胞内有大小不等的脂滴形成,肝细胞部分气球样变,局部有炎性细胞浸润,表明已成功建立了NAFLD模型。

图3 非诺贝特对各组小鼠肝脏组织PPARα、CHOP、GRP78 mRNA表达水平的影响

图4 非诺贝特对各组小鼠肝脏组织PPARα、GRP78、CHOP蛋白表达水平的影响
非诺贝特是PPARα的特异性激动剂,具有抗氧化应激、抑制炎症反应、抗凋亡等作用,可降低2型糖尿病血管并发症的风险[6-8]。本实验采用该药治疗时,显示非诺贝特可明显降低NAFLD小鼠的血清TG水平,减少肝细胞内的脂滴,表明非诺贝特能够降低血脂和减轻肝脏脂肪沉积。然而,ALT和AST水平在3组小鼠间的差异无统计学意义,之前曾有文献[9]报道59%的脂肪肝患者血清ALT是正常的,这些患者肝脏活检证实还未进展至NASH阶段,本次研究结果与其基本一致。
内质网是真核细胞内重要的细胞器,在维持细胞内稳态的平衡方面具有重要作用,当内质网稳态被破坏时,将会导致ERS,而已知ERS在NAFLD的发生发展中扮演相当重要的角色[10]。GRP78是内质网中最重要的分子伴侣之一,可参与新生多肽链的折叠、装配和转运,研究[11]表明在ERS的早期,GRP78的表达迅速增加,可帮助变性蛋白重新折叠,恢复蛋白质的正确构象,减轻ERS,同时将无法恢复的蛋白质转移降解,从而避免细胞进一步受到伤害。然而,持续过强的应激将会使内质网自稳态功能受到严重损害,GRP78合成减少,同时CHOP的表达明显增加,从而启动细胞内的凋亡通路,使细胞死亡[12]。本研究中非诺贝特能明显激活PPARα的表达,从而通过增加肝组织中TG的氧化分解来起降脂作用;另一方面通过增加GRP78的表达、降低CHOP的表达来减轻ERS进而激活下游的胰岛素信号通路来改善胰岛素抵抗;但GRP78 mRNA和蛋白水平的改变不太一致,可能与其转录后模板降解增加有关,其具体原因有待后期的进一步深入研究。
本研究结果表明:非诺贝特有明显的改善NAFLD小鼠的胰岛素抵抗、降低TG的作用,可能与激活PPARα及减轻ERS有关。然而非诺贝特具体影响ERS下游的哪条信号通路还需要进一步的实验来证实,其机制的阐明将为非诺贝特开发作为治疗NAFLD的药物奠定基础。
[1]Tiniakos D G,Vos M B,Brunt E M.Nonalcoholic fatty liver disease:pathology and pathogenesis[J].Annu Rev Pathol,2010,5:145-71.
[2]Adams L A,Waters O R,Knuiman M W,et al.NAFLD as a risk factor for the development of diabetes and the metabolic syndrome:an eleven-year follow-up study[J].Am J Gastroenterology,2009,104(4):861-7.
[3]Cohen J C,Horton J D,Hobbs H H.Human fatty liver disease:old questions and new insights[J].Science,2011,322(6037):1519-23.
[4]Puri P,Mirshahi F,Cheung O,et al.Activation and dysregulation of the unfolded protein response in nonalcoholic fatty liver disease[J].Gastroenterology,2008,134(2):568 - 76.
[5]Michael S K,Anastazia K,Moses S E.Current role of fenofibrate in the prevention and management of non-alcoholic fatty liver disease[J].World J Hepatol,2013,5(9):470 -8.
[6]Vera T,Taylor M,Bohman Q,et al.Fenofibrate prevents the development of angiotensin Ⅱ-dependent hypertension in mice[J].Hypertension,2005,45(4):730-5.
[7]Miranda S,Gonzalez-Rodriquez A,Garcia-Ramirez M,et al.Beneficial effects of fenofibrate in retinal pigment epithelium by the modulation of stress and survival signaling under diabetic conditions[J].J Cell Physiol,2012,227(6):2352 -62.
[8]Walker A E,Kaplon R E,Lucking S M,et al.Fenofibrate improves vascular endothelial function by reducing oxidative stress while increasing endothelial nitric oxide synthase in healthy normolipidemic older adults[J].Hypertension,2012,60(6):1517 -23.
[9]Fracanzani A L,Valenti L,Bugianesi E,et al.Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels:a role for insulin resistance and diabetes[J].Hepathology,2008,48(3):792 -8.
[10]Abdelmalek M F,Diehl A M.Nonalcoholic fatty liver disease as a complication of insulin resisitance[J].Med Clin North Am,2007,91(6):1125-49.
[11]Hotamisligi G S.Endoplasmic reticulum stress and the inflammatory basis metabolic disease[J].Cell,2010,140(6):900 -17.
[12]Tajiri S,Yano S,Morioka M,et al.CHOP is involved in neuronal apoptosis induced by neurotrophic factor deprivation[J].FEBS Lett,2006,580(14):3462 -8.
