外科治疗重症肌无力的临床分析
2014-05-18于在诚张仁泉王云海左剑辉
赵 元,于在诚,胡 旭,张仁泉,王云海,刘 伟,左剑辉
重症肌无力(myasthenia gravis,MG)是指乙酰胆碱受体抗体介导、细胞免疫依赖、补体参与、主要累及神经肌肉接头突触后膜的乙酰胆碱受体的获得性自身免疫性疾病。约80%的MG患者伴有胸腺瘤或胸腺增生,胸腺组织的病理改变被认为是MG发病的重要原因,因而胸腺切除术在MG的治疗中有重要的地位[1]。但MG患者术后容易出现肌无力症状加重,甚至发生肌无力危象。现回顾性分析在我院行外科治疗的52例MG患者的术后疗效及后危象发生的危险因素。
1 材料与方法
1.1 一般资料 收集2008年5月~2013年5月在我院行胸腺切除术的MG的患者52例,其中男21例,女31例,年龄19~63(42.5±6.2)岁。患者均根据临床症状、新斯的明试验阳性或肌电图递减试验阳性明确诊断。
1.2 术前患者病情及分型 患者术前病程为6个月~5年,平均20.3个月。患者术前均须口服溴吡斯的明控制症状,服用剂量在90~480 mg/d,其中2例患者术前口服激素治疗,6例患者术前1~2个月接受过甲泼尼龙冲击治疗。MG患者病情根据改良Osseman分型,Ⅰ型(单纯眼肌型)3例,Ⅱa型(轻度全身型)29例,Ⅱb型(中度全身型)15例,Ⅲ型(急性爆发型)3例,Ⅳ型(迟发重症型)2例。
1.3 手术方法 患者均采用全麻单腔气管插管。采用胸骨正中切口39例,胸腔镜手术13例。术中均完整切除瘤体及侵犯周围组织,并对纵隔脂肪组织完整清扫。纵隔脂肪组织清除上方应达甲状腺下极水平,下方达膈肌顶水平,两侧达膈神经水平。术中切除组织均送检病理。
1.4 疗效判定 按照Papatestas外科治疗效果判定标准进行术后疗效判定,有效率为缓解和改善的总和与总例数之比。
1.5 统计学处理 采用SPSS 17.0统计软件分析,对术后肌无力危象发生的危险因素先进行单因素分析,计数资料进行χ2检验,计量资料进行t检验,对有统计学意义的因素再进行多因素Logistic回归分析。
2 结果
全组无手术死亡病例。术后出现肺部感染9例(合并肌无力危象7例),均行气管切开加强抗感染治疗后痊愈;肌无力危象13例,其中10例行气管切开。术后病理检查证实胸腺增生17例,胸腺瘤33例,其中恶性胸腺瘤2例。术后疗效判定,缓解15例,改善26例,无变化8例,恶化3例,总有效率为78.8%。本组患者有13例行胸腔镜手术,其中缓解6例,改善7例,均未发生明显并发症。
肌无力危象为MG手术后常见的严重并发症,根据术后患者有无危象发生,分为发生危象组13例和未发生危象组39例。对一些可能影响术后肌无力危象发生的因素进行单因素分析。从术前分型方面分析,重型患者(Ⅱb、Ⅲ型及Ⅳ型)较轻型(Ⅰ型、Ⅱa型)术后更易发生危象,且差异有统计学意义(P<0.01)。从患者的术前病程方面看,术后发生危象组要长于未发生危象组,且差异有统计学意义(P<0.01)。从术前病程长短方面分析,术后发生危象组的用量明显高于未发生危象组,且差异有统计学意义(P<0.05)。从有无合并胸腺瘤来看,两组的差异也有统计学意义(P<0.01)。而手术方式、年龄及性别方面,两组间差异无统计学意义。单因素分析可见Osseman分型、术前病程长短、术前溴吡斯的明用量及是否合并胸腺瘤是术后肌无力危象发生的相关危险因素。见表1。对单因素分析得出的可能影响因素:Osserman分型、病程长短、术前溴吡斯的明用量及合并胸腺瘤进入多因素Logistic回归分析,结果分别为(OR值,P值):12.367,0.009;8.135,0.015;15.367,0.006;27.087,0.003。由此可见,上述4项均是术后危象发生的独立相关危险因素。
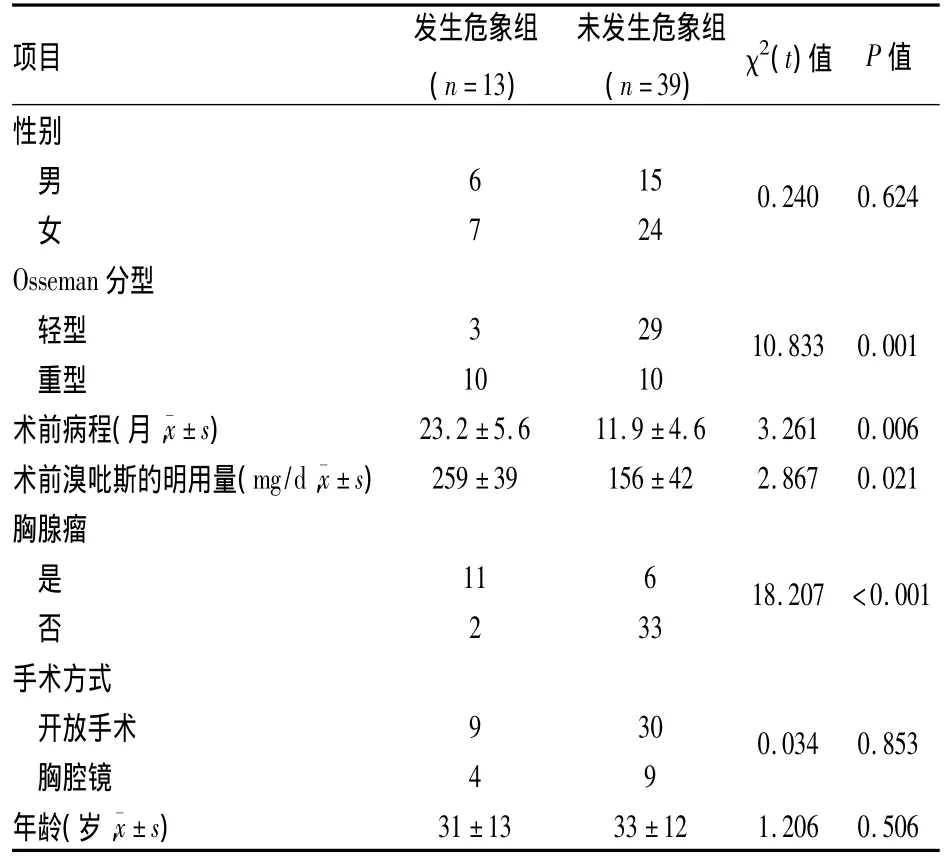
表1 术后危象发生的单因素分析
3 讨论
3.1 手术适应证及时机 胸腺切除术是治疗MG较为有效的方法。一般认为18~55岁的全身型或和并胸腺瘤的MG患者,若无其他手术禁忌,应尽早考虑手术治疗[2]。手术前应当将患者的病情控制相对稳定,选择在患者症状较轻,服药量相对较少时进行。重症患者应待药物治疗病情缓解后手术,这样可以提高手术安全性及术后近、远期疗效[3]。MG患者接受肾上腺皮质激素治疗一般1~2周后症状开始减轻,术前用量宜调节在较低水平或待停药后1个月再行手术,以减少不良反应。
3.2 手术方式的选择 目前,MG的胸腺切除术的手术路径有胸骨正中劈开切口、胸骨部分劈开切口、颈部切口以及近年来兴起的胸腔镜手术。以往报道[4]表明在胸骨正中切口行胸腺扩大清扫术的效果最为理想。该术式便于完整切除胸腺及纵隔内的脂肪组织。近年来有报道[5-6]采用电视胸腔镜手术取得同胸部正中切口相近的效果,而且具有缩短住院时间,减少并发症等优势。
3.3 围术期处理 术前口服抗胆碱酯酶类药物采用少量多次的办法,每次口服剂量不宜超过60 mg,术后24 h应当给予术前日用量的一半,而重症患者则应按术前剂量给予,之后根据患者的病情调整药物的增减,这对于术后肌无力危象的预防有一定的好处。对于重型患者和合并有胸腺瘤的患者,应当先采取积极的内科治疗控制症状,必要时采取激素冲击或免疫抑制剂治疗,待患者症状改善后再行手术治疗。对于MG患者术后需严格观察包括肌无力症状、肠鸣音状态及呼吸道分泌物等病情变化情况,及早发现术后危象并及时予以治疗。另外,对部分重症患者采用术毕延迟拔管的治疗措施,可有助于维持术后患者的呼吸功能,预防肌无力危象的发生,同时也降低了术后气管切开的风险。
3.4 术后危象发生的相关因素分析 术后危象是MG患者术后最严重的并发症,发生率为16% ~25%。大多数学者[2,7-8]认为 Osserman 分型是术后危象发生的重要预测因素。重症患者易出现呼吸肌无力,诱发呼吸困难,本身发生危象的可能性就较大。因此重症患者术后发生危象的概率要明显增加,对于此类患者术后应当高度关注。张海涛 等[7]研究提示术前病程长短也是术后危象发生的重要相关因素,这与本组病例的结果相同,这也提示尽早行手术治疗对有MG患者是有益的。另外,本研究也提示术前抗胆碱酯酶药物的用量大及合并有胸腺留也与术后的危象发生有关,Watanabe et al[8]研究也得出了类似的结果。
总之,外科治疗MG能够取得较为满意的效果。治疗成功的关键在于掌握正确的手术适应证,缩短术前病程;选择合理的手术方式完整切除胸腺;加强围术期管理,控制危象发生的相关危险因素。
[1]Gold R,Schneider-Gold C.Current and future standards in treatment of myasthenia gravis[J].Neurotherapeutics,2008,5(4):535-41.
[2]Diaz-Manera J,Rojas-Garcia R,Illa I.Treatment strategies for myasthenia gravis[J].Expert Opin Pharmacother,2009,10(8):1329-42.
[3]陈 力,杨双强.58例胸腺瘤合并重症肌无力的围手术期处理[J].重庆医学2008,37(13):1447 -9.
[4]Prokakis C,Koletsis E,Salakou S,et al.Modified maximal thymectomy for myasthenia gravis:effect of maximal resection on late neurologic outcome and predictors of disease remission[J].Ann Thorac Surg,2009,88(5):1638 -45.
[5]Lei Yu,Xiao-jun Zhang,Shan Ma,et al.Thoracoscopic thymectomy for myasthenia gravis with and without thymoma:a single-center experience[J].Ann Thorac Surg,2012,93(1):240 - 4.
[6]郭明发,徐美青,徐世斌,等.胸腔镜下扩大胸腺切除术治疗重症肌无力[J].安徽医科大学学报,2011,46(4):394 -5.
[7]张海涛,刘德若,郭永庆,等.外科治疗重症肌无力的疗效分析[J].中华外科杂志,2007,45(22):1546 -8.
[8]Watanabe A,Watanabe T,Obama T,et al.Prognostic factors for myasthenic crisis after transsternal thymectomy in patients with myasthenia gravis[J].J Thorac Cardiovasc Surg,2004,127(3):868-76.
