环化小檗碱类似物A55的抗肿瘤活性及其机制研究
2014-01-29赵午莉李阳彪何红伟宋丹青邵荣光
赵午莉 李阳彪 何红伟 宋丹青 邵荣光
小檗碱(berberine)又叫黄连素,为中药黄连中的主要生物碱。有多种药理作用,临床主要用于清热、解毒、抗肠道细菌抗感染以及糖尿病的治疗[1~3]。近年研究发现小檗碱(BBR)还具有抗肿瘤活性,体内外的抗肿瘤活性检测表明其能够特异性地抑制白血病、黑素瘤、表皮样癌、肝癌、口腔癌、恶性胶质瘤等癌细胞的增殖而不影响正常细胞的生长[4~8]。本研究所在长期进行小檗碱类衍生物的研究中,基于对相关有机反应的深刻理解,合成并构建了一类未见报道的全新化合物结构——环化小檗碱(CBBR),即在BBR分子中又骈合了一个芳香环。结构分析后发现CBBR不但与另一类具有显著抗癌作用的生物碱——苯骈菲里啶类化合物结构相似,而且本身还具备BBR的分子结构,因此我们推测CBBR有可能为一类具有较强抗肿瘤作用的化合物,初步研究结果表明其对HCT116细胞的IC50为1.0μmol/L左右。基于此,笔者以CBBR为先导化合物较为系统地合成了30个化合物并对其抑瘤率进行了检测,结果发现CBBR的8-位经基进行芳香酰化后,引入邻氟苯甲酰基合成的化合物A55具有更强的抗肿瘤活性,因此我们着重对A55的抗肿瘤活性以及其相应机制做了进一步的研究[9]。
材料与方法
1.细胞系及化合物:人肝癌细胞系 HepG2、SMMC7721、BEL7402、BEL7404、人乳腺癌细胞 MCF-7,人肺癌细胞系A549及人大肠癌细胞系HCT116和HT29由本实验室保存;环化小檗碱及合成的相应衍生物A10~A50由笔者单位合成,结构及其合成路线见参考文献[9]。
2.主要试剂:RPMI1640培养基(GIBCO);新生胎牛血清(Hyclone公司);SRB(sulforhodamine B,Sigma公司);PI(propidium iodide,Sigma公司);预染蛋白Marker(New England Biolabs公司);DNA拓扑异构酶Ⅰ(Topgen);质粒pBR322DNA(Takara);兔抗人抗体p-ATM、r-H2AX和Cleaved Parp等抗体购自Cell Signal Technology公司。
3.化合物对肿瘤细胞的抑制率及IC50的测定:在96孔板上孔接种不同的肿瘤细胞,24h后采用不同浓度的化合物进行增殖抑制实验。细胞增殖48h后,用50%三氯乙酸 (TCA)固定,并用SRB(0.4%)稀醋酸溶液染色。室温静置10min,未与细胞结合的SRB用1% 稀醋酸溶液5遍,空气干燥。结合的SRB用10mmol/L非缓冲Tris碱液(pH值10.5)振荡溶解,酶标仪测定各孔光吸收,测定波长为492nm。根据各孔OD值计算药物对细胞增殖的抑制率。计算公式为抑制率(%)=(1-化合物OD492/对照OD492)×100%。采用Sigmaplot计算化合物的IC50。
4.流式细胞仪测定方法:用0.2μg/ml的化合物A55处理HepG2细胞,分别在0、4、8、12和24h收集药物处理后的细胞,PBS洗两次,加入预冷的75%乙醇,-20℃固定过夜,离心除去乙醇,PBS洗两次,加入200μg/ml的RNA酶,37℃消化30min,加碘化丙啶(PI)25μg/ml,4℃避光染色30min后,流式细胞仪检测细胞周期变化[10]。
5.拓扑异构酶抑制实验:将1U扑异构酶Ⅰ和不同浓度的药物在37℃反应20min,再加入0.5μg的pBR322DNA在37℃继续反应 30min,加入 0.5% 的 SDS,0.25μg/μl的溴酷兰,15%的甘油终止反应。在TBE电泳缓冲液中进行琼脂糖电泳,40V电压下,电泳4h。溴化乙淀溶液染色30min,置于紫外线下观察DNA的电泳区带,并摄片记录。
6.Western blot:将 A55加入到 HepG2细胞中,使A55的终浓度达到1μg/ml,24h后取实验组和对照组细胞,加入细胞裂解液,提取细胞总蛋白,蛋白定量后加热变性。每组取40μg蛋白经10%的SDS-PAGE电泳分离后,采用半干转电转移将蛋白转移至PVDF膜上,5%脱脂奶粉封闭2h,加入一抗 (1∶1000)4℃ 孵育过夜,采用TBST洗膜5次,加入HRP标记二抗(1∶5000),室温下孵育1h,增强化学发光法(ECL)发光显色。以β-actin作为内参。
结 果
1.化合物 A55的抗肿瘤活性筛选:首先采用HCT116细胞对先导化合物CBBR及其30个衍生物(A10~A50)的抗肿瘤活性进行筛选,筛选浓度为3μg/ml。结果表明有15个化合物的抑制率达到了85%以上。接着采用0.5μg/ml的浓度对这15个化合物继续筛选。结果表明,化合物A55的抑制率最高,达到了90%左右,化合物A32和A45的抑制率分别为62%和68%,高于其他化合物。对化合物A55、A32和A45的IC50进行检测,结果表明其IC50分别为0.18 ±0.01、0.46 ±0.03 和 0.4 ±0.05μg/ml,A55 的活性最高。此后笔者选用A55(图1)对具其抗肿瘤活性进行了进一步的研究并初步探讨了其抗肿瘤机制。
2.A55对多种肿瘤细胞具有较强的抑制作用:笔者采用 BEL7402、BEL7404 SMC7721、HT29、A549 以及MCF-7等肿瘤细胞对环化小檗碱CBBR及其衍生物A55的IC50进行了检测,结果表明A55对多种类型的肿瘤均具有良好的抑制作用,抑制效果明显强于先导化合物CBBR,结果见表1和图2。

图2 A55对不同肿瘤细胞系的IC50
3.A55对拓扑异构酶Ⅰ具有较强的抑制作用:TopⅠ在体外可使DNA双链中的单链断裂,使另一单链从缺口处穿过,催化超螺旋的DNA松弛解旋。本实验中A55对拓扑异构酶Ⅰ的解螺旋活性抑制实验结果表明,A55在和pBR322DNA以及拓扑异构酶Ⅰ共同孵育时,可完全逆转拓扑异构酶Ⅰ对底物pBR322DNA的解螺旋作用,而其直接和底物pBR322DNA作用时,pBR322DNA并无明显的改变,因此我们认为A55可有效地抑制拓扑异构酶Ⅰ活性(图3)。
4.A55可将细胞周期阻滞于S期:为了进一步探化合物 A55的抗肿瘤机制,笔者检测了 A55对HepG2细胞周期分布的影响。结果表明,化合物A55作用于HepG2细胞4h后,细胞的周期开始阻滞于S期,并随着时间的增加,S期阻滞不断加强,到24h,阻滞达到最强(图4)。
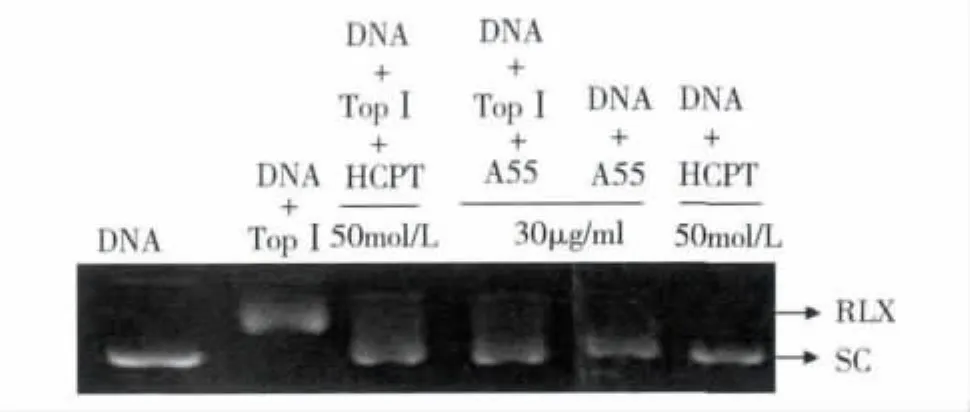
图3 A55对TopⅠ的抑制作用
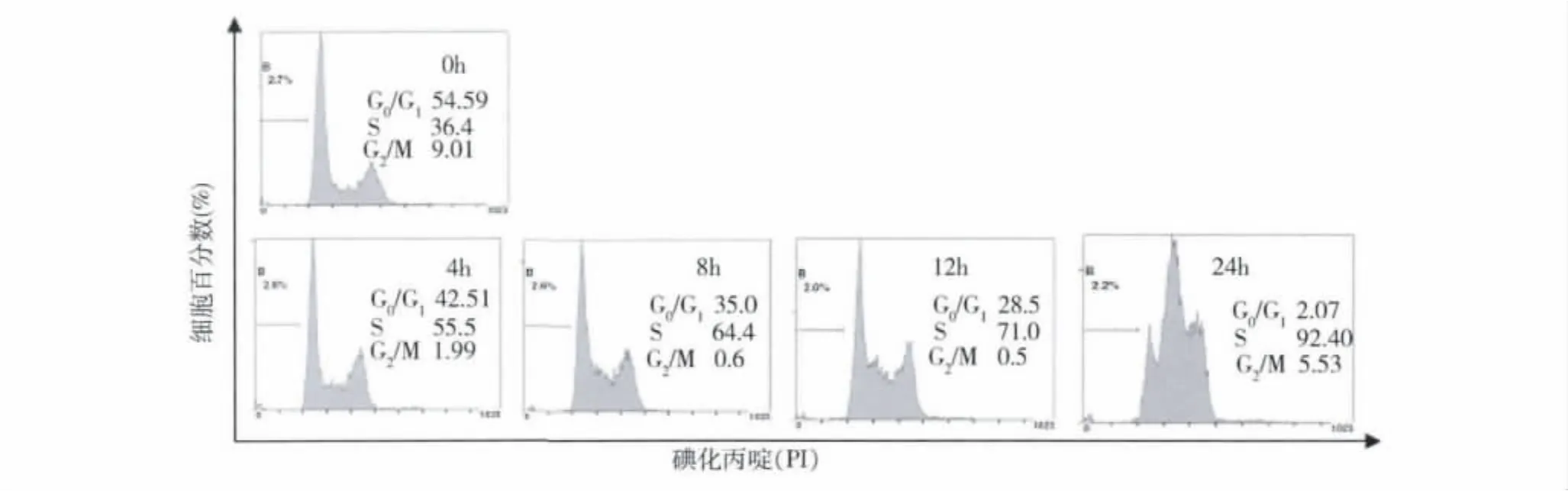
图4 A55对HepG2细胞周期分布的影响
5.A55通过促进 DNA链断裂引起凋亡:由于A55抑制了拓扑异构酶Ⅰ的活性,阻止了DNA断端的再连接,引起了DNA断裂和细胞凋亡。因此我们检测了A55处理细胞后细胞的凋亡以及与凋亡和DNA断裂相关蛋白的表达情况。结果表明,A55可明显引起HepG2细胞凋亡(图5A),如细胞核浓缩、碎裂及溶解等现象。Western blot结果表明,在A55作用于HepG2细胞24h后,与DNA断裂相关的蛋白p-ATM和 γ-H2AX明显增加,凋亡相关蛋白cleaved parp和cleaved caspase-3明显增加(图5B)。

图5 A55引起细胞凋亡并激活DNA修复通路
讨 论
拓扑异构酶Ⅰ是一种核酶,可松解DNA超螺旋,在DNA的复制、转录、重组和修复等重要过程中发挥重要的作用。研究发现,肿瘤细胞中TopⅠ的含量和活性要明显高于正常细胞,如果能选择性抑制TopⅠ的生理作用,便能有效抑制肿瘤细胞的DNA的复制和转录,从而引起细胞凋亡进而抑制细胞增殖[11]。因此,TopⅠ成为抗肿瘤药物作用的重要靶点。目前在临床使用和处于研发阶段的TopⅠ抑制剂主要包括喜树碱类(camptochecines)和吲哚并咔唑类(indolocarbazoles)等化合物但由于水溶性差、不良反应强以及耐药使得这些药物的应用受到了限制,因此开发结构新且药效强的新型抗肿瘤药物非常重要[12]。Li等[13]报道小檗碱能与TopⅠ结合,使S期细胞合成受阻,阻止细胞增殖。CBBR是一类全新结构骨架的化合物——环化小檗碱,由于其具有更好的平面性结构特征,更加容易嵌入双链DNA碱基对里,推测可能具有更好的抗肿瘤作用。采用HepG2细胞对CBBR 的 IC50检测,IC50在 1.2μmol/L 左右,活性显著强于BBR[9]。A55是在CBBR结构的基础上进行改造而形成的一类衍生物,即在CBBR的8-位经基进行芳香酰化,引入邻氟苯甲酰基。改造后的 A55对HCT116的抗肿瘤活性显著强于 CBBR,IC50达到了0.18μg/ml,对其他肿瘤的结果也表明其 IC50在1μg/ml左右,显示了良好的抗肿瘤活性。
在DNA复制过程中,拓扑异构酶Ⅰ在DNA双链上产生单链断裂,使另一单链从缺口处穿过,使得DNA从超螺旋变为疏松型,进而一些与DNA复制相关的酶结合到DNA上,启动了染色体的复制。拓扑异构酶抑制剂与拓扑异构酶结合后抑制了DNA拓扑异构酶的催化活性,使得断裂的DNA不能重新进行连接,进而导致 DNA链发生致命性的破坏,造成DNA损伤,从而激活DNA损伤检验点及相应的DNA损伤应答修复通路(DNA damage response,DDR)进行修复[14,15]。这些通路包括细胞内的感应器如 ATM的快速识别损伤,启动下游多种效应成分如H2AX及引起周期阻滞的蛋白通路,提供时间进行损伤修复。其中最为显著和具有标志意义的是H2AX的磷酸化,如损伤不能正确修复或不能修复,凋亡和非凋亡性死亡(apoptosisand non-apoptoticdeath)程序将被启动[16]。环化小檗碱衍生物A55在和拓扑异构酶Ⅰ以及底物DNA共同作用时可显著抑制拓扑异构酶Ⅰ的解螺旋作用,但其单独和超螺旋DNA反应并不影响pBR322DNA的构型改变,表明A55是通过抑制拓扑异构酶的活性来影响pBR322DNA的构型。由于拓扑异构酶Ⅰ活性受到抑制,使得DNA链在解旋后不能再连接而引起DNA断裂,因此我们观察到与DNA断裂相关的蛋白如ATM和H2AX被磷酸化激活。
细胞在进行DNA复制时,需要拓扑异构酶来解螺旋并在DNA复制结束后再改变双链DNA拓扑再形成超螺旋,因此拓扑酶在细胞的S期的活性和表达量最高,因此,当拓扑酶受到抑制时,细胞的DNA复制过程会严重受阻并使得细胞可能停滞在S期。本实验中,化合物A55通过主要通过抑制拓扑异构酶的活性而引起的DNA损伤的修复,周期分布实验也证实了细胞停滞在S期,这也同样与通过抑制拓扑异构酶Ⅰ的活性而致DNA损伤的羟基喜树碱衍生物引起的S期阻滞是一样的[17]。化合物A55具体是通过激活或抑制了哪些通路而导致了S期阻滞,今后我们也将进一步进行研究。肿瘤细胞在A55的持续作用下,由于修复不能完全进而活化了促使细胞凋亡的一系列酶如csapase-3,活化后的 csapase-3裂解了parp从而最终引起细胞凋亡。
总之,环化小檗碱衍生物A55是一类镖靶明确、结构新颖以及抗肿瘤活性强的新型抗肿瘤化合物,且本所可以自主合成开发。随着对其作用机制研究的逐渐深入,这一类从生物碱中发现高效低毒的抗肿瘤新药的前景将会更加广阔。
1 蔡少平,刘泽.黄连素抑制结肠癌细胞中PGE2表达作用的研究[J].中国医药学报,2004,19(2):95-97
2 丁阳平,叶小利,周洁,等.小檗碱衍生物合成及生理活性研究进展[J].有机化学,2012,32(4):677-685
3 赵午莉,李阳彪,李迎红,等.13-取代小檗碱衍生物的合成及其抗肿瘤活性研究[J].中国医药导报,2013,296(10):17-20
4 Eom KS,Hong JM,Youn MJ,et al.Berberine induces G1 arrest and apoptosis in human glioblastoma T98G cells through mitochondrial/caspases pathway[J].Biol Pharm Bull,2008,31(4):558-562
5 Hwang JM,Kuo HC,Tseng TH,et al.Berberine induces apoptosis through a mitochondria/caspases pathway in human hepatoma cells[J].Arch Toxicol,2006,80(2):62-73
6 Letasiova S,Jantova S,Cipak L,et al.Berberine-antiproliferative activity in vitro and induction of apoptosis/necrosis of the U937 and B16 cells[J].Cancer Lett,2006,239(2):254-262
7 Lin CC,Lin SY,Chung JG,et al.Down-regulation of cyclin B1 and up-regulation of Wee1 by berberine promotes entry of leukemia cells into the G2/M-phase of the cell cycle[J].Anticancer Res,2006,26(2A):1097-1104
8 Mantena SK,Sharma SD,Katiyar SK.Berberine inhibits growth,induces G1 arrest and apoptosis in human epidermoid carcinoma A431 cells by regulating Cdki-Cdk-cyclin cascade,disruption of mitochondrial membrane potential and cleavage of caspase 3 and PARP[J].Carcinogenesis,2006,27(10):2018-2027
9 Li YB,Zhao WL,Wang YX,et al.Discovery,synthesis and biological evaluation of cycloprotoberberine derivatives as potential antitumor agents[J].Eur J Med Chem,2013,68(10):463-472
10 Zhao W,He H,Ren K,et al.MR-1 blocks the megakaryocytic differentiation and transition of CML from chronic phase to blast crisis through MEK dephosphorylation[J].Blood Cancer J,2013,3(3):e107
11 郭晓鹏,冯思良,王金辉,等.拓扑异构酶1及其喜树碱类抑制剂的临床研究进展[J].国际药学研究杂志,2013,40(4):405-414
12 洪鸣凰,裴元英.羟喜树碱及其制剂的研究进展[J].中国临床药学杂志,2008,17(4):255-258
13 Li TK,Bathory E,LaVoie EJ,et al.Human topoisomerase I poisoning by protoberberines:potential roles for both drug-DNA and drug-enzyme interactions[J].Biochemistry,2000,39(24):7107-7116
14 马云彤.拓扑异构酶Ⅰ抑制剂介导的DNA损伤,修复和检验点应答[J].西安文理学院学报:自然科学版,2010,13(1):44-47
15 Winter E,Levy D,Gordon JS.Changes in the H-1 histone complement during myogenesis I.Establishment by differential coupling of H-1 species synthesis to DNA replication[J].J Cell Biol,1985,101(1):167-174
16 李俊英,张士猛,周平坤.H2AX磷酸化与去磷酸化的分子机制及其对 DNA损伤修复反应的调节作用[J].军事医学,2013,37(3):227-230
17 Veltkamp SA,Witteveen EO,Capriati A,et al.Clinical and pharmacologic study of the novel prodrug delimotecan(MEN 4901/T-0128)in patients with solid tumors[J].Clin Cancer Res,2008,14(11):7535-7544
