同型半胱氨酸对肝细胞增殖及CyclinD1、ALT和AST表达的影响*
2014-01-26杨晓玲曹成建姜怡邓
蔡 欣,杨晓玲,杨 程,曹成建,王 磊,田 珏,张 焱,姜怡邓△
(宁夏医科大学:1.检验学院;2.基础学院病理生理教研室;3.心血管疾病基础研究重点实验室;4.科技中心,宁夏银川 750004)
同型半胱氨酸对肝细胞增殖及CyclinD1、ALT和AST表达的影响*
蔡 欣1,杨晓玲2,3,杨 程1,曹成建1,王 磊1,田 珏2,3,张 焱4,姜怡邓2,3△
(宁夏医科大学:1.检验学院;2.基础学院病理生理教研室;3.心血管疾病基础研究重点实验室;4.科技中心,宁夏银川 750004)
目的探讨同型半胱氨酸(Hcy)对肝细胞增殖及细胞周期素D1(CyclinD1)、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)表达的影响。方法 将HL-7702细胞体外常规培养,分别用0、50、100、200、500μmol/L Hcy刺激细胞,分别于刺激后6、12、24h采用MTT法检测肝细胞的增殖情况;采用荧光定量PCR(RT-qPCR)检测CyclinD1mRNA的表达;采用微板法检测各组细胞培养液中ALT和AST的变化。结果不同浓度Hcy刺激肝细胞不同时间后,细胞的增殖受到抑制,其中100、200、500μmol/L Hcy组与对照组比较差异有统计学意义(P0.01),24h作用最明显;不同浓度 Hcy刺激肝细胞24h后,CyclinD1mRNA的表达显著下降(P0.01),细胞培养液中ALT和AST水平显著升高(P0.01)。结论Hcy可以抑制肝细胞增殖,并引起CyclinD1的mRNA表达下降,ALT和AST释放增多。
肝细胞;细胞增殖;同型半胱氨酸;细胞周期素D1;丙氨酸转氨酶;天冬氨酸氨基转移酶
同型半胱氨酸(homocysteine,Hcy)作为动脉粥样硬化(atherosclerosis,AS)的独立危险因子[1-2],其致 AS的机制有脂代谢紊乱、平滑肌细胞增殖、炎性反应等,其中脂代谢紊乱是重要环节[3]。Hcy属于氨基酸类物质,不直接参与脂代谢,因此Hcy如何能引起脂代谢紊乱,值得进一步研究。肝脏是机体脂质代谢的主要场所,肝细胞是肝脏的基本组成单位,当肝细胞数量减少或功能损伤时,就会引起肝脏脂质代谢紊乱及脂质在体内堆积[4],进而导致高脂血症,促进 AS的发生、发展[5]。体内Hcy的代谢主要在肝脏进行[6],但 Hcy对肝细胞数量和功能的影响目前研究尚不明确。本研究拟用不同浓度Hcy刺激肝细胞,分析Hcy对肝细胞增殖及细胞周期素D1(CyclinD1)、ALT和AST的影响。
1 材料与方法
1.1 材料 主要仪器:CO2培养箱(HF90,Heal Force);倒置显微镜(Nikon公司);高速低温离心机(Heraeus公司);酶标仪(Model680,Bio-Rad)。试剂:1640培养基、胎牛血清(Gibco,美国);青霉素-链霉素溶液(碧云天,江苏);PBS缓冲液、胰蛋白酶(吉诺,杭州);同型半胱氨酸、二甲基亚砜(DMSO)(Sigma,德国);MTT(凯基,南京);RNA 提取试剂 Trizol(Invitrogen,美国);逆转录试剂盒、SYBR实时定量PCR(RT-qPCR)Master Mix(全式金,北京);丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)试剂盒(建成生物,南京)。
1.2 方法
1.2.1 肝细胞的培养及分组 人肝细胞株HL-7702购于中南大学湘雅细胞库,肝细胞用含10% 胎牛血清的RPMI1640培养基培养,置于37℃、含5%CO2的培养箱中。当细胞密度达到80% 时,将细胞随机分为5组,分别用含0、50、100、200、500μmol/L Hcy的培养液刺激细胞,其中0μmol/L Hcy组为对照组,将各组细胞置CO2培养箱中培养24h后收集细胞,用于后续指标的检测。
1.2.2 MTT检测 常规培养人肝细胞至细胞密度达到80%时,用0.25% 胰蛋白酶消化细胞1min,然后加入含10% 胎牛血清的RPMI1640培养基重悬,以50μL/孔的细胞重悬液接种于96孔板中,在37℃、5%CO2培养箱中培养24h,吸出各孔内的培养液,换成含0、50、100、200、500μmol/L Hcy的培养液继续培养,分别于6、12、24h后,加入50μL MTT工作液,置于培养箱中4h,然后小心吸出上清液,每孔加入150μL DMSO,震荡10min使结晶充分溶解,用酶标仪在490nm处检测各孔的光密度(OD)。细胞增殖率(%)=(加药细胞OD/对照细胞OD)×100%。
1.2.3 RT-qPCR检测 用Trizol提取各组细胞的总RNA,核酸分析仪分析纯度后,选取260nm和280nmOD值之比(OD260/OD280)为1.7~1.9的RNA用于实验。根据公布的CyclinD1(GenBank No.49457150)序列用Premier 5.0设计引物,上 游:5′-GTC GCT GGA GCC CGT GAA-3′,下 游:5′-CGG ATG GAG TTG TCG GTG TAG-3′,扩增产物长度为132bp。GAPDH 上游:5′-AGA AGG CTG GGG CTC ATT TG-3′,下游:5′-AGG GGC CAT CCA CAG TCT TC-3′,扩增产物长度为146bp。按逆转录试剂盒说明书合成cDNA并取产物3μL,在 PCR管内加入SYBR RT-qPCR Master Mix 12.5μL,上、下游引物各0.5μL,加去离子水使整个反应体系为25μL,设定PCR的条件:94℃预变性5min,94℃变性30s,56℃退火30s,72℃延伸30s,扩增40个循环。根据公式计算结果:目的基因的相对量=2-△△Ct,Ct为热循环仪检测到反应体系中荧光信号的强度值,△△Ct=[Ct(待测样品)-Ct GAPDH(待测样品)]-[Ct(校正样品)-Ct GAPDH(校正样品)]。校正样品是任何被选做代表1倍目的基因表达量的样品。
1.2.4 细胞培养液ALT和AST水平的检测 将细胞分为对照组及50、100、200、500μmol/L Hcy组,置37 ℃、5%CO2培养箱中培养24h后收集各组细胞培养液,按试剂盒说明书要求,先将基质液置37℃预温,加入待测样本后反复吹打混匀,37℃水浴30min,然后分别加入2,4-二硝基苯肼液和0.4 mol/L氢氧化钠溶液,轻轻水平摇动96孔板混匀,室温放置15min,使用酶标仪在510nm处检测每孔的OD值(绝对OD值=测定孔OD值-对照孔OD值),根据标准曲线,计算ALT/AST活力单位。
1.3 统计学处理 采用Prism5.0统计软件进行分析,计量资料以±s表示,两样本均数间比较采用Student′st检验,多样本均数间比较采用One-way ANOVA检验,组间两两比较采用Student-Newman-Keuls检验,以P0.05为差异有统计学意义。
2 结 果
2.1 Hcy各浓度在不同时间对肝细胞增殖的影响 不同浓度的Hcy刺激肝细胞后,肝细胞的增殖均受到抑制,且随着Hcy浓度的增加,肝细胞增殖率降低,其中100、200、500μmol/L Hcy组肝细胞的增殖率与对照组比较显著下降(P0.01),见表1。Hcy作用肝细胞6、12、24h后,细胞的增殖受到抑制,其中24h组肝细胞的增殖率显著下降,与6、12h相应组比较差异有统计学意义(P0.01)。
2.2 细胞增殖相关基因CyclinD1mRNA的变化 CyclinD1 mRNA检测的结果和MTT结果基本一致。与对照组比较,各Hcy组CyclinD1表达随Hcy浓度的增加而降低,50μmol/L Hcy组CyclinD1mRNA水平为对照组的71.51%(P0.05);100、200、500μmol/L Hcy组 CyclinD1mRNA水平分别为对照组的 50.33%、41.33%、29.97%,差异有统计学意义(P0.01),见图1、2。
表1 各组肝细胞增殖率比较(±s,n=5,%)

表1 各组肝细胞增殖率比较(±s,n=5,%)
a:P 0.01,与对照组比较;b:P0.05,c:P 0.01,与同组6h比较;d:P0.05,与同组12h比较。
组别6h 12h 24h对照组1.18±0.08 1.75±0.04 1.77±0.03 50μmol/L Hcy组 1.78±0.05 1.73±0.04 1.71±0.03 100μmol/L Hcy组 1.43±0.02a 1.36±0.04ab 1.09±0.04acd 500μmol/L Hcy组 1.09±0.01a 1.03±0.08ab 0.64±0.02acd

图1 各组肝细胞CyclinD1mRNA表达的扩增曲线

图2 各组肝细胞CyclinD1mRNA表达比较
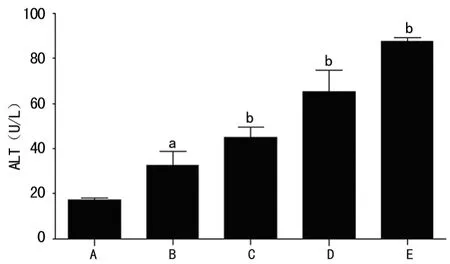
图3 各组肝细胞培养液中的ALT水平比较
2.3 细胞培养液ALT和AST水平的检测 与对照组比较,
各Hcy组ALT和AST水平随Hcy浓度的增加而增加,50 μmol/L Hcy组的肝细胞上清液中ALT水平为对照组的1.90倍(P0.05);100、200、500μmol/L Hcy刺激后,ALT水平分别是对照组的2.61、3.80、5.10倍,差异有统计学意义(P0.01)。AST水平在100、200、500μmol/L Hcy组也分别是对照组的3.28、4.36、5.97倍,差异有统计学意义(P0.01),见图3、4。
3 讨 论
肝脏是全身脂代谢最重要的器官,也是合成和降解Hcy的主要部位,当肝细胞受损时,会引起脂质代谢紊乱和Hcy在体内聚积,进而导致高脂血症和高Hcy血症,促进AS的发生、发展。研究发现,Hcy与多种肝脏疾病密切相关,Hcy可诱导肝脏氧化应激,促进炎症细胞浸润并降低大鼠肝脏糖原/糖蛋白水平[7],在非酒精性脂肪肝疾病(NAFLD)患者血浆中 Hcy水平较正常人显著升高,推测Hcy可能通过影响肝脏功能引起AS。肝细胞是肝脏最基本的结构和功能单位,当肝细胞受到各种因素刺激或损伤后致其细胞数量减少时,可进一步引起肝细胞功能降低。Xagorari等[8]证实急性肝损伤后细胞数量明显下降,肝脏可出现凋亡;有研究报道肝癌病程进展中肝细胞的存活率显著下降[9-10]。
本实验结果显示,50μmol/L Hcy对肝细胞增殖没有明显抑制作用,而100、200、500μmol/L Hcy在体外能显著抑制肝细胞的增殖,使肝细胞数量减少。由于高浓度的Hcy具有细胞毒性,可以导致细胞凋亡[11],因此在本研究中,当Hcy浓度超过50μmol/L后,所测得细胞增殖率下降的原因除了与细胞增殖受到抑制有关,也有可能是高浓度Hcy诱导了细胞凋亡所致,为了尽量降低Hcy的细胞毒性对实验结果的影响,本研究在能引起肝细胞增殖率明显下降的Hcy浓度中挑选最小剂量,即100μmol/L用于后续实验研究。Hcy作用肝细胞24h后,肝细胞的增殖率明显降低,与6、12h比较,差异有统计学意义(P0.01)。因此,可以将100μmol/L Hcy作用 HL-7702细胞24h用于Hcy对肝细胞影响的研究,这为后续进一步分析Hcy对肝细胞结构和功能的作用奠定了基础。
CyclinD1基因由染色体11q13上CCND1基因编码,是Cyclins家族成员之一,属细胞周期正调控因子。CyclinD1促使细胞从G期顺利进入S期,使细胞发生分裂和增殖[12],其表达受到抑制时会造成细胞增殖率的下降。CyclinD1与肝脏疾病的发生、发展密切相关,李启炯等[13]研究证实,CyclinD1在肝细胞癌中表达升高,是肝细胞肝癌预后的独立危险因素。本实验结果显示,随着 Hcy浓度增加,100、200、500μmol/L Hcy组CyclinD1mRNA水平逐渐下降,与肝细胞的增殖率变化趋势一致。本研究结果进一步提示,不同浓度Hcy引起细胞增殖率的下降可能与抑制细胞增殖有关,但不能排除细胞凋亡在其中也起一定作用。
目前,临床常用于判断肝脏疾病诊断与预后的血清学指标主要包括ALT和AST[14]。ALT和AST作为肝细胞功能损害最敏感最常用的检测指标,主要存在于肝细胞的细胞质内,当肝细胞受损时就会释放入血,导致血清中的ALT和AST水平大幅度上升。本实验结果显示,100、200、500μmol/L Hcy组细胞培养液中ALT和AST水平明显升高,表明Hcy能够损伤肝细胞使其功能降低,提示Hcy对肝细胞增殖率的影响可能会进一步导致肝细胞功能的下降。
综上所述,Hcy可抑制肝细胞增殖,同时引起CyclinD1的mRNA表达下降以及肝细胞功能的降低。肝细胞凋亡是否在其中起一定作用有待进一步研究。本研究结果为进一步揭示Hcy促进AS的机制提供了新思路。
[1] Castro R,Rivera I,Blom HJ,et al.Homocysteine metabolism,hyperhomocystenemia and vascular disease:an overview[J].J Inherit Metab Dis,2006,29(1):3-20.
[2] 薛莉,陈树兰,贾绍斌,等.同型半胱氨酸与冠心病的相关性及其机制探讨[J].中华心血管病杂志,2002,30(9):520-524.
[3]Jiang Y,Zhang H,Sun T,et al.The comprehensive effects of hyperlipidemia and hyperhomocysteinemia on pathogenesis of atherosclerosis and DNA hypomethylation in ApoE-/-mice[J].Acta Biochim Biophys Sin,2012,44(10):866-875.
[4] Park O,Wang H,Weng H,et al.In vivo consequences of liver-specific interleukin-22expression:implications for human liver disease progression[J].Hepatology,2011,54(1):252-261.
[5] 李薇,杜军保.动脉粥样硬化发病机制研究进展[J].实用儿科临床杂志,2009,24(1):520-524.
[6] Medici V,Peerson JM,Stabler SP,et al.Impaired homocysteine transsulfuration is an indicator of alcoholic liver disease[J].J Hepatol,2010,53(3):551-557.
[7] MattéC,Stefanello FM,Mackedanz V,et al.Homocysteine induces oxidative stress,inflammatory infiltration,fibrosis and reduces glycogen/glycoprotein content in liver of rats[J].Int J Dev Neurosci,2009,27(4):337-344.
[8] Xagorari A,Siotou E,Yiangou M,et al.Protective effect of mesenchymal stem cell-conditioned medium on hepatic cell apoptosis after acute liver injury[J].Int J Clin Exp Pathol,2013,6(5):831-840.
[9] Tao GZ,Lehwald N,Jang KY,et al.Wnt/β-Catenin Signaling Protects Mouse Liver against Oxidative Stress-induced Apoptosis through the Inhibition of Forkhead Transcription Factor FoxO3[J].J Biol Chem,2013,288(24):17214-17224.
[10]Zhao J,Han SX,Ma JL,et al.The role of CDK1in apoptin-induced apoptosis in hepatocellular carcinoma cells[J].Oncol Rep,2013,30(1):253-259.
[11]Wang X,Cui L,Joseph J,et al.Homocysteine induces cardiomyocyte dysfunction and apoptosis through p38MAPK-mediated increase in oxidant stress[J].J Mol Cell Cardiol,2012,52(3):753-760.
[12]王前,邓晶,蒋永新,等.CyclinD1的研究进展[J].现代肿瘤医学,2009,17(2):350-353.
[13]李启炯,宋军民,陆敏,等.CyclinD1在肝细胞癌中的表达与肝细胞癌患者预后的关系[J].中华临床医师杂志:电子版,2012,6(2):355-360.
[14]Park O,Wang H,Weng H,et al.In vivo consequences of liver-specific interleukin-22expression:implications for human liver disease progression[J].Hepatology,2011,54(1):252-261.
Effect of homocysteine on proliferation and expression of CyclinD1,ALT and AST in hepatic cells*
ObjectiveTo explore the effects of homoysteine(Hcy)on the proliferation of hepatic cells and the expression of CyclinD1,ALT and AST.MethodsHL-7702hepatic cells were routinely cultured in vitro and irritated with Hcy at a concentration of 0,50,100,200,500μmol/L,respectively.The proliferation of hepatic cells was measured by MTT at 6,12,24hafter irritation.The expression of CyclinD1mRNA was detected by quantitative reverse transcription polymerase chain reaction(RT-qPCR).The changes of ALT and AST in the cells culture medium of each group were determined by the microplate method.ResultsThe proliferation of hepatic cells was inhibited by different concentrations of Hcy,in which the proliferation rates irritated by Hcy at the concentrations of 100,200,500μmol/L were lower than that in control group with statistical difference(P0.01),and the effect was most markedly at 24hafter irritation(P0.01);compared with the control group,when hepatic cells were irritated by Hcy at the concentrations of 100,200,500μmol/L for 24h,the mRNA expression of CyclinD1was decreased(P0.01),meanwhile the levels of ALT and AST were significantly increased(P0.01).ConclusionHcy can inhibit the proliferation of hepatic cells,cause the decrease of CyclinD1mRNA expression and result in the increase of ALT and AST release.
hepatocytes;cells proliferation;homocysteine;CyclinD1;alanine transaminase;aspartate aminotransferases
10.3969/j.issn.1671-8348.2014.12.020
A
1671-8348(2014)12-1468-03
* 基金项目:国家自然科学基金资助项目(81260063、81260105、81160044)。
蔡欣(1987-),在读硕士研究生,主要从事动脉粥样硬化的分子生物学诊断研究工作。△
,Tel:(0951)6980998;Email:jiangyideng123@163.com。
2013-11-18
2013-12-26)
•短篇论著•
