TNF-α、MMP-2及VEGF在大隐静脉曲张形成中的作用
2014-01-21雷跃华冯会和付召君杨玉辉
张 陈,雷跃华,李 曦,冯会和,付召君,魏 健,杨玉辉,王 勇
(自贡市第四人民医院,四川自贡643000)
大隐静脉曲张血管形成是发生于曲张大隐静脉中平滑肌细胞和细胞外基质等主要成分的结构改变,是静脉血管壁组织系统适应来自各种病理状态所发生的自身代偿的结果。肿瘤坏死因子α(TNF-α)、基质金属蛋白酶2(MMP-2)及血管内皮细胞生长因子(VEGF)在大隐静脉的形成中具有重要作用。本研究通过检测曲张大隐静脉组织标本中TNF-α、MMP-2、VEGF 的表达,探讨三者在大隐静脉曲张形成中的作用。现报告如下。
1 资料与方法
1.1 临床资料 选择2012年1~12月我院收治的大隐静脉曲张患者40例,男27例、女13例,年龄35~75岁、平均59岁。均符合《黄家驷外科学》(第8版)、《外科学》(第8版)中的诊断标准,排除有活动性下肢溃疡并感染、深静脉血栓,伴严重心、脑、肺疾病,伴糖尿病及其他系统感染者。根据曲张静脉管壁厚度分为萎缩(管壁厚度<409 μm)组17例,增生(管壁厚度≥409 μm)组23例。选择同期需要移植使用的、外伤需截肢的15例正常大隐静脉血管作为对照组,患者男9例、女6例,年龄15~72岁、平均51岁。
1.2 方法
1.2.1 标本制作及 TNF-α、MMP-2、VEGF 表达检测
采用无损伤原则保护切取的静脉血管标本(曲张静脉切取明显迂曲扩张部及扩张部中间之血管壁),常规固定包埋,HE染色,切成5~8 μm厚的切片,组织切片完全脱蜡和水化后,用PBS冲洗。微波修复抗原,加过氧化物酶阻断反应,非特异性动物血清封闭,再分别滴加一抗[TNF-α(1∶100)、MMP-2(1∶100)、VEGF(1∶100)]和生物素标记的二抗,室温下孵育10 min后PBS冲洗。加链霉素菌抗生物素蛋白—过氧化物酶,室温下孵育10 min,PBS冲洗,DAB显色,苏木素复染,中性树脂封片,光学显微镜下观察。
1.2.2 评定标准 采用定位定性法,即定位在高倍镜下观察一张切片5个视野,取平均值,对染色强度和范围进行定性分级,细胞核内出现棕黄色颗粒为阳性细胞,细胞质显色的不计数。观察视野中100个细胞中的阳性细胞数。评定标准:细胞无着色为0分;细胞呈淡黄色,阳性细胞数≤25%,计1分;细胞深黄色,阳性细胞>25% ~50%,计2分;细胞呈棕黄色,阳性细胞>50%,计3分。
1.2.3 统计学方法 采用SPSS17.0统计软件,计数资料比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 TNF-α、MMP-2、VEGF 在不同组织中的表达TNF-α、VEGF、MMP-2在曲张静脉血管细胞核内呈棕黄色颗粒;在正常静脉血管细胞中无着色,或细胞核内呈淡染棕黄色颗粒。
2.2 各组 TNF-α、VEGF、MMP-2 阳性表达情况比较 见表1。
3 讨论
大隐静脉曲张的形成主要原因是静脉壁软弱、静脉瓣膜缺陷及静脉内压升高,TNF-α、MMP-2、VEGF在大隐静脉的形成中具有重要作用。TNF-α具有广泛的生物学作用,包括抗肿瘤、细胞免疫调节、细胞调亡、细胞毒性等。TNF-α主要由激活的巨噬细胞和某些肿瘤细胞合成,通过与其自身受体结合发生信号传递,促使细胞内蛋白磷酸化和脱磷酸化,激活NF-κB产生生物学效应。TNF-α高表达可引起组织细胞出血、坏死,还可与诱导炎性细胞因子的释放、刺激异常血管增生。研究证实,TNF-α具有双重的生物学作用[1]:正常水平的TNF-α可以调节免疫应答、抗感染、促进组织修复、引起细胞凋亡等,但大量产生和释放则会破坏机体的免疫平衡,产生多种病理损伤。TNF-α能刺激其他细胞因子如IL-4、IL-6等释放,扩大其效应,介导创伤后细胞炎性反应,促进静脉曲张急性期蛋白的合成。这些介质导致细胞内皮损伤,诱导中性粒细胞分裂、迁移、黏附和浸润,并可诱导其脱颗粒反应和溶酶体酶释放,从而导致过度的炎症反应,促使静脉曲张形成或加重。
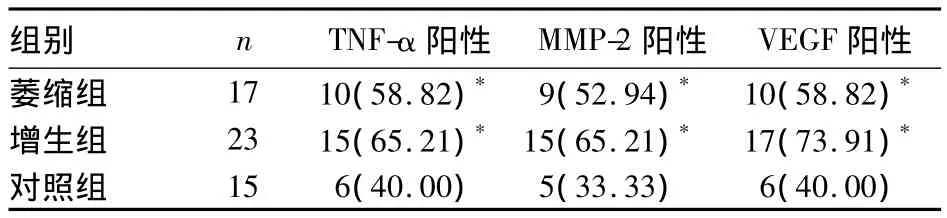
表1 各组TNF-α、VEGF、MMP-2阳性表达情况比较[例(%)]
MMP是降解细胞外基质的蛋白酶类家族中最重要的一类,存在于正常人体中,参与机体多种生理及病理过程,如伤口愈合、新生血管形成、肿瘤侵润及转移、炎症反应等[2]。MMP-2定位于细胞穿透基质的突出上,其对血管内皮细胞的趋化、迁移和增生起关键作用。路艳等[3]发现,去除了MMP-2基因的小鼠角膜血管生长面积明显小于对照组,表明MMP-2能促进新生血管形成。本研究结果显示,MMP-2在正常静脉组织中有一定表达,而在曲张静脉组织中细胞质、细胞核都表达明显,与文献[4,5]报道相符。MMP-2的高表达可抑制蛋白酶的活性,有利于结缔组织的沉积,从而增加静脉壁的厚度[6,7]。因此判断MMP-2对静脉曲张的病理过程有重要推动作用。
VEGF是惟一作用于血管内皮细胞的生长因子,有很强的促进血管内皮细胞有丝分裂、内皮细胞增殖、迁移和增强血管通透性的作用[8~10]。其主要作用是刺激血管内皮细胞分泌蛋白酶和蛋白酶原活化因子,导致血管基底膜降解,细胞随之进入周围的基质,发生迁移、增生,形成一个新的血管形成区域。有学者发现,新生血管中 VEGF水平增高,认为VEGF是一个有效的内源性血管因子。VEGF通过与细胞膜上的 VEGF受体相结合发挥作用,而VEGF受体广泛分布于血管内皮细胞中,因此,VEGF作为与血管病理生理改变过程相关的内源性生成因子[11],对静脉曲张的形成有促进作用。本研究显示,VEGF在对照组和曲张组均有表达,在后者为高度表达,光镜下提示VEGF在上皮、内皮细胞上都有表达,与文献报道[12,13]一致。Meslri对 VEGF的表达作用进行干预,发现新生细胞逐渐衰退,调亡,说明VEGF是一种特异性促进血管内皮细胞有丝分裂、对血管细胞存活起主要调控作用的因子。
综上所述,TNF-α、MMP-2、VEGF 在大隐静脉曲张形成的病理过程中起到重要的免疫调节作用,对静脉曲张的发生发展过程中起推动作用。
[1]王亚平.尖锐湿疣患者治疗前后血清 TNF-α、IL-6、IL-8、IL-10检测的临床意义[J].放射免疫学杂志,2007,20(6):525-526.
[2]Raffetto JD,Khalil RA.Matrix metalloproteinases and their in-hibitors in vascular remodeling and vascular disease[J].Biochem Pharmacol,2008,75(2):346-359.
[3]路艳,张春艳,王聪霞,等.高糖对MMP-2与TIMP-2的表达及血管平滑肌细胞增殖的影响[J].西安交通大学学报(医学版),2012,11(3):58-61.
[4]Lim CS,Davies AH.Pathogecsis of primary varicose veins[J].Br J Surg,2009,96(11):1231-1242.
[5]Raffetto JD,Qiao X,Koledova VV,et al.Prolonged increases in vein wall tension increase matrix metalloproteinases and decrease constriction in rat vena cava:potential implications in varicose veins[J].J Vasc Surg,2008,48(2):447-456.
[6]Aravind B,Saunders B,Navin T,et al.Inhibitory effect of TIMP Influences the morphology of varicose veins[J].Eur J Vasc Endovasc Surg,2010,40(6):754-765.
[7]王涛,王国华,徐永波,等.曲张大隐静脉管壁病理形态学特征研究[J].中国普外基础与临床杂志,2011,18(6):663-665.
[8]陀泳华,郭小磊,文军,等.CGRP与VEGF对内皮细胞成血管的作用比较研究[J].中国矫形外科杂志,2012,18(10):64-68,107.
[9]张璐.VEGF诱导血管新生的新通路[J].生理学进展,2011,9(6):82.
[10]徐海涛,张庆广.VEGF及其受体KDR在肿瘤血管生成中的作用[J].滨州医学院学报,2010,33(2):131-132.
[11]王国华,李凤臣,徐兵,等.滋养血管在下肢静脉曲张管壁病理学变化的研究[J].中国普外基础与临床杂志,2013,18(8):919-921.
[12]段泽星,谢立群.VEGF在肿瘤生长和血管生成中的作用[J].世界华人消化杂志,2010,18(27):2894-2900.
[13]马跃东,李德华.VEGF在心血管疾病治疗作用的研究进展[J].中国老年学杂志,2011,15(9):211-213.
