新辅助化疗对宫颈癌患者OPN和MMP-9表达的影响
2014-01-21张玲玲李广起刘书斌赵伟珠
张玲玲,李广起,赵 靓,刘书斌,赵伟珠
(滨州市人民医院,山东滨州256610)
宫颈癌是妇科常见的恶性肿瘤,许多患者确诊时已处于晚期,手术效果不佳,易转移及复发。近年研究显示,术前行新辅助化疗可缩小肿瘤体积和范围,且可控制术中、术后医源性转移,为手术切除创造良好的条件。骨桥蛋白(OPN)是一种分泌型钙结合型磷酸化糖蛋白,可以特异性结合与细胞黏附有关的氨基酸序列,通过与其受体结合,可以增强细胞的趋化、黏附和迁移能力,促进肿瘤细胞的侵袭和转移[1]。基质金属蛋白酶-9(MMP-9)可以降解细胞外基质和基底膜,增强肿瘤性血管的生成,从而促进肿瘤细胞的侵袭和转移[2]。本研究观察了新辅助化疗对宫颈癌患者肿瘤组织中OPN和MMP-9表达的影响,并探讨二者的表达与化疗效果的关系。
1 资料与方法
1.1 临床资料 选择2010年12月~2013年12月我院收治的宫颈癌患者81例,年龄26~68(42.9±8.1)岁。均经HE切片复读确认,未接受过手术或化放疗。宫颈癌临床分期按FIGO(1995年)标准,Ⅱa期24例,Ⅱb期29例,Ⅲa期16例,Ⅲb期10例,Ⅳ期2例。
1.2 方法
1.2.1 治疗方法 化疗前12 h及6 h分别给予地塞米松20 mg,化疗前30 min静滴奥美拉唑40 mg+苯海拉明50 mg。化疗方案采用紫杉醇联合顺铂,先给予紫杉醇135~175 mg/m2滴注3 h,随后顺铂50~75 mg/m2滴注,3周为一疗程,共治疗2个疗程。
1.2.2 检测方法 新辅助化疗前行宫颈组织活检,化疗后手术取活组织进行检测,标本用10%甲醛固定,石蜡包埋,切4 μm厚的石蜡切片,65℃烘烤,脱蜡,采用免疫组织化学染色SP法测定OPN和MMP-9的表达。根据切片染色程度和阳性细胞数所占百分比综合计分。染色强度:细胞无显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数所占百分比:阴性为0分,阳性细胞数≤10%为1分,11% ~50%为2分,51% ~75%为3分,>75%为4分。染色强度计分×阳性细胞计分>3分为阳性。
1.2.3 疗效评价标准 按照 RECIST标准 1.0版[3]进行疗效评价,完全缓解(CR):肉眼观察肿瘤完全消失,且无新病灶;部分缓解(PR):肿瘤缩小≥50%,且无新病灶;稳定(SD):肿瘤缩小<50%,且无新病灶;进展(PD):肿瘤无缩小或有新病灶出现。以CR+PR计算总有效率。不良反应评价采用WHO抗癌药物急性与亚急性毒副反应分级标准。
1.2.4 统计学方法 采用SPSS13.0统计软件,计数资料的比较采用χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 新辅助化疗的疗效与安全性 化疗2个疗程后,CR 27例,PR 37例,SD 10例,PD 7例,总有效率为79.0%。化疗过程中出现贫血28例,白细胞减少62例,血小板减少35例,神经毒性14例,肝功能损害11例,肾功能损害5例,恶心呕吐73例。
2.2 化疗前后 OPN、MMP-9表达比较 化疗前OPN和MMP-9的表达阳性率分别为88.9%(72/81)和 84.0%(68/81),化疗后分别为 13.6%(11/81)和12.3%(10/81),化疗后OPN和MMP-9的表达阳性率均明显低于化疗前(P均<0.01)。
2.3 OPN、MMP-9表达与新辅助化疗效果的关系化疗前OPN表达阳性者化疗总有效率为77.8%,阴性者为88.9%,OPN表达阴性者的化疗效果更理想(P<0.05)。化疗前MMP-9表达阳性者化疗总有效率为77.9%,阴性者为84.6%,MMP-9表达阴性者的化疗效果更理想(P<0.05)。见表1。
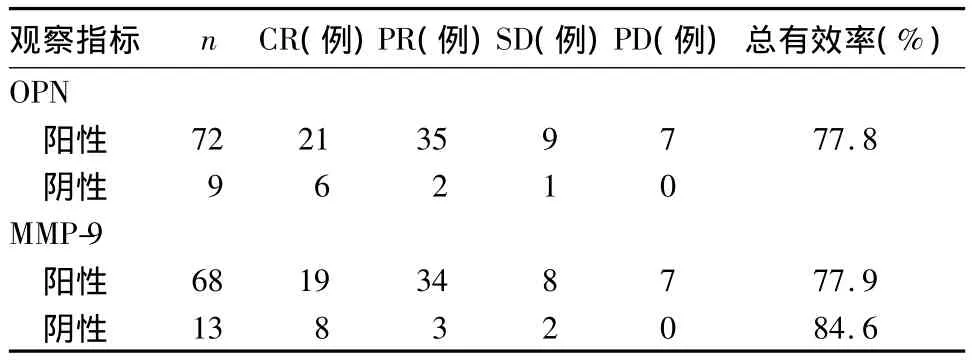
表1 OPN、MMP-9表达与新辅助化疗的关系
3 讨论
据统计,30% ~80%的宫颈癌患者死于侵袭和转移[4,5]。单纯手术治疗局部晚期宫颈癌难度大,易发生淋巴结或远处转移。放疗疗效相对肯定,但卵巢遭受放射剂量为6~10 Gy时,可永久性被破坏,阴道上皮发生纤维化,进而发生阴道挛缩[6]。新辅助化疗方案作为综合治疗的一部分,用于头颈部癌、骨肿瘤及乳腺癌的治疗已取得一定效果。新辅助化疗分为全身静脉化疗和子宫动脉介入栓塞化疗两种方式,动脉介入化疗的缺点是具有侵入性,且费用较高;静脉化疗与动脉化疗效果相同,且更简便、经济[7]。本研究对宫颈癌患者采用紫杉醇联合顺铂化疗,总有效率为79.0%,不良反应包括贫血、白细胞减少、血小板减少、神经毒性、肝功能损害、肾功能损害、恶心呕吐。表明新辅助化疗治疗宫颈癌效果显著,不良反应程度较轻。
OPN是一种多功能的细胞外基质中的磷酸化唾液酸糖蛋白。OPN一方面与细胞表面的多种整合素受体通过黏附序列 RGD结合,另一方面与CD44通过非依赖RGD序列结合,从而将细胞内一系列信号激活,合成内在的蛋白水解酶,加快降解纤维粘连蛋白和层粘连蛋白等细胞外基质,促进肿瘤的浸润和转移[8,9]。Tuck 等[10]证实,在转染实验中,良性肿瘤高表达OPN后可以向恶性转化。研究表明,多种肿瘤组织均存在OPN高表达,并且其表达程度与肿瘤的浸润转移相关。MMP属于内切蛋白水解酶家族,主要由肿瘤细胞等合成和分泌,能降解基底膜,利于血管内皮细胞出芽,促进宫颈癌局部血管的生成。MMP-9分子量为92 kD,是MMP中分子量最大的酶,其不仅可以降解细胞外基质和基底膜,还能改建细胞外基质,是新生血管形成的关键因素[11]。徐平等[12]报道,在宫颈癌患者不同分期中MMP-9的表达强度存在差异,随肿瘤进展其表达逐渐增强,与宫颈癌的临床分期相关。本研究显示,化疗前OPN和MMP-9的表达阳性率分别为88.9%和84.0%,化疗后分别为13.6%和12.3%,化疗后阳性率均明显降低;化疗前OPN表达阴性、MMP-9表达阴性者的化疗效果更理想。因此认为,新辅助化疗可以减少OPN和MMP-9的表达,监测OPN和MMP-9可以判断化疗效果。
[1]Green IA,Kirwan IM,Tierney JF,et al.Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix:a systematic review and Meta-analysis[J].Lancet,2009,358(1):781-786.
[2]黄志欣,廖莳,许学岚.血管内皮生长因子和基质金属蛋白酶-9在宫颈癌演进中与微血管密度的关系及其意义[J].中国现代医学杂志,2008,18(12):1655-1658.
[3]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors.European Organization for Research and Treatment of Cancer,National Cancer Institute of the United States,National Cancer Institute of Canada[J].J Natl Cancer Inst,2000,92(3):205-216.
[4]高进,章静波.癌的侵袭和转移基础与临床[M].北京:科学出版社,2003:1-4.
[5]林爽,李力,易萍,等.宫颈癌中Eagl钾离子通道的表达以及缺氧对其的调控作用[J].重庆医学,2010,39(8):899-901.
[6]吴良芝,李春梅,刘雯雯,等.局部晚期宫颈癌新辅助化疗分子疗效研究[J].中国实验诊断学,2010,14(5):738-741.
[7]王平,彭芝兰,张家文,等.子宫颈癌新辅助化疗不同化疗途径的疗效比较[J].中华妇产科杂志,2005,40(4):227-230.
[8]郝筱诗,安燕,王立岩,等.骨桥蛋白在宫颈组织中的表达及与宫颈癌进展的相关性研究[J].中国实验诊断学,2012,16(1):65-67.
[9]Yang G,Zhang Y,Wu J,et al.Osteopontin regulates growth and migration of human nasopharyngeal cancer cells[J].Mol Med Rep,2011,4(6):1169-1173.
[10]Tuck AB,Arsenault DM,OMalley FP,et al.Osteopontin induces increaseed invasiveness and plasminogen activator expression of human mammary epithelial cells[J].Oncogene,2009,18(29):4237-4246.
[11]Reidel F,Gotte K,Schwalb J,et al.Expression of 92-kDa type IV collagenase correlates with angiogenic markers and poor survival in head and neck aquamous cel carcinoma[J].Int J Oncol,2009,17(6):1099-1105.
[12]徐平,蔡海宁,王丹霞,等.基质金属蛋白酶-2、-9在宫颈癌进展中的意义[J].西部医学,2009,21(12):2040-2042.
