人巨细胞病毒感染与系统性红斑狼疮的相关性
2014-01-21陈静章慧娣楼威洋邵蓉蓉张丽芳薛向阳朱小春
陈静,章慧娣,楼威洋,邵蓉蓉,张丽芳,薛向阳,朱小春
(1.温州医科大学附属第一医院 风湿免疫科,浙江 温州 325015;2.温州医科大学附属第一医院肾内科, 浙江 温州 325015;3.温州医科大学 第一临床医学院,浙江 温州 325035;4.温州医科大学 微生物学与免疫学教研室,浙江 温州 325035)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及全身多系统、多脏器的自身免疫性疾病[1],其病因及发病机制尚未明确。近年来的研究显示,病毒感染,如EB病毒、细小病毒B19等是SLE发生发展的重要促进因素[1]。但人类巨细胞病毒(human cytomegalovirus,HCMV)感染与SLE的相关性目前仍存在争议。有研究认为HCMV的感染可能为SLE的一个重要病因,并加重SLE疾病的进程[2],同时,SLE病情的严重也可能导致HCMV的感染[3],两者互为因果。但有些研究认为HCMV感染与SLE无关[4]。考虑到人群高感染率的HCMV具潜伏感染和广泛细胞亲嗜性的特征,不同检测方法可明显影响HCMV检测结果。为此,本研究通过血清HCMV特异性IgG、IgM检测分析SLE患者及健康体检者HCMV感染的同时,选择HCMV必不可少的UL55基因以及潜伏相关的、高度保守的,且只在临床分离株中存在的UL138基因,建立高度敏感特异的PCR方法,分析SLE患者及健康体检者外周血白细胞内HCMV感染状态,多层面评价HCMV感染与SLE的相关性。
1 材料和方法
1.1 一般资料 本研究共计收集自2011年3月至2012年5月间在温州医科大学附属第一医院住院治疗的SLE患者抗凝外周静脉血标本60例,其中男15例,女45例,年龄11~70岁,平均(34.17±12.80)岁。所有SLE患者均进行了常见临床症状调查、常见检测指标的测定,并根据国际通用的SLE疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)[5]进行评分,一般认为≤5分为非活动期,>5分为活动期。另选取同一时期本院健康体检者(均排除SLE)抗凝外周静脉血标本111例,其中男41例,女70例,年龄18~55岁,平均(32.68±10.43)岁。两组人群均排除乙肝、丙肝、人类免疫缺陷病毒(human immunodeficiency virus,HIV)、梅毒、EB病毒(epstein-barr virus EBV)等感染。本研究经本院伦理委员会批准,所有受试者均签署知情同意书。
1.2 试剂 KOD Plus Neo[东洋纺(上海)生物科技有限公司];100 bp DNA marker[天根生化科技(北京)有限公司];DNA提取试剂盒[天根生化科技(北京)有限公司];红细胞裂解液(上海碧云天生物技术有限公司);pEASY-Blunt Zero Cloning Vector[天根生化科技(北京)有限公司];HCMV IgG检测试剂(德国罗氏诊断有限公司);HCMV IgM检测试剂(德国罗氏诊断有限公司)。引物均由上海生物工程有限公司合成。
1.3 方法
1.3.1 外周血白细胞分离:取当天采集的SLE患者及健康体检者的EDTA抗凝静脉血(2 mL),4 ℃1 500 r/min离心10 min,吸去上层血浆,向下层的血细胞悬液中加入3倍体积的红细胞裂解液,轻轻吹打混匀,充分裂解20 min,4 ℃ 3 000 r/min离心20 min,弃上清。用PBS重悬下层的白细胞沉淀4 ℃ 3 000 r/min离心10 min,弃上清,以便彻底清除红细胞,重复清洗两次。
1.3.2 基因组DNA抽提:采用DNA提取试剂盒抽提外周血白细胞的DNA,1%琼脂糖凝胶电泳鉴定DNA纯度。
1.3.3 PCR检测外周血白细胞中HCMV UL55和UL138基因:采用巢式PCR技术检测SLE患者及健康体检者外周血白细胞内HCMV UL55和UL138基因。UL138基因及UL55基因检测的引物序列[6]及反应条件见表1。第二轮PCR反应体系以1μL第一轮PCR扩增产物为模板进行扩增。阳性对照为确诊HCMV感染患者的DNA,阴性对照为灭菌的双蒸水。UL55及UL138的PCR产物大小分别为100 bp和89 bp。目的条带连接pEASY-Blunt Zero Cloning Vector,挑阳性克隆测序。

表1 巢式PCR引物及反应条件
1.3.4 血清HCMV特异性IgG和IgM检测:收集SLE患者及健康体检者对照血清,按血清HCMV IgG、IgM检测试剂说明书操作检测血清中HCMV IgG和IgM(委托某医院检验科代为检测)。
1.4 统计学处理方法 采用SPSS17.0软件进行统计学分析。计数资料用 ±s表示,采用独立样本t检验进行比较;分类资料用n/%形式表示,采用卡方检验及Fisher确切概率法比较不同方法检验HCMV感染的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 细胞内HCMV UL55、UL138 PCR检测方法的建立 以SLE患者及健康体检者外周血白细胞中抽提的DNA(浓度测定范围在408.1~510.6 ng/μL)为模板进行巢式PCR扩增(第1泳道为阳性对照,最后一个泳道为阴性对照),PCR产物琼脂糖凝胶电泳显示,分别在100、89 bp位置出现单一的目的条带(见图1A-B),分别将其切胶回收后连载体送测序,测序结果与目的序列吻合(见图1C-D),说明建立的PCR方法可用于检测外周血白细胞的HCMV感染。
2.2 SLE患者及健康体检者HCMV感染不同检测方法阳性率的比较 60例SLE患者及111例健康体检者外周血白细胞内HCMV UL55、UL138基因检测及血清HCMV IgG、IgM结果显示,SLE患者外周血白细胞内HCMV UL55、UL138及血清HCMV IgG、IgM阳性率分别为43.33%、96.67%、100%和6.67%,健康体检者外周血白细胞内HCMV UL55、UL138及血清HCMV IgG、IgM阳性率分别为1.80%、100%、100%和0.90%。SLE患者与健康体检者外周血白细胞内HCMV UL138基因及血清HCMV IgG检测阳性率两组之间差异无统计学意义(P>0.05);SLE患者外周血白细胞内HCMV UL55基因检测阳性率高于健康体检者(P<0.01)。
2.3 HCMV不同检测方法相关性分析 比较外周血白细胞内HCMV UL55、UL138检测和血清HCMV IgG、IgM检测结果显示,细胞内HCMV UL138检测与血清HCMV IgG检测存在较好的一致性,两种方法同时检测阳性率达98.83%;细胞内HCMV UL55及UL138检测间一致性较差,两种检测同时阳性率仅15.79%(见表2)。

图1 外周血白细胞HCMV UL55、UL138 PCR检测及测序结果

表2 HCMV不同检测方法阳性率的比较
2.4 外周血白细胞内HCMV感染检测与SLE患者免疫系统相关指标的相关性分析 对外周血白细胞内HCMV UL55检测结果与SLE患者临床特征及免疫系统相关指标进行相关性分析发现,与外周血白细胞内HCMV UL55阴性的SLE患者相比,细胞内HCMV UL55阳性患者的抗Rib-P抗体(P=0.031)、直接Coomb’s试验(P=0.017)阳性率明显升高,血清总IgG(P=0.023)、β2-GP-1(P=0.022)水平明显升高,抗核抗体(antinuclear antibody,ANA)、抗ds-DNA抗体、抗U1RNP抗体、抗组蛋白抗体、抗SSA抗体、抗SSB抗体阳性率及SLEDAI评分等指标差异无统计学意义(均P>0.05)。细胞内HCMV UL138检测结果与SLE患者免疫系统相关临床指标差异无统计学意义(均P>0.05)。见表3。
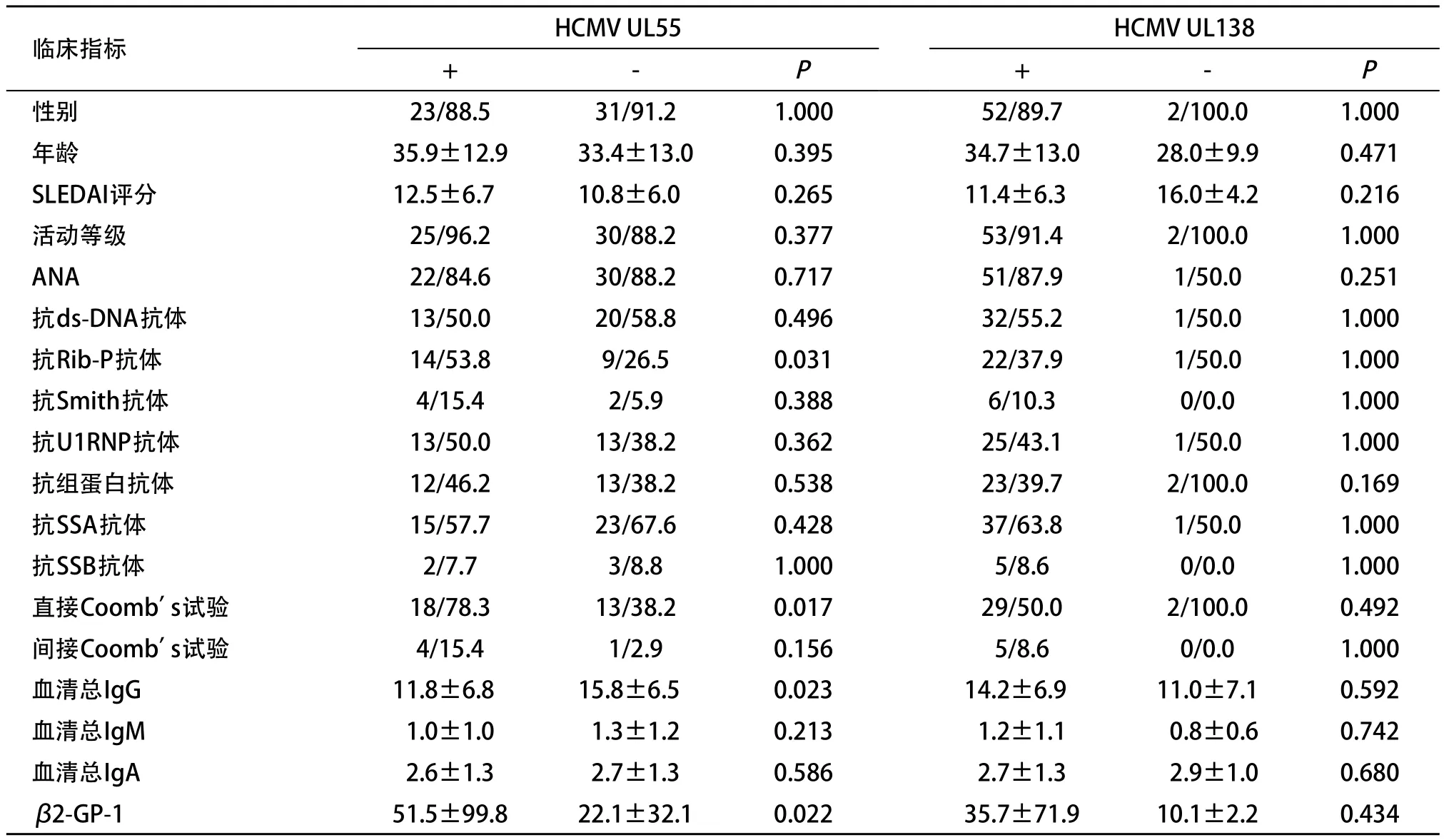
表3 不同HCMV感染检测情况与SLE患者临床指标的相关性分析(n=60,n/%, ±s)
3 讨论
HCMV属于疱疹病毒β亚科,是一种广泛细胞亲嗜性的DNA病毒,能感染上皮细胞、内皮细胞、成纤维细胞、外周血单个核细胞及神经细胞等。人群HCMV感染十分普遍,据报道中国成人感染率高达95%[7],与本研究结果相符。关于SLE与HCMV感染相关性研究近年来的研究证据表明HCMV的感染是SLE重要促发因素,并加重SLE疾病的进程[1]。研究发现,与正常对照比较,SLE患者HCMV感染阳性率以及体内HCMV DNA拷贝数明显升高[8];大部分的SLE患者血液中存在HCMV PP65 C末端的抗体[9];此外,核内U1小核糖核蛋白(U1 snRNP)抗体多见于SLE患者以及HCMV感染或免疫接种的动物体内或血液中[10-11]。但James等[4]研究认为HCMV感染与SLE无关。而且SLE患者HCMV感染率不同的报道也存在较大差异:Takizawa等[12]利用PP65抗原检测风湿病患者中HCMV的感染情况,总共151例患者中有149人感染,其中SLE患者74例全部感染HCMV,感染率达100%;Newkirk等[10]使用ELISA试剂盒检测HCMV抗体,SLE患者HCMV感染率约为60%,与正常对照组相近;Su等[13]通过对类风湿因子(RF)中和处理后,87个SLE患者中有84例CMV-IgG阳性(阳性率为96.55%),9例CMV-IgM阳性(阳性率为10.34%)。由于HCMV基因组上存在165~252个开放阅读框(open reading frames,ORF),而且潜伏感染是HCMV重要生物学特征[14-16],所以选择不同检测基因、采用不同检测手段均可能导致HCMV检测结果的变化。
目前对于HCMV的检测方法主要有病毒分离、PP65抗原检测、血清IgM、IgG抗体检测、核酸检测等方法。HCMV诊断的金标准是HCMV分离培养,但是HCMV在体外人成纤维细胞培养中增殖非常缓慢,复制周期为36~48 h。HCMV初次分离培养,需1个多月才出现特殊的细胞,而且操作繁琐,设备要求高,即使分离结果阴性并不能完全排除HCMV活动性感染,因此不适于作为检测HCMV感染的常用方法。现在临床上HCMV感染的诊断主要依赖于抗体血清学(IgG、IgM)检测或血清抗原(PP65)检测。但HCMV感染细胞谱广泛[17],血清学诊断难以明确感染部位,且经过激素和/或免疫抑制剂治疗后,HCMV感染可能不出现或延迟出现IgM类抗体反应。由于PCR技术敏感性高,已被广泛应用于HCMV感染检测。可用于PCR检测的HCMV靶基因有:pp65基因[18]、UL54[19]、UL83[20]、UL123[21]、US17基因[22]、UL75[23]等。已有文献报道编码糖蛋白B(gB)的UL55基因是HCMV一个不可缺少的、高度保守的基因[24],而UL138是HCMV潜伏感染所必需的高度保守的基因[25]。为更好地反映SLE患者HCMV感染情况,我们不但进行血清HCMV IgG和IgM检测,而且建立细胞内HCMV UL55及UL138巢式PCR技术以检测外周血白细胞内HCMV感染。PCR产物电泳及测序结果证实我们建立的巢式PCR能特异性检测到外周血白细胞内HCMV UL55及UL138基因。
在血清HCMV IgG、IgM及细胞内HCMV UL55、UL138四种不同HCMV检测方法中,不管是SLE患者还是健康体检者,血清HCMV IgG及细胞内HCMV UL138基因检测几乎全部阳性,细胞内HCMV UL55基因检测其次,血清HCMV IgM检测阳性率最低。比较SLE患者与健康体检者检测结果,血清HCMV IgG及细胞内HCMV UL138基因检测结果之间差异无统计学意义(P>0.05),SLE患者血清HCMV IgM检测阳性率高于健康体检者,但差异无统计学意义(P=0.052),SLE患者外周血白细胞内HCMV UL55基因检测的阳性率显著高于健康体检者(P<0.01)。HCMV感染4种检测方法的相关分析显示,细胞内HCMV UL138检测与血清HCMV IgG检测存在较好的一致性,而同为细胞内HCMV感染检测,由于UL55及UL138目的基因选择不同,HCMV检测感染阳性率之间存在显著性差异。这些结果提示,不同检测基因、不同检测手段均可能影响HCMV检测结果。
进一步分析外周血白细胞内HCMV感染检出情况与SLE患者免疫系统相关指标间的相关性,以细胞内HCMV UL55基因作为HCMV感染指标,HCMV感染与SLE患者多项免疫系统相关指标存在相关性,如抗Rib-P抗体、直接Coomb’s试验、血清总IgG、β2-GP-1等,但是以细胞内HCMV UL138基因作为HCMV感染指标,HCMV感染与SLE患者免疫相关指标没有相关性。因此,HCMV感染与SLE存在一定的相关性,但由于本研究仅从HCMV感染的阳性率方面进行评价,并未深入探究SLE患者疾病活动期与缓解期以及其临床指标与HCMV拷贝数的关系,且样本量偏少,未进一步研究HCMV活动性感染和潜伏期对SLE患者疾病情况的影响。因此,HCMV感染与SLE之间相互作用的机制有待于进一步探索。
[1] Zandman-Goddard G, Shoenfeld Y. Infections and SLE[J].Autoimmunity, 2005, 38(7): 473-485.
[2] Chang M, Pan MR, Chen DY, et al. Human cytomegalovirus pp65 lower matrix protein: a humoral immunogen for systemic lupus erythematosus patients and autoantibody accelerator for NZB/W F1 mice[J]. Clin Exp Immunol, 2006,143(1): 167-179.
[3] Y oon KH, Fong KY, Tambyah PA. Fatal cytomegalovirus infection in two patients with systemic lupus erythematosus undergoing intensive immunosuppressive therapy: role for cytomegalovirus vigilance and prophylaxis?[J]. J Clin Rheumatol, 2002, 8(4): 217-222.
[4] James JA, Neas BR, Moser KL, et al. Systemic lupus erythematosus in adults is associated with previous Epstein-Barr virus exposure[J]. Arthritis Rheum, 2001, 44(5): 1122-1 126.
[5] Bombardier C, Gladman DD, Urowitz MB, et al. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE[J].Arthritis Rheum, 1992, 35(6): 630-640.
[6] Alkhawaja S, Ismaeel A, Botta G, et al. The prevalence of congenital and perinatal cytomegalovirus infections among newborns of seropositive mothers[J]. J Infect Dev Ctries,2012, 6(5): 410-415.
[7] 郭丽丽, 徐红梅. 人巨细胞病毒感染的流行病学研究进展[J]. 国际检验医学杂志, 2010, 31(10): 1131-1133.
[8] Hrycek A, Kusmierz D, Mazurek U, et al. Human cytomegalovirus in patients with systemic lupus erythematosus[J].Autoimmunity, 2005, 38(7): 487-491.
[9] Hsieh AH, Jhou YJ, Liang CT, et al. Fragment of tegument protein pp65 of human cytomegalovirus induces autoantibodies in BALB/c mice[J]. Arthritis Res Ther, 2011, 13(5):R162.
[10] Newkirk MM, van Venrooij WJ, Marshall GS. Autoimmune response to U1 small nuclear ribonucleoprotein (U1 snRNP)associated with cytomegalovirus infection[J]. Arthritis Res,2001, 3(4): 253-258.
[11] Curtis HA, Singh T, Newkirk MM. Recombinant cytomegalovirus glycoprotein gB (UL55) induces an autoantibody response to the U1-70 kDa small nuclear ribonucleoprotein[J].Eur J Immunol, 1999, 29(11): 3643-3653.
[12] Takizawa Y, Inokuma S, Tanaka Y, et al. Clinical characteristics of cytomegalovirus infection in rheumatic diseases:multicentre survey in a large patient population[J]. Rheumatology (Oxford), 2008, 47(9): 1373-1378.
[13] Su BY, Su CY, Yu SF, et al. Incidental discovery of high systemic lupus erythematosus disease activity associated with cytomegalovirus viral activity[J]. Med Microbiol Immunol, 2007, 196(3): 165-170.
[14] Weekes MP, Tan SY, Poole E, et al. Latency-associated degradation of the MRP1 drug transporter during latent human cytomegalovirus infection[J]. Science, 2013, 340(6129):199-202.
[15] Jenkins C, Garcia W, Godwin MJ, et al. Immunomodulatory properties of a viral homolog of human interleukin-10 expressed by human cytomegalovirus during the latent phase of infection[J]. J Virol, 2008, 82(7): 3736-3750.
[16] Umashankar M, Petrucelli A, Cicchini L, et al. A novel human cytomegalovirus locus modulates cell type-specif c outcomes of infection[J]. PLoS Pathog, 2011, 7(12): e1002444.
[17] Sinzger C, Jahn G. Human cytomegalovirus cell tropism and pathogenesis[J]. Intervirology, 1996, 39(5-6): 302-319.
[18] Biri A, Bozdayi G, Cicfti B, et al. The detection of CMV in amniotic fluid and cervicovaginal smear samples by real-time PCR assay in prenatal diagnosis[J]. Arch Gynecol Obstet, 2006, 273(5): 261-266.
[19] Sanchez JL, Storch GA. Multiplex, quantitative, real-time PCR assay for cytomegalovirus and human DNA[J]. J Clin Microbiol, 2002, 40(7): 2381-2386.
[20] Mengelle C, Sandres-Saune K, Pasquier C, et al. Automated extraction and quantif cation of human cytomegalovirus DNA in whole blood by real-time PCR assay[J]. J Clin Microbiol, 2003, 41(8): 3840-3845.
[21] Fan J, Ma WH, Yang MF, et al. Real-time f uorescent quantitative PCR assay for measuring cytomegalovirus DNA load in patients after haematopoietic stem cell transplantation[J]. Chin Med J (Engl), 2006, 119(10): 871-874.
[22] Yoshida A, Hitomi S, Fukui T, et al. Diagnosis and monitoring of human cytomegalovirus diseases in patients with human immunodef ciency virus infection by use of a real-time PCR assay[J]. Clin Infect Dis, 2001, 33(10): 1756-1761.
[23] Onishi Y, Mori S, Higuchi A, et al. Early detection of plasma cytomegalovirus DNA by real-time PCR after allogeneic hematopoietic stem cell transplantation[J]. Tohoku J Exp Med, 2006, 210(2): 125-135.
[24] Isaacson MK, Compton T. Human cytomegalovirus glycoprotein B is required for virus entry and cell-to-cell spread but not for virion attachment, assembly, or egress[J]. J Virol,2009, 83(8): 3891-3903.
[25] Qi Y, He R, Ma YP, et al. Human cytomegalovirus UL138 open reading frame is highly conserved in clinical strains[J].Chin Med Sci J, 2009, 24(2): 107-111.
