超高效液相色谱-串联质谱结合QuEChERS方法快速检测柑橘中的残留苯丁锡
2014-01-18朱艳梅赵其阳陈卫军焦必宁张耀海
朱艳梅,赵其阳,陈卫军,焦必宁,3,*,张耀海
(1.农业部柑桔产品质量安全风险评估实验室(重庆),西南大学柑桔研究所,重庆 400712;2.西南大学食品科学学院,重庆 400715;3.国家柑桔工程技术研究中心,中国农业科 学院柑桔研究所,重庆 400712)
超高效液相色谱-串联质谱结合QuEChERS方法快速检测柑橘中的残留苯丁锡
朱艳梅1,2,赵其阳1,陈卫军1,焦必宁1,2,3,*,张耀海1
(1.农业部柑桔产品质量安全风险评估实验室(重庆),西南大学柑桔研究所,重庆 400712;2.西南大学食品科学学院,重庆 400715;3.国家柑桔工程技术研究中心,中国农业科 学院柑桔研究所,重庆 400712)
采用改进的QuEChERS方法结合超高效液相色谱-串联四极杆质谱仪,建立快速检测柑 橘中残留苯丁锡的方法。样品经乙腈提取、无水MgSO4和NaCl脱水盐析、十八烷基硅胶键合相分散萃取净化,采用BEH C18液相色谱柱分离(2.1 mm×50 mm),等度洗脱,在多反应监测模式下测定,基质匹配标准溶液外标法定量。结果表明:在0.001~1.0 mg/L范围内,苯丁锡含量与峰面积具有良好的线性关系,R2≥0.993 0;方法定量限为2.0 μg/kg;在方法线性范围内,柑橘果肉、果皮和全果中低、中、高3个添加水平的平均回收率为74.0%~97.7%,相对标准偏差为2.5%~6.9%。该方法操作简单、快速、成本低、环境友好、安全、精确度高,能满足柑橘中痕量苯丁锡残留的快速确证和定量检测要求。
QuEChERS;超高效液相色谱-串联质谱;柑橘;苯丁锡
苯丁锡(fenbutatin oxide,分子式C60H78OSn2)是一种感温型抑制神经组织的有机锡杀螨剂,中等毒性[1],对植物叶螨、瘿螨和锈螨具有良好的防治效果,主要用于防治柑橘、苹果、葡萄、茶树和蔬菜等作物的植物食性螨,残效期比较长。目前美国、欧盟、日本等均制定了苯丁锡在柑橘类水果中的最大残留限量标准,我国规定柑橘中苯丁锡的最大残留限量值为5 mg/kg[2],但尚未制定柑橘类水果中残留苯丁锡的标准检测方法,加之果农使用苯丁锡农药欠规范,可能导致柑橘鲜果中的残留量过高而产生潜在的质量安全风险,因此建立快速、准确、灵敏的柑橘中苯丁锡残留确证检测方法十分必要。
目前报道的苯丁锡残留的检测方法主要有气相色谱法(gas chromatography,GC)[3-5]、气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)[6-9]和液相色谱法(high performance liquid chromatography,HPLC))[10-12]。这些方法主要针对环境和动物源性食品中残留苯丁锡的分析,而植物源性食品,特别是柑橘类产品中残留苯丁锡确证方法的报道较少。其中的GC和GC-MS法,样品通常需经过格林试剂[13-15]或浓盐酸[16]等衍生、净化才能检测,操作步骤繁琐且重复性差,不适合大批量样品的快速检测。Barnes等[17]建立了高效液相色谱串联大气压化学电离源质谱(high performance liquid chromatographic-atmospheric pressure chemical ionizationmass spectrometry,HPLC-APCI-MS)法检测番茄、黄瓜、香蕉中苯丁锡残留,样品前处理虽不需衍生,但操作繁琐,有机溶剂消耗量大,且检测灵敏度不高。本研究针对复杂的柑橘类鲜果样品基质,采用改进的QuEChERS方法,样品前处理无需衍生,首次建立了检测柑橘类水果中痕量残留苯丁锡的超高效液相色谱-串联质谱(ultraperformance liquid chromatography-tandem mass spectrometry,UPLC-MS-MS)法。该方法低成本且环保、操作简便快速,且方法灵敏度极高、重复性好、准确度高,适合大批量柑橘类鲜果样品中苯丁锡残留的快速确证和定量检测。
1 材料与方法
1.1 材料与试剂
苯丁锡标准品(纯度>9 9%) 德国G r. Ehrenstorfer GmbH公司;十八烷基硅胶键合相(40~63 μm) 加拿大Silicycle公司;无水MgSO4(分析纯,用前先在500 ℃马弗炉内烘干5 h) 江苏强盛化工有限公司;NaCl(分析纯) 国药集团化学试剂有限公司;乙腈、甲醇、二氯甲烷(均为色谱纯)、甲酸、甲酸铵(均为分析纯) 重庆川东化工有限公司。
1.2 仪器与设备
Quatrro-Premier XE超高效液相色谱-串联质谱、Acquity UPLC BEH C18柱 美国Waters公司;Milli-Q A10超纯水器 美国Millipore公司;CL31/CL31R多用途离心机 美国Thermo Fisher公司;KS260摇床 德国IKA公司;0.22 μm有机滤膜 北京捷盛依科科技有限公司。
1.3 方法
1.3.1 样品预处理
取大约1.0 kg柑橘鲜果样品,用干净纱布将样品表面附着物擦去,以四分法分别取全果、果肉和果皮等样品部位进行匀浆。
1.3.2 标准溶液的配制
标准贮备液:准确称取10.0 mg(精确到0.1 mg)苯丁锡标准品,用二氯甲烷溶解并定容至100 mL,得到100 mg/L苯丁锡母液,于-50℃条件下保存。
标准工作液:准确移取一定体积的苯丁锡母液,分别用乙腈稀释成0.01、0.1、1、5 mg/L和10 mg/L的苯丁锡标准工作液,于-4℃条件下保存。
基质空白标准工作溶液:将不含苯丁锡的柑橘果皮、果肉和全果样品按1.3.1节方法进行前处理,得到基质空白溶液。用基质空白溶液将苯丁锡标准工作液按相同比例稀释至0.001、0.01、0.1、0.5 mg/L和1.0 mg/L,得到柑橘果皮、果肉和全果基质空白标准工作溶液。
1.3.3 样品提取和净化
准确称取5.00 g(精确至0.01g)已匀浆的样品于20 mL离心管中,加10.00 mL乙腈,300 r/min振荡30 min;加入1.5 g无水MgSO4和0.5 g NaCl,剧烈振荡1 min,4 000 r/min离心5 min;取上清液2 mL,加20 mg十八烷基硅胶键合相(C18),涡旋1 min,3 000 r/min离心5 min;取适量上清液过0.22 μm有机滤膜,待测。
1.3.4 色谱条件
色谱柱:A c q u i t y U P L C B E H C18柱(2.1 mm×50 mm,1.7 øm);柱温30 ℃;进样量3 øL;流速0.3 mL/min;流动相为0.1%甲酸水溶液(5 mmol/L甲酸铵)-甲醇(体积比为10∶90);等度洗脱5 min。
1.3.5 质谱条件
电喷雾离子源;正离子模式;电离电压3.20 kV;离子源温度120 ℃;锥孔反吹气流量50 L/h;脱溶剂气温度380 ℃;脱溶剂气流量800 L/h;碰撞气流量为0.18 L/min;多反应监测模式;苯丁锡监测离子及碰撞能量等质谱参数见表1。
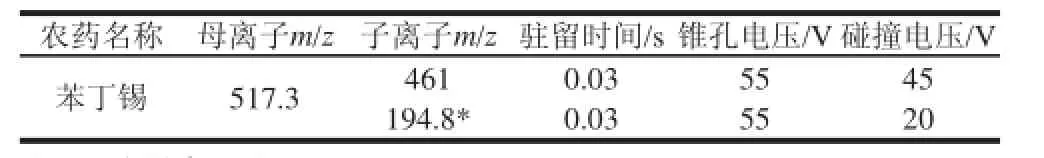
表1 苯丁锡监测离子、驻留时间、锥孔电压及碰撞电压Table 1 Detection ions, dwell time, cone voltage and collision energy of fenbutatin oxxiiddee
2 结果与分析
2.1 QuEChERS方法的改进
2.1.1 样品量的选择
采用QuEChERS方法作为检测农药残留的前处理技术时,样品量通常选用10.0 g[18-21],本实验比较了3个称样水平,样品量分别为1.0、5.0、10.0 g,每个水平重复3次。样品量为1.0 g时,精密度、重复性差;样品量选择5.0 g和10.0 g时,回收率分别为75.8%~110.2%和72.5%~102.3%,相对标准偏差均小于10%,实验稳定性好,均能满足农残检测分析的要求。但是样品量的增加会使提取剂乙腈的用量增加,这样不仅成本增加,而且污染环境,综合考虑,本方法的样品量定为5.0 g。
2.1.2 除水剂用量的选择
传统的前处理过程通常采用无水Na2SO4作为除水剂,QuEChERS方法改用吸水性更好的无水MgSO4作为除水剂,并结合NaCl的盐析作用,使苯丁锡充分溶解在有机相中。本实验以全果为基质,优化了无水MgSO4的用量,发现当无水MgSO4的用量在0.5~1.5 g时,苯丁锡的回收率随用量的增加而呈上升趋势;在1.5~3 g范围内时,苯丁锡的回收率随用量的增加呈降低趋势(图1),所以本方法选择1.5 g无水MgSO4作为除水剂。
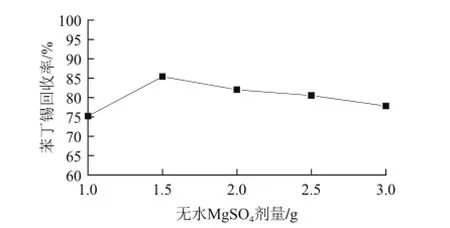
图1 MgSO4用量对苯丁锡加标回收率的影响(加标水平0.2 mg/kg)Fig.1 Effect of MgSO4dose on fenbutatin oxide recovery (spiked concentration 0.2 mg/kg)
2.1.3 净化剂的选择
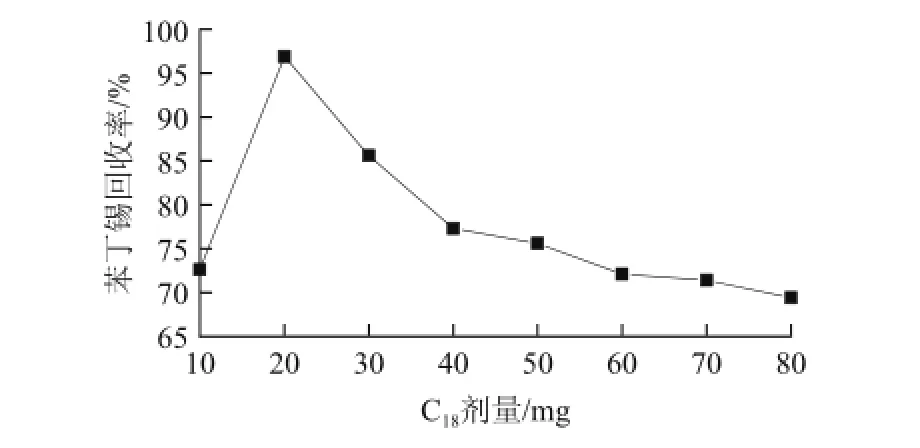
图2 不同用量苯丁锡加标回收率的影响(加标水平0.2 mg/kg)Fig.2 Effect of C18dose on fenbutatin oxide recovery (spiked concentration 0.2 mg/kg)
Q u E C h E R S选用的净化剂主要有石墨炭黑(graphitized carbon blacks,GCB)、N-丙基乙二胺(primary secondary amine,PSA)、十八烷基硅胶键合相(octadecylsilyl silica gel,C18)等。本实验以全果为基质,对这3种吸附剂及其不同组合的净化效果作了比较,发现GCB对苯丁锡的吸附性极强,可能是因为苯丁锡为极性分子,带有芳香环,并且结构非常对称。PSA和C18净化后,苯丁锡回收率均能满足农残检测要求。但空白基质加标实验发现,以PSA为净化剂时,基质标液苯丁锡的离子响应信号值明显强于溶剂标液的响应值,即PSA净化样品时存在较强的基质效应,而C18净化样品基质效应明显小于PSA的。所以本方法选定净化剂为C18,并对C18用量做了进一步优化,图2为C18的用量为10~80 mg时对应的苯丁锡加标回收率,C18用量为20 mg时,苯丁锡加标回收率最佳。
2.2 液相色谱和质谱条件的优化
2.2.1 流动相及洗脱条件的优化
由于甲醇比乙腈更适合于正离子监测模式,所以本实验比较了水-甲醇、甲酸溶液-甲醇、甲酸+甲酸铵溶液-甲醇3种流动相体系。研究发现流动相中加入少量甲酸后,可抑制苯丁锡峰拖尾,增强离子信号强度值;而加入少量甲酸铵后,苯丁锡峰形可得到明显改善。因此本方法选用甲酸+甲酸铵溶液-甲醇流动相体系,并进一步优化了甲酸和甲酸铵的加入量。发现当甲酸和甲酸铵加入量分别达到0.1%和5 mmol/L时,峰形不再随甲酸和甲酸铵含量的增加而明显改变,所以采用0.1%甲酸溶液+5 mmol/L甲酸铵-甲醇作为流动相。实验发现,苯丁锡在流动相比例发生变化时会出峰,检测信号值有一定波动,所以本实验采用等度洗脱。通过比较流动相中有机相和水相的不同比例,发现V(0.1%甲酸溶液+5 mmol/L甲酸铵)∶V(甲醇)为10∶90时分离度和峰形较好,因此将0.1%甲酸溶液+5 mmol/L甲酸铵-甲醇作为本方法的流动相体系,体积比为10∶90,苯丁锡的出峰时间在2 min左右。
2.2.2 质谱条件的优化
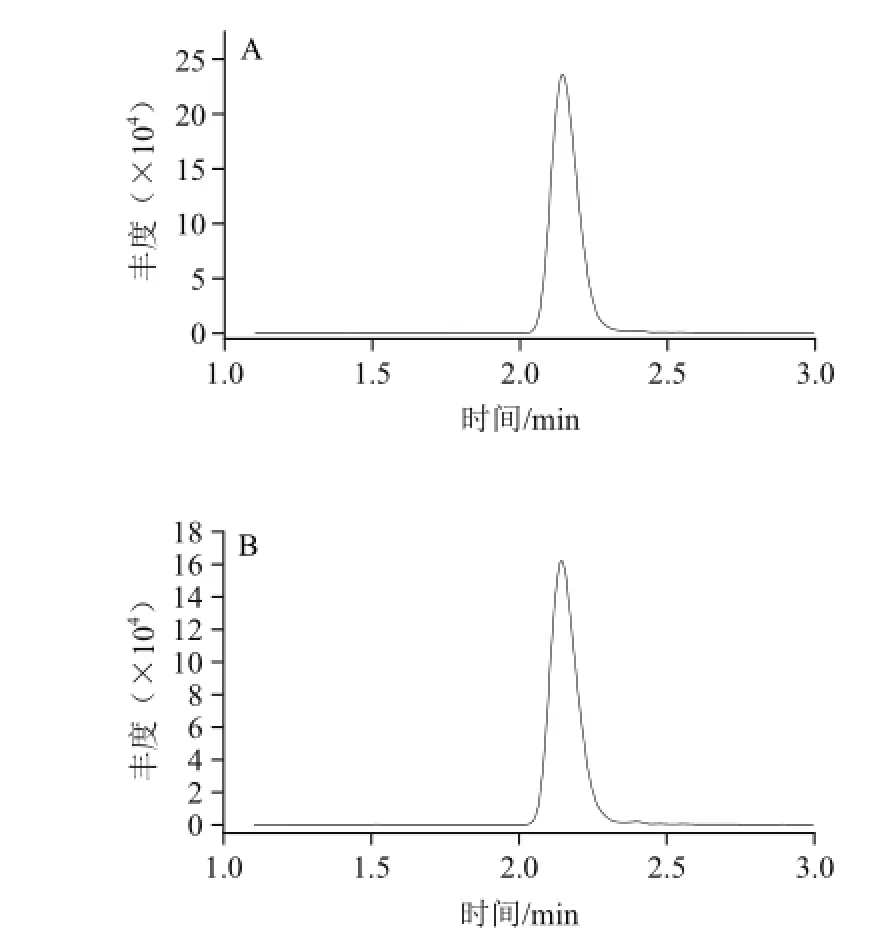

图3 苯丁锡离子质谱图Fig.3 Mass spectra of fenbutatin oxide
采用流动注射泵连续进样方式进行质谱条件的优化。在电喷雾离子源正离子模式下进行全扫描,确定苯丁锡的母离子为m/z 517.3。随后优化毛细管电压、锥孔电压、脱溶剂温度、碰撞能量、碰撞压力等质谱参数,产生了m/z 194.8、m/z 349.1、m/z 461等子离子(图3)。根据文 献[22],选择2对离子进行多反应监测即可满足要求,因此选取了离子丰度较强、干扰较小的m/z 517.3>461和m/z 517.3>194.8离子对作为监测离子对,以丰度最强的子离子m/z 194.8作为定量离子。
2.3 方法的评价
2.3.1 标准曲线及定量限
本实验采用基质匹配标准溶液外标法定量,为降低基质效应对定量测定的影响,本方法选择了空白基质标准溶液工作曲线进行定量。按照UPLC-MS-MS条件从低到高依次测定空白基质标准溶液,以基质标准溶液质量浓度/(mg/L)为横坐标,MS-MS定量离子色谱峰峰面积为纵坐标,绘制标准曲线,进行线性回归分析。结果表明,苯丁锡在0.001~1.0 mg/L范围内具有良好的线性关系,R2≥0.993 0(表2),方法定量限为2.0 μg/kg。

表2 苯丁锡的线性范围、线性方程、相关系数(n=6)Table 2 Liner range, linear equation and correlation coefficient of fenbutation oxid ( = 6)
2.3.2 加标回收率及精密度
分别称取柑橘果肉、果皮、全果5.0 g,添加0.01、0.1、0.2 mg/kg 3个苯丁锡水平,每个水平设置6个重复,按照1.3.3节进行提纯净化,然后用选定的UPLC-MSMS条件测定苯丁锡含量。结果表明(表3),果肉、果皮、全果中苯丁锡的平均添加回收率分别为81.6%、87.8%、81.3%,相对标准偏差为2.5%~6.9%,方法的准确度和精密度都符合农残检测的要求。
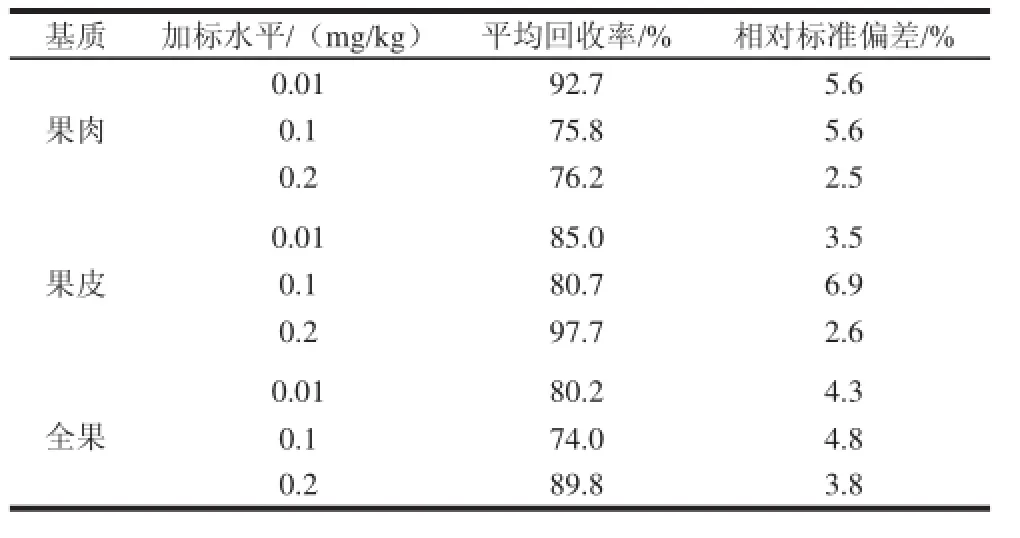
表3 加标回收率及精密度测试结果(n=6)Table 3 Results of recovery and precision tests (n =6)
2.3.3 实际样品的检测
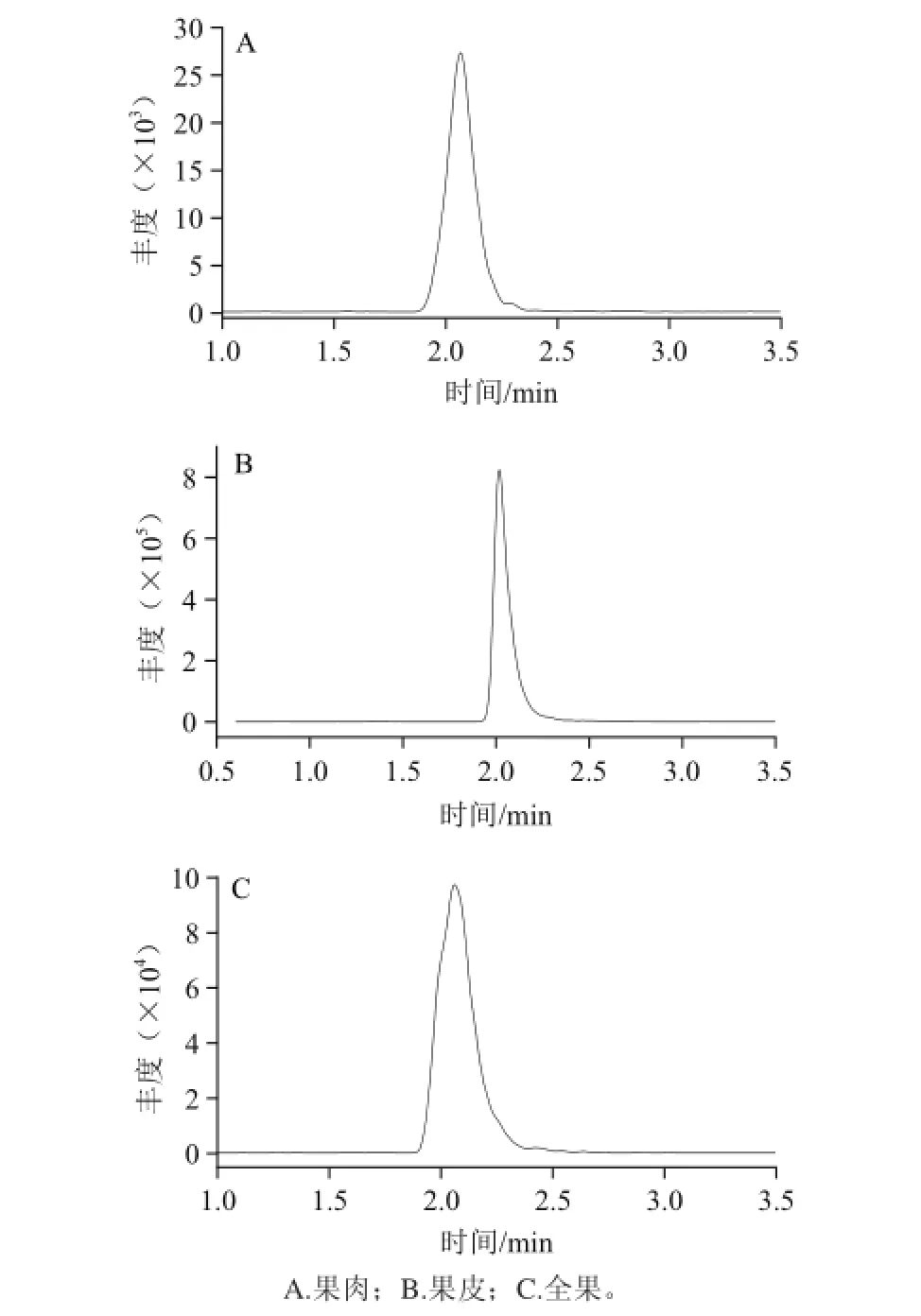
图4 柑橘实际样品中苯丁锡的色谱图Fig.4 Chromatogram of fenbutatin oxide in real citrus samples
本实验实际样品来自苯丁锡田间残留实验样品,从中随机抽取若干份,采用QuEChERS-UPLC-MS-MS快速分析各样品中苯丁锡残留(图4)。结果显示,果皮中苯丁锡检出含量为1.264~3.084 mg/kg;果肉的苯丁锡检出含量为0~0.029 mg/kg;全果的苯丁锡检出含量为0.166~0.366 mg/kg。可以看出,苯丁锡主要分布在柑橘果皮上,难以通过果皮进入内部的果肉组织。
3 结 论
本研究采用改进的QuEChERS方法建立了UPLC-MSMS检测柑橘中苯丁锡的方法,方法精密度、灵敏度、回收率和定量限均能很好地满足农药残留分析的要求。与传统的苯丁锡残留检测方法比,前处理无需衍生,简便、快速、低成本、准确、灵敏度高,仅需5 min即可完成全部检测,适合大批量快速确证和定量检测柑橘样品中痕量残留的苯丁锡,有较高的应用推广价值。
[1] JACOBSON R J, CROFT P, FENLON J. Response to fenbutatin oxide in populations of Tetranychus urticae Koch (Acari: Tetranychidae) in UK protected crops[J]. Crop Protection, 1999, 18(1): 47-52.
[2] 卫生部. GB 2763—2012 食品中农药最大残留限量[S]. 北京: 中国标准出版社, 2012.
[3] FORSYTH D S, JASON T. Detection of organotin, organomercury, and organolead compounds with a pulsed discharge detector (PDD)[J]. Analytical and Bioanalytical Chemistry, 2002, 374(2): 344-347.
[4] BRAVO M, LESPES G, PINOCHET H, et al. Determination of organotin compounds by headspace solid-phase microextraction-gas chromatography-pulsed flame-photometric detection (HS-SPME-GCPFPD)[J]. Analytical and Bioanalytical Chemistry, 2005, 383(7/8): 1082-1089.
[5] ANDRZJ W, TOMAS Z C. Determination of organotin compounds in biological samples using accelerated solvent extraction, sodium tetraethylborate ethylation, and multi-capillary gas chromatography–flame photometric detection[J]. Analytical and Bioanalytical Chemistry, 2004, 378(5): 1357-1363.
[6] IKONOMOU M G, FEMANDEZ M P, HE T, et al. Gas chromatography-high-resolution mass spectrometry based method for the simultaneous determination of nine organotin compounds in water, sediment and tissue[J]. Journal of Chromatography A, 2002, 975(2): 319-333.
[7] DEVOS C, MOENS L, SANDRA P. Determination of the acaricide fenbutatin oxide in water samples by automated headspace-SPME-GC/ MS[J]. Journal of Separation Science, 2005, 28(7): 665-668.
[8] NATALIA C, PILAR V, ROSA P, et al. Solid-phase microextraction followed by gas chromatography for the speciation of organotin compounds in honey and wine samples: a comparison of atomic emission and mass spectrometry detectors[J]. Journal of Food Composition and Analysis, 2012, 25(1): 66-73.
[9] MONTES R, CANOSA J, PABLO A, et al. Matrix solid-phase dispersion and solid-phase microextraction applied to study the distribution of fenbutatin oxide in grapes and white wine[J]. Analytical and Bioanalytical Chemistry, 2009, 395(8): 2601-2610.
[10] 何欣, 唐敏然, 何光耀. 苯丁锡反相高效液相色谱分析方法的研究[J].中国测试, 2011, 37(4): 32-35.
[11] PAOLO C, MARINELLA M, CARLO T, et al. High-performance liquid chromatographic determination of fenbutatin oxide and its persistence in peaches and nectarines[J]. Journal of Agricultural and Food Chemistry, 1992, 40(5): 901-903.
[12] 季汝泉, 朱传明. 苯丁锡的高效液相色谱分析研究[J]. 现代农药, 2005, 4(3): 21-22.
[13] BINATO G, BIANCOTTO G, ANGELETTI P R. Atomic absorption spectrometric screening and gas chromatographic-mass spectrometric determination of organotin compounds in marine mussels: an application in samples from the Venetian Lagoon[J]. Fresenius Journal of Analytical Chemistry, 1998, 361(4): 333-337.
[14] CANOSA P, MONTES R, LAMAS J P, et al. Pressurized liquid extraction followed by gas chromatography with atomic emission detection for the determination of fenbutatin oxide in soil samples[J]. Talanta, 2009, 79(3): 598-602.
[15] 刘志杏, 郭平, 王远兴, 等. 气相色谱分析柑桔类水果中残留的苯丁锡[J]. 色谱, 2009, 27(6): 760-763.
[16] WU Min, LU Jun, ZHU Yahong. Determination of fenbutatin oxide residue in citrus fruit and soil by gas chromatography with electron capture detector[J]. Chinese Journal of Pesticide Science, 2011, 13(5): 503-508.
[17] BANES K A, FUSSELL R J, STARTIN J R, et al. Determination of the pesticide fenbutatin oxide in tomatoes, cucumbers and bananas by high performance liquid chromatographic/atmospheric pressure chemical ionization-mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 1997, 11(2): 159-164.
[18] 曲斌. QuEChERS在动物源性食品兽药残留检测中的研究进展[J].食品科学, 2013, 34(5): 327-331.
[19] 谢建军, 陈捷, 李菊, 等. 改良QuEChERS法结合气相色谱串联质谱测定果蔬中20种杀菌剂[J]. 食品安全质量检测学报, 2013, 4(1): 82-88.
[20] LESUEUR C, KNITTL P, GARTNER M, et al. Analysis of 140 pesticides from conventional farming foodstuff samples after extraction with the modified QuEChERS method[J]. Food Control, 2008, 19(9): 906-914.
[21] URAIRAT K, STEVEN J L, SHUI M, et al. High throughput analysis of 150 pesticides in fruits and vegetables using QuEChERS and lowpressure gas chromatography-time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2010, 1217(43): 6692-6703.
[22] 郭德华, 邓晓军, 赵善贞, 等. 串联质谱同时检测动物源性食品中76种兽药残留[J]. 分析化学, 2010, 38(3): 318-324.
Ultra High Performance Liquid Chromatography-Tandem Mass Spectrometry Combined with QuEChERS for the Quick Detection of Fenbutatin Oxide Residue in Citrus
ZHU Yan-mei1,2, ZHAO Qi-yang1, CHEN Wei-jun1, JIAO Bi-ning1,2,3,*, ZHANG Yao-hai1
(1. Laboratory of Quality and Safety Risk Assessment for Citrus Products (Chongqing), Ministry of Agriculture, Citrus Research Institut e, Southwest University, Chongqing 400712, China; 2. College of Food Science, Southwest University, Chongqing 400715, China; 3. National Citrus Engineering Research Center, Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400712, China)
The fenbutatin oxide residue in citrus fruits was detected by optimized QuEChERS combined with ultraperformance liquid chromatography-tandem mass spectrometry (UPLC-MS-MS). Fenbutatin oxide was extracted from the samples with acetonitrile, salted out with anhydrous MgSO4and NaCl, cleaned up with octadecyl bonded phase silica gel and then analyzed by UPLC-MS-MS in multiple reaction monitoring (MRM) mode. The separation of the target pesticide residue was performed on an BEH C18column (2.1 mm×50 mm) using a mobile phase consisting of 0.1% formic acidmethanol by isocratic elution and the matrix-matched external standard calibration was used for quantitation. There was a linear relation between fenbutatin oxide content and peak area in the range of 0.001–1.0 mg/L (R2≥ 0.993 0), and the limit of quantitation was 2.0 μg/kg. The average recoveries in different matrices (citrus pulp, peel and whole fruits) at three spiked concentration levels ranged from 74.0% to 97.7% with relative standard deviations (RSDs) of 2.5%–6.9%. This method was simple, quick, cheap, environmentally friendly and safe. The accuracy and precision could meet the requirements for quick confirmation and quantitative determi nation of trace fenbutatin oxide residue in citrus fruits.
QuEChERS; ultra-performance liquid chromatography-tandem mass spectrometry; citrus; fenbutatin oxide
TS207.3
A
1002-6630(2014)04-0111-05
10.7506/spkx1002-6630-201404023
2013-04-30
国家现代农业(柑橘)产业技术体系建设专项(CARS-27);农业部农药检定所残留项目(2012P303)
朱艳梅(1986—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:zhuyanmei0828@163.com
*通信作者:焦必宁(1964—),男,研究员,本科,研究方向为果蔬质量安全及检测技术。E-mail:bljiao@tom.com
