高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化
2014-01-18余永建邓晓阳陆震鸣史劲松许正宏
余永建,邓晓阳,陆震鸣,2,史劲松,3,许正宏,2,3,*
(1.江南大学药学院,江苏 无锡 214122;2.中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室,天津 300308;3.国家固态酿造工程技术研究中心,四川 泸州 646000)
高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化
余永建1,邓晓阳1,陆震鸣1,2,史劲松1,3,许正宏1,2,3,*
(1.江南大学药学院,江苏 无锡 214122;2.中国科学院天津工业生物技术研究所 天津市工业生物系统与过程工程重点实验室,天津 300308;3.国家固态酿造工程技术研究中心,四川 泸州 646000)
优化固态发酵食醋中9种有机酸的高效液相色谱定量分析方法。色谱条件:以C18色谱柱进行分离,流动相为NaH2PO4溶液,流速为0.9 mL/min,检测波长为210 nm,可在14 min内完成检测。在优化的色谱条件下,9种有机酸的检测线性范围较宽,最低检出限为0.02~1.79 mg/L,加标回收率为96.02%~104.55%,相对标准偏差0.46%~3.52%。该方法具有灵敏、准确、稳定等优点,可用于固态发酵食醋中有机酸的测定。
固态发酵食醋;高效液相色谱;有机酸
中国传统固态酿造食醋具有悠久的历史,是深受我国人民喜爱的一种调味品[1-4]。固态发酵食醋中有机酸种类丰富,除乙酸外尚存在乳酸、苹果酸、柠檬酸、草酸、酒石酸、琥珀酸、富马酸等多种不挥发酸,对食醋的口感具有重要影响[5-7]。例如,琥珀酸可增强醋的鲜味,乳酸、苹果酸、柠檬酸、琥珀酸等可以缓冲乙酸的刺激性,使醋液酸味柔和、醇厚[8]。食醋中有机酸主要来源于固态酿造过程中各种微生物的代谢活动,且不同酿造原料(高粱、糯米、麸皮等多种谷物)和工艺生产条件所产出的食醋中有机酸组成差别较大[9-12]。因此,准确测定食醋中有机酸的种类和含量对于评价食醋品质及解析食醋酿造机理具有重要意义。
目前用于食醋有机酸定量分析的方法主要有高效液相色谱(high performance liquid chromatography,HPLC)法、离子排斥色谱法、毛细管电泳法、气相色谱法[13-17],其中HPLC法由于具有高效快速、灵敏度高、稳定性好等优点使用最为普遍。已有学者采用HPLC法对不同地域发酵食醋的有机酸组成进行了分析[18-19],对食醋发酵过程中有机酸的变化规律进行了研究[20-21]。但是目前对食醋中复杂有机酸组成的HPLC分析条件优化及其方法学评价的研究报道较少。另外,食醋中除了富含有机酸以外,尚含有大量蛋白质等生物大分子物质以及色素等小分子物质。这些物质的存在容易导致食醋有机酸HPLC分析过程中柱压升高、使用寿命降低、有机酸分离度下降等问题。前期已对有机酸HPLC分析前的食醋样品预处理方法(沉淀、固相萃取)进行了优化[15],本研究进一步对经过预处理后的醋样中9种有机酸的HPLC分析条件进行了优化及方法学评价,为固态发酵食醋中有机酸定量分析及其酿造机理解析提供了理论依据。
1 材料与方法
1.1 材料与试剂
固态发酵醋样为镇江香醋,总酸4.5 g/100 mL,主要生产原料为糯米和麸皮,生产日期为2012年4月。
磷酸、磷酸二氢钠、亚铁氰化钾、硫酸锌、乙酸(均为分析纯)、甲醇(色谱纯) 中国医药(集团)上海化学试剂公司;草酸、丙酮酸、α-酮戊二酸、焦谷氨酸、柠檬酸、乳酸、酒石酸、琥珀酸、富马酸和苹果酸(均为色谱纯) 美国Sigma-Aldrich公司。
有机酸标准溶液(0.50 mg/mL草酸、1.00 mg/mL酒石酸、0.51 mg/mL丙酮酸、0.50 mg/mL α-酮戊二酸、4.02 mg/mL乳酸、10.05 mg/mL乙酸、0.50 mg/mL柠檬酸、0.50 mg/mL焦谷氨酸、1.00 mg/mL琥珀酸) 中国医药(集团)上海化学试剂公司;所用试剂均为分析纯。
1.2 仪器与设备
PHS-25C型pH计 上海鹏顺科学仪器有限公司;EL204型电子天平 瑞士Mettler Toledo公司;U3000高效液相色谱仪 美国Dionex公司;Sep-Pak C18固相萃取小柱 美国Waters公司。
1.3 方法
1.3.1 食醋样品的预处理[22]
取5 mL醋样于100 mL容量瓶中,加入2 mL 10.6%(m/m)亚铁氰化钾溶液和2 mL 30%(m/m)硫酸锌溶液,摇匀后用超纯水定容,静置0.5 h后用双层滤纸过滤,滤液用0.22 μm微孔滤膜过滤,然后采用Sep-Pak C18固相萃取小柱处理(小柱用5 mL甲醇进行活化,然后用5 mL超纯水平衡),将样品溶液缓慢流过小柱,流速1 mL/min,所得溶液用于HPLC分析。
1.3.2 HPLC分析条件的优化
色谱柱:Waters Atlantis T3(150 mm×4.6 mm,5 μm);检测波长:分别对9种有机酸的标准溶液进行全波长扫描(190~400 nm),确定样品的检测波长;流动相:比较3种磷酸盐溶液(NaH2PO4、KH2PO4、 (NH4)2HPO4)在不同浓度(0.01、0.02、0.03 mol/L)、不同pH值(2.3、2.5、2.7、2.9、3.1,用H3PO4调节)、不同柱温(25、30、35、40 ℃)以及流速(0.5、0.6、0.7、0.8、0.9、1.0 mL/min)条件下对食醋有机酸保留时间和分离度的影响;进样量10 μL。
1.3.3 HPLC分析方法的验证
1.3.3.1 线性关系
取不同体积(0.0、0.1、0.2、0.5、2.0、4.0、6.0、8.0 mL)的有机酸标准溶液,用超纯水定容于10 mL容量瓶中,混匀后分别进行HPLC分析。绘制峰面积-质量浓度标准曲线,计算各有机酸的线性范围、回归方程及相关系数,并以信噪比RSN=3对应的质量浓度确定各有机酸的检出限。
1.3.3.2 精密度
1 d内连续6次对同一有机酸标样进行HPLC分析,测定各有机酸的保留时间和峰面积,计算精密度(以相对标准偏差表示)。
1.3.3.3 准确度
取同一醋样2份(5.0 mL),其中1份作为本底,另1份加入有机酸标准溶液5 mL,分别预处理后进行HPLC分析,计算各有机酸的加标回收率。
1.3.3.4 重复性
取同一醋样6份(5.0 mL),分别预处理后进行HPLC分析,计算相对标准偏差。
1.3.3.5 稳定性
取5.0 mL醋样进行预处理,分别在制样不同时间后(0、2、4、8、12、24 h)进行HPLC分析,计算相对标准偏差。
2 结果与分析
2.1 检测波长的选择
本研究分别对9种有机酸在190~400 nm进行全波长扫描,发现各种有机酸在210 nm波长处均有较大的吸收峰,故采用210 nm作为醋样中9种有机酸的检测波长,此结果与赵景婵等[23]报道一致。
2.2 流动相的选择
磷酸盐缓冲溶液在紫外区几乎无吸收,是有机酸分析最常用的的流动相[17]。本研究中比较了不同缓冲液作为流动相时,9种有机酸的分离情况。结果表明,上述3种磷酸盐缓冲溶液对9种有机酸的出峰顺序和分离效果无显著性差异。但是NaH2PO4缓冲液作为流动相时,有机酸的分析时间最短(<17 min),而另外2种缓冲液则需要20 min完成所有有机酸的分析,故选择NaH2PO4溶液为本实验的流动相。
2.3 流动相浓度的选择
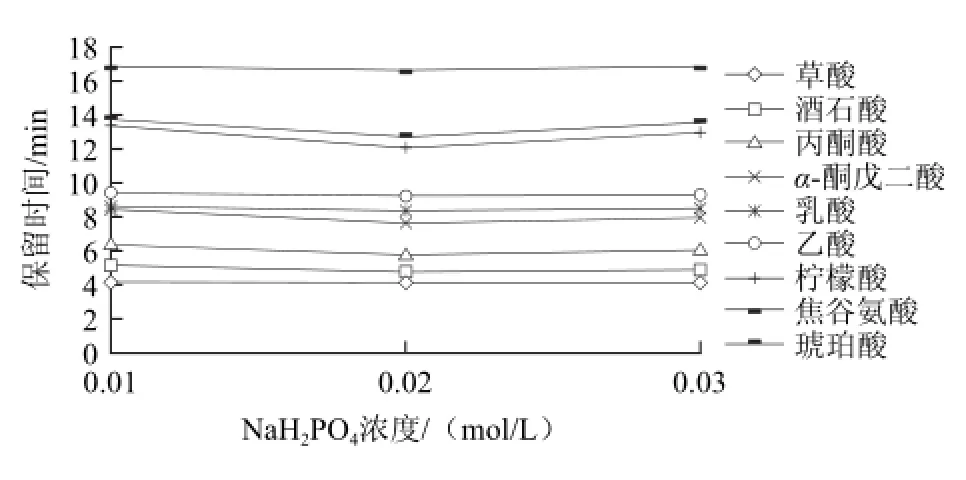
图1 不同缓冲液浓度对9种有机酸保留时间的影响Fig.1 Effect of buffer concentration on retention time
由图1可知,磷酸盐缓冲溶液的浓度直接影响其缓冲容量、在流动相中的存在形式及溶液的离子强度,从而影响有机酸在色谱柱上的分离效果。缓冲溶液的浓度越高,待测有机酸的存在形式越稳定,但缓冲溶液的浓度不能过高,因为其浓度增高时,离子强度也增大,对组分分离不利,同时影响泵和柱子的寿命,增加流动相的本底吸收,降低测定的灵敏度[23]。本实验中NaH2PO4溶液浓度为0.01 mol/L时,α-酮戊二酸和乳酸不能分开,而流动相浓度为0.02、0.03 mol/L时,有机酸均能得到有效分离(图1)。考虑到高盐浓度对泵和柱子的不利影响,本实验选用0.02 mol/L NaH2PO4溶液作为流动相。
2.4 流动相pH值的选择
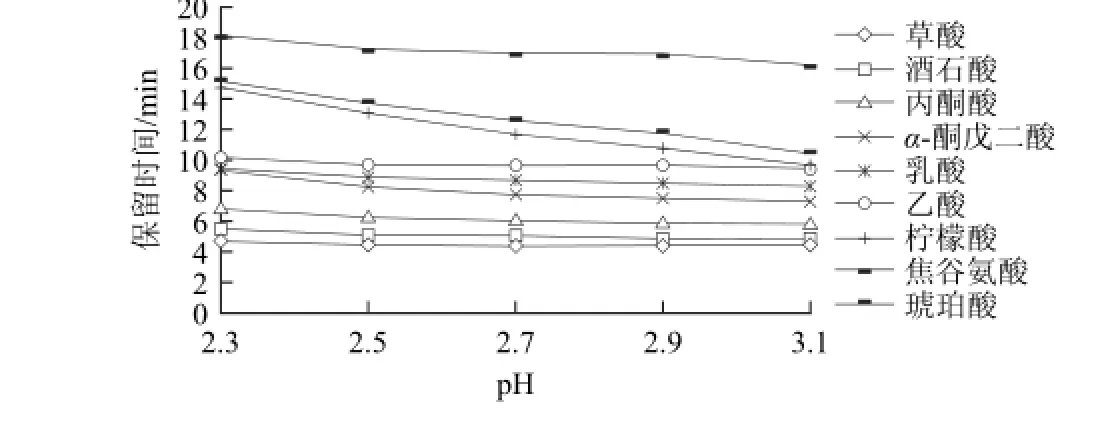
图2 流动相的pH值对保留时间的影响Fig.2 Effect of mobile phase pH on retention time
由图2可知,当pH值为2.3时,α-酮戊二酸和乳酸不能分开,柠檬酸和焦谷氨酸没有分开;pH值为2.5时,柠檬酸和焦谷氨酸仍然没有完全分开;逐步提高pH值,各酸的保留时间提前,9种有机酸逐渐得到分离,但草酸和酒石酸、柠檬酸和乙酸的分离度却逐渐减小;当pH值为3.1时,柠檬酸与乙酸的色谱峰重叠。因此,最终确定最适流动相pH值为2.7。
2.5 柱温的选择
根据色谱理论,柱温是影响柱效和分离度的主要因素,柱温升高可以降低流动相的黏度、提高传质效率[18],降低保留时间,但柱温太高不利于有机酸的分离且影响色谱柱的使用寿命。本实验结果表明,25 ℃时柠檬酸和焦谷氨酸分离不佳;随着色谱柱温度的升高,各有机酸的保留时间均提前,尤其是琥珀酸、焦谷氨酸和柠檬酸;当温度为40 ℃时,乙酸和柠檬酸不能完全分离(图3)。综合考虑有机酸的保留时间与分离度,最终将色谱柱温度定为35 ℃。
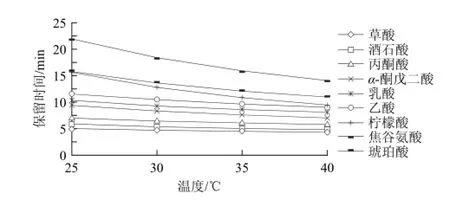
图3 柱温对保留时间的影响Fig.3 Effect of column temperature on retention time
2.6 流速的选择
实验结果表明,流速在0.5~1.0 mL/min范围内有机酸的分离效果相差不大;流速越低,保留时间越长。综合考虑流速对保留时间、色谱柱压力的影响,本实验选择流速为0.9 mL/min,9种有机酸能在14 min内完成分析,此时系统压力适中,灵敏度也足够高。
2.7 线性范围和检出限
将不同质量浓度的有机酸标准溶液进行HPLC分析,以峰面积外标法定量,绘制各有机酸的峰面积-质量浓度曲线,得到9种有机酸回归方程及相关系数,并以3倍噪声对应的质量浓度计算出各有机酸的最低检出限,结果见表1。有机酸的峰面积与进样质量浓度呈良好的线性关系,且线性范围宽、检出限较低,表明此方法灵敏度较高。
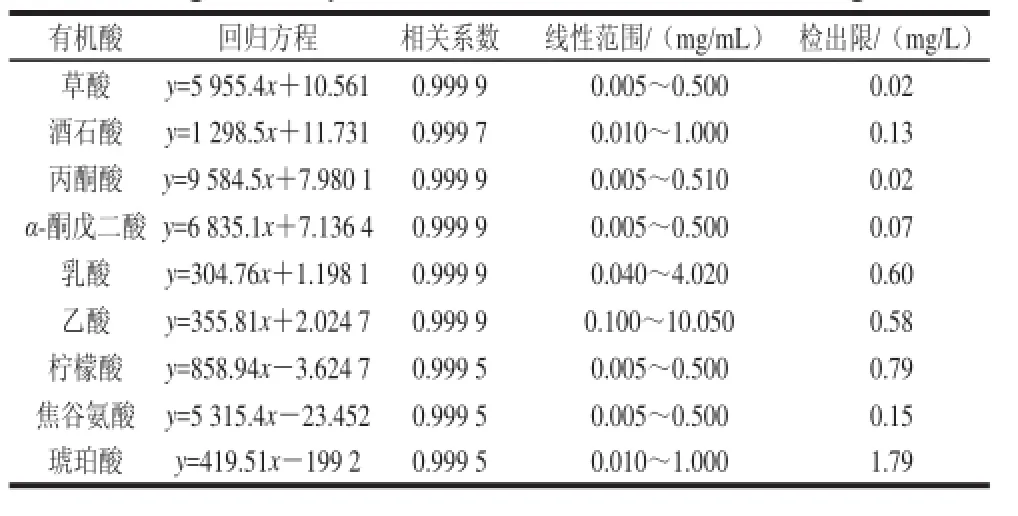
表1 有机酸标准曲线的线性参数Table 1 Regression equations and correlation coefficients for organic acids
2.8 精密度
本实验中各有机酸峰面积的相对标准偏差为0.16%~2.38%(表2),说明该方法的精密度较好。
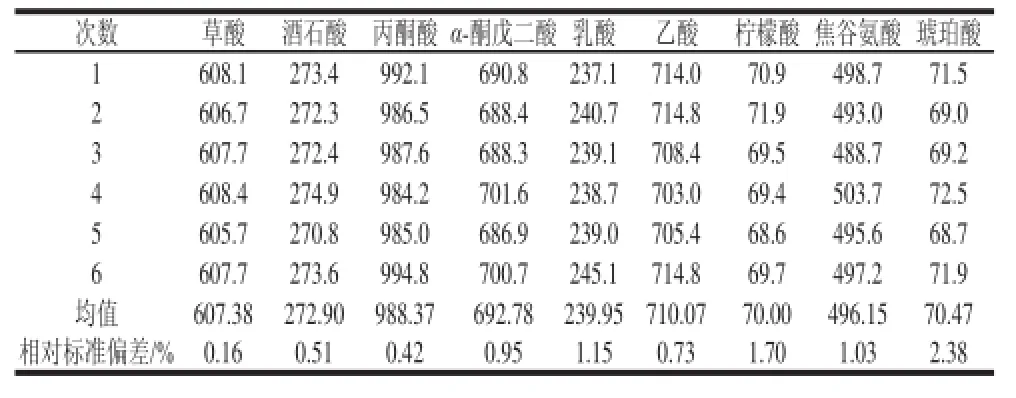
表2 测定方法的精密度Table 2 Precision of the method mAU
2.9 准确度
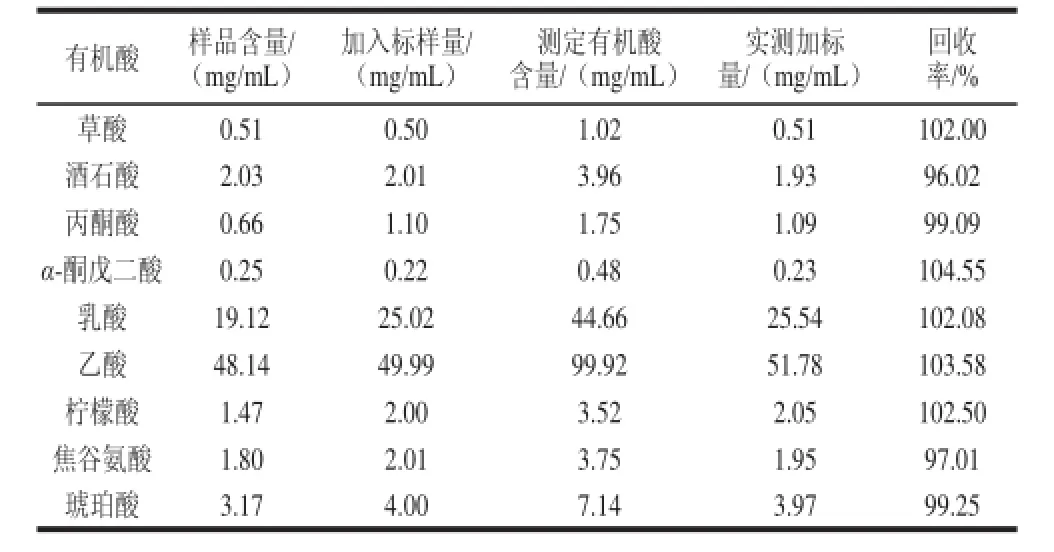
表3 有机酸加标回收率Table 3 Recovery of organic acids
由表3可知, 9种有机酸的加标回收率在96.02%~104.55%之间,说明该方法的准确度较高。
2.10 重复性

表4 测定方法的重复性Table 4 Repeatability of the method mg/mL
由表4可知,有机酸重复实验的相对标准偏差在0.46%~3.52%之间,说明本方法的重复性比较好。
2.11 稳定性
由表5可知,样品在24 h内各有机酸的质量浓度无显著差异,相对标准偏差为0.95%~4.17%,说明样品溶液在室温放置24 h内基本稳定。
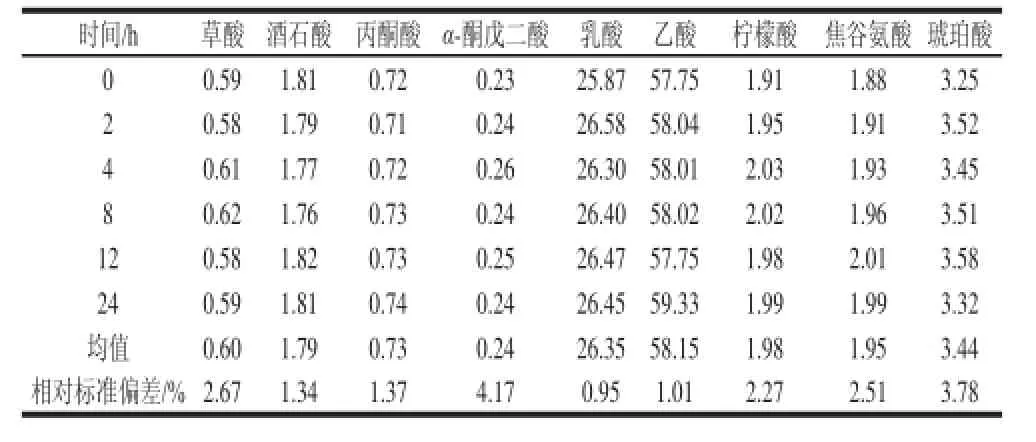
表5 测定方法的稳定性Table 5 Stability of the method mg/mL
2.12 典型食醋样品的分析
经过单因素优化后获得了最优HPLC分析条件:以C18色谱柱进行分离,柱温35℃,流动相为0.02 mol/L NaH2PO4溶液pH 2.7,流速0.9 mL/min,检测波长210 nm,整个分析可在14 min内完成。采用优化后的分析方法获得的典型食醋样品和有机酸标样的HPLC分析图谱见图4。
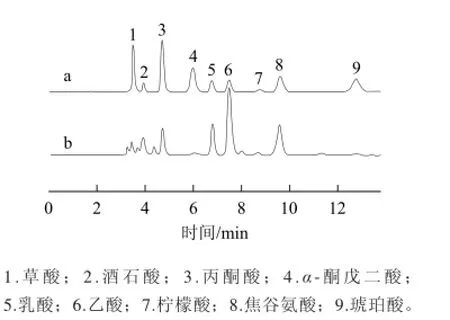
图4 有机酸标样(a)和典型食醋样品(b)有机酸HPLC分析的图谱Fig.4 Chromatograms of organic acid standards (a) and typical solid-state fermented vinegar (b)
3 结 论
本实验对固态发酵食醋有机酸的HPLC分析条件进行了优化,获得了最优色谱条件:以C18色谱柱进行分离,柱温35 ℃,流动相为0.02 mol/L NaH2PO4溶液(pH 2.7),流速0.9 mL/min,检测波长210 nm,整个分析可在14 min内完成。该方法的线性关系良好,且准确度、灵敏度、精密度较高,重复性好,测定结果稳定可靠,适用于固态发酵食醋中有机酸的定量分析。
[1] 萧凤歧. 食醋的历史与文化[J]. 中国酿造, 2000, 18(4): 31-32.
[2] 赵良启, 李丽. 我国食醋生产技术的历史、现状与发展趋势: 上[J].中国调味品, 2005, 30(1): 3-6.
[3] 赵良启, 李丽. 我国食醋生产技术的历史、现状与发展趋势: 下[J].中国调味品, 2005, 30(2): 15-17.
[4] 舒静, 陈轩, 潘从道, 等. 不同品牌食醋味感特征的电子舌分析[J].中国调味品, 2013, 38(8): 95-98; 101.
[5] LIU Dengru, ZHU Yang, BEEFTINK R, et al. Chinese vinegar and its solid-state fermentation process[J]. Food Reviews International, 2004, 20(4): 407-424.
[6] 王贵双, 高丽华, 赵俊平, 等. 酿造食醋与配制食醋中有机酸的分析研究[J]. 中国酿造, 2011, 29(11): 146-148.
[7] 刘晓伟, 杨代明, 孙桂芳, 等. 食醋有机酸的液相指纹图谱建立方法研究[J]. 食品工业科技, 2011, 32(5): 403-406.
[8] 汪建国, 冯德明. 嘉兴玫瑰米醋中有机酸风味特征的分析探讨[J].江苏调味副食品, 2011, 28(1): 27-29.
[9] XU Wei, HUANG Zhiyong, ZHANG Xiaojun, et al. Monitoring the microbial community during solid-state acetic acid fermentation of Zhenjiang aromatic vinegar[J]. Food Microbiology, 2011, 28(6): 1175-1181.
[10] CHEN Quansheng, DING Jiao, CAI Jianrong, et al. Simultaneous measurement of total acid content and soluble salt-free solids content in Chinese vinegar using near-infrared spectroscopy[J]. Journal of Food Science, 2012, 77(2): C222-C227.
[11] 辛梅华, 李明春, 篮心仁, 等. 反相HPLC快速测定调味品中有机酸[J].中国调味品, 2003, 28(4): 36-39.
[12] 周永治. 食醋的生产原理[J]. 江苏调味副食品, 2007, 24(4): 21-24.
[13] 王贵双, 唐坤甜, 鲁绯, 等. 离子交换色谱法测定食醋中有机酸[J].中国酿造, 2010, 28(7): 166-168.
[14] 薛霞, 霍艳敏, 王骏, 等. 固相萃取-高效液相色谱法测定果醋中7种有机酸[J]. 食品科学, 2012, 33(14): 247-250.
[15] 张颖, 张健. 利用HPLC和GC全面分析葡萄醋中有机酸[J]. 中国调味品, 2006, 31(2): 49-53.
[16] 周建科, 李路华, 岳强, 等. 离子排斥色谱法测定苹果醋中的有机酸[J].中国酿造, 2005, 22(12): 53-55.
[17] 余宁华, 陆震鸣, 许伟, 等. 基于主成分分析的中国发酵食醋有机酸含量差异性分析[J]. 食品与发酵工业, 2010, 36(10): 144-148.
[18] 吕利华, 梁丽绒,赵良启. 山西老陈醋中有机酸的HPLC测定分析[J].食品科学, 2007, 28(11): 456-459.
[19] 郑彦婕, 陈素娟, 李锦才, 等. 地理标志保护醋中有机酸差异性分析[J].食品与发酵工业, 2010, 36(12): 173-176.
[20] 张丽娟, 许伟, 许泓瑜, 等. 恒顺香醋固态发酵过程中有机酸的变化分析[J]. 中国调味品, 2009, 34(2): 106-109.
[21] 高年发, 任雪. HPLC测定独流老醋陈酿过程中有机酸变化[J]. 中国酿造, 2010, 28(3): 143-147.
[22] 余永建, 邓晓阳, 陆震鸣, 等. 固态发酵食醋有机酸组成分析中样品预处理方法的研究[J]. 食品工业科技, 2013, 34(4): 198-200; 211.
[23] 赵景婵, 郭治安, 常建华, 等. 有机酸类化合物的反相高效液相色谱法的分离条件研究[J]. 色谱, 2001, 19(3): 260-263.
[24] 杨毅, 李崎, 陈蕴, 等. 反相高效液相色谱法(RP-HPLC)测定啤酒中有机酸[J]. 食品与发酵工业, 2003, 29(8): 6-12.
[25] 张军, 韩英素, 高年发, 等. HPLC法测定葡萄酒中有机酸的色谱条件研究[J]. 酿酒科技, 2004(2): 91-93.
An Optimized Method for the Analysis of Organic Acids in Solid-State Fermented Vinegars by High Performance Liquid Chromatography
YU Yong-jian1, DENG Xiao-yang1, LU Zhen-ming1,2, SHI Jin-song1,3, XU Zheng-hong1,2,3,*
(1. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, China; 2. Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China; 3. National Engineering Research Center of Solid-State Brewing, Luzhou 646000, China)
Quantitative determination of 9 organic acids in traditional Chinese vinegars by high performance liquid chromatography (HPLC) was optimized. The procedure of HPLC analysis was carried out on a C18column using sodium dihydrogen phosphate as the mobile phase. The flow rate was 0.9 mL/min and the detection wavelength was 210 nm. The HPLC analysis was completed within 14 min. The linear ranges for 9 types of organic acids were wide and the limits of detection were 0.02–1.79 mg/L. The recovery rates were in the range of 96.02%–104.55% with relative standard deviation (RSD) of 0.46%–3.52%. This method is sensitive, accurate, repeatable and suitable for the determination of organic acids in traditional Chinese vinegars.
solid-state fermented vinegar; high performance liquid chromatography; organic acids
TS207.3
A
1002-6630(2014)04-0055-05
10.7506/spkx1002-6630-201404012
2013-05-04
国家自然科学基金面上项目(31271922);国家高技术研究发展计划(863计划)项目(2012AA021301;2013AA102106);国家固态酿造工程技术研究中心开放课题(2011B2211;GCKF201109)
余永建(1976—),男,博士研究生,研究方向为发酵工程。E-mail:1439878431@qq.com
*通信作者:许正宏(1976—),男,教授,博士,研究方向为生物工程。E-mail:zhenghxu@jiangnan.edu.cn
