葡萄籽原花青素对顺铂导致H9c2细胞毒性的保护作用
2014-01-18郭培培郭卓雨赵艳萌高丽萍
郭培培,郭卓雨,赵艳萌,高丽萍*
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
葡萄籽原花青素对顺铂导致H9c2细胞毒性的保护作用
郭培培,郭卓雨,赵艳萌,高丽萍*
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
目的:研究葡萄籽原花青素对顺铂诱导大鼠H9c2心肌细胞损伤的影响并探讨其可能机理。方法:体外培养H9c2细胞,噻唑蓝法测定葡萄籽原花青素、顺铂对H9c2细胞生长的影响及葡萄籽原花青素对顺铂所致H9c2细胞毒性的影响,观察细胞的形态变化,并通过检测H9c2细胞及培养液中超氧化物歧化酶活性、丙二醛含量研究其可能机理。结果:葡萄籽原花青素能明显改善顺铂所致H9c2细胞形态变化,并抑制顺铂所致H9c2细胞及培养液中超氧化物歧化酶活性的降低、丙二醛含量的升高。结论:体外培养条件下葡萄籽原花青素能改善顺铂诱导的H9c2细胞的损伤,其作用机制可能与调高H9c2细胞的抗氧化能力有关。
葡萄籽原花青素;顺铂;H9c2细胞;抗氧化
顺铂(cis-diamminedichloroplatinum,CDDP)是临床上肿瘤治疗中常用的化疗药物之一,但随着使用剂量增加,其毒负效应也随之增多,肾毒性是其主要负效应,有研究报道CDDP治疗一般也伴随心脏毒性[1],CDDP和其他抗癌药物联合使用常会引起严重的心肌病。多种研究表明CDDP的毒负效应和氧化应激有密切的关系[2-6]。原花青素是一种广泛存在于植物界的多酚类化合物,主要位于植物的籽、皮、核部位[7-8],近半个世纪以来人们对从多种植物中提取的原花青素开展了大量研究,尤以葡萄籽原花青素(grape seed proanthocyanidin extract,GSPE)的研发工作进行地最为深入和广泛。迄今为止,相关研究人员已经从葡萄的籽和皮中分离、鉴定出了20余种类的原花青素,实验证实其在体内的抗氧化能力是VE的50倍、VC的20倍,强抗氧化能力使得原花青素这一天然、无毒、安全、高效的物质受到人们的广泛关注及重视[9];此外,原花青素被发现具有抗疲劳、抗衰老、抗病毒、抗肿瘤、降血脂、降血压、健脑益智、改善免疫功能等多种生理活性[10-16],如今以原花青素为主要成分的保健食品风靡全球;原花青素还被作为防腐剂用于食品工业中以延长食品货架期,在普通的食品配料、添加剂中也有应用以达到强化营养的功效。
GSPE因富含酚羟基而具有较强的自由基清除能力,可以拮抗各种原因所致氧化应激状态,从而发挥强抗氧化活性[12]。本实验利用CDDP诱导H9c2细胞产生损伤,研究GSPE对CDDP诱导心肌细胞损伤的影响,并从氧化应激角度探讨其可能机理,相关研究报道较为少见,以期为开发新型GSPE保健食品提供参考。
1 材料与方法
1.1 材料与试剂
H9c2细胞购自中国科学院细胞中心。
CDDP (注射用粉剂) 齐鲁制药公司;GSPE(纯度≥95%) 天津市尖峰天然产物研究开发有限公司;新生牛血清 美国Gibico公司;Dulbecco’s Modified Eagle’s Medium(DMEM)培养液 美国Hycolon公司;噻唑蓝、胰酶、双抗 美国Sigma公司;Bicinchonininc acid(BCA)蛋白浓度测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 方法
1.2.1 细胞培养及药物处理
H9c2心肌细胞常规培养于含有20%新生胎牛血清和含有1%双抗的DMEM高糖培养基中,培养箱环境为37 ℃、含5%CO2,饱和湿度。待细胞融合至80%~90%时传代,每隔2 d换一次培养基,每4~5 d传代1次,取对数生长期细胞接种于培养瓶中。CDDP用生理盐水溶解配制溶液,GSPE用双蒸水溶解配制溶液,使用培养基稀释到所需浓度[2]。
1.2.2 细胞活力实验
1.2.2.1 CDDP对H9c2细胞生长的影响
将100 øL细胞密度为1.5×105个/mL的H9c2细胞悬液接种到96孔板中,待细胞生长到融合状态,加入终质量浓度分别为0、20、40、60、80、160 øg/mL的CDDP,每组设5个复孔,培养箱孵育24 h,后加入噻唑蓝使其终质量浓度为0.5 mg/mL,继续孵育4 h,弃上清加二甲基亚砜200 øL/孔,适当混匀570 nm波长处检测吸光度(A),以CDDP终浓度为0孔作为空白对照孔,按式(1)计算细胞抑制率,由此确定CDDP诱导H9c2细胞损伤模型的最佳使用浓度。

1.2.2.2 GSPE对H9c2细胞生长的影响
处理方法同上,GSPE终质量浓度依次为:0、25、50、80、100、120 øg/mL,按式(2)计算细胞生长存活率,由此确定GSPE保护H9c2细胞的最佳浓度。

1.2.2.3 GSPE对CDDP诱导H9c2细胞毒性的影响
实验分为空白对照组、CDDP模型组、GSPE保护组1(GSPE 80 øg/mL)、GSPE保护组2(GSPE 100 øg/mL)。处理方法同上,加入CDDP前30 min加入GSPE,药物组加药时其他相应组加入同体积的生理盐水或双蒸水。计算细胞生长存活率。
1.2.3 细胞形态观察
实验分组同1.2.2.3节,使用倒置显微镜取像,观察CDDP对H9c2细胞形态的影响及GSPE对CDDP诱导H9c2细胞形态改变的影响。
1.2.4 H9c2细胞蛋白含量测定及MDA含量、SOD活力测定
实验分组、细胞培养同上,待药物处理结束,收集细胞培养液,消化细胞并收集,后磷酸盐缓冲液洗两遍,离心弃上清,使用细胞裂解液(含苯甲基磺酰氟)进行低温裂解30 min,后进行冻解(-80 ℃、15 min,37 ℃、5 min,连续3次),12000 r/min离心10 min,取上清按照试剂盒测定SOD活力、MDA含量。
1.3 数据统计
2 结果与分析
2.1 CDDP对H9c2细胞生长的影响
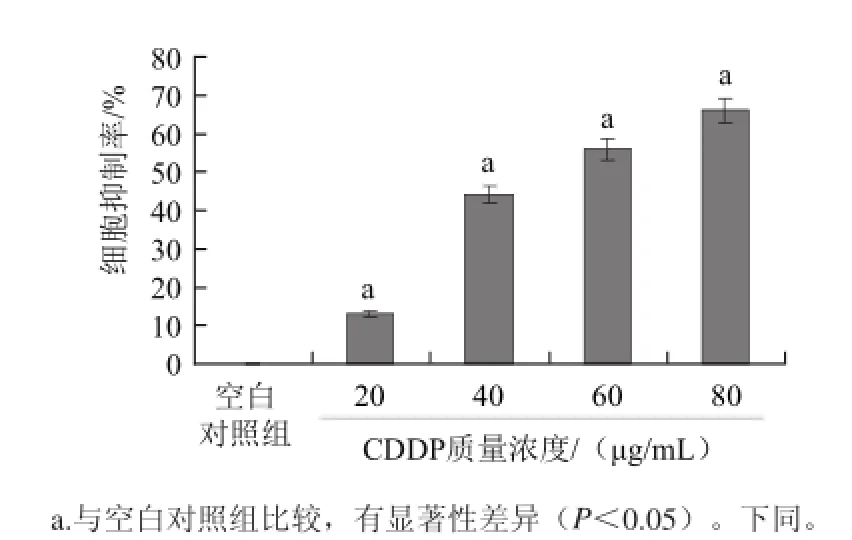
图1 CDDP对H9c2细胞生长的影响Fig.1 Effect of CDDP on the survival of H9c2 cells
由图1可见,与空白对照组比较,随CDDP质量浓度升高,细胞生长抑制率逐渐升高,CDDP质量终浓度为60 μg/mL时细胞生长率为44/%,接近半数致死质量浓度,选此作为造模质量浓度。
2.2 GSPE对H9c2细胞存活率的影响
由图2可见,与空白对照组比较,随GSPE终质量浓度的提高,细胞存活率先升高后下降,以80、100、120 øg/mL的GSPE质量浓度效果最为明显,选此作为保护组质量浓度。
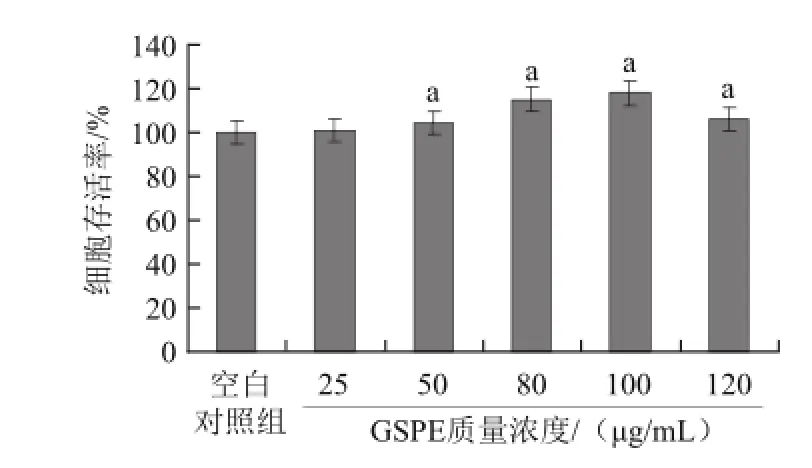
图2 GSPE对H9c2细胞生长的影响Fig.2 Effect of GSPE on the survival of H9c2 cells
2.3 GSPE对CDDP诱导H9c2细胞毒性的影响
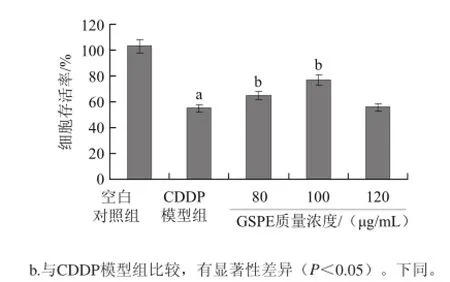
图3 GSPE对CDDP诱导H9c2细胞毒性的影响Fig.3 Effect of GSPE on CDDP-induced toxicity in H9c2 cells
由图3可知,CDDP模型组与空白对照组相比细胞存活率明显下降,80、100 øg/mL的GSPE能使CDDP诱导的细胞存活率下降明显提升(P<0.05),选二者质量浓度作为保护质量浓度分别为GSPE1、GSPE2进行后续实验。
2.4 GSPE对CDDP诱导细胞形态变化的影响
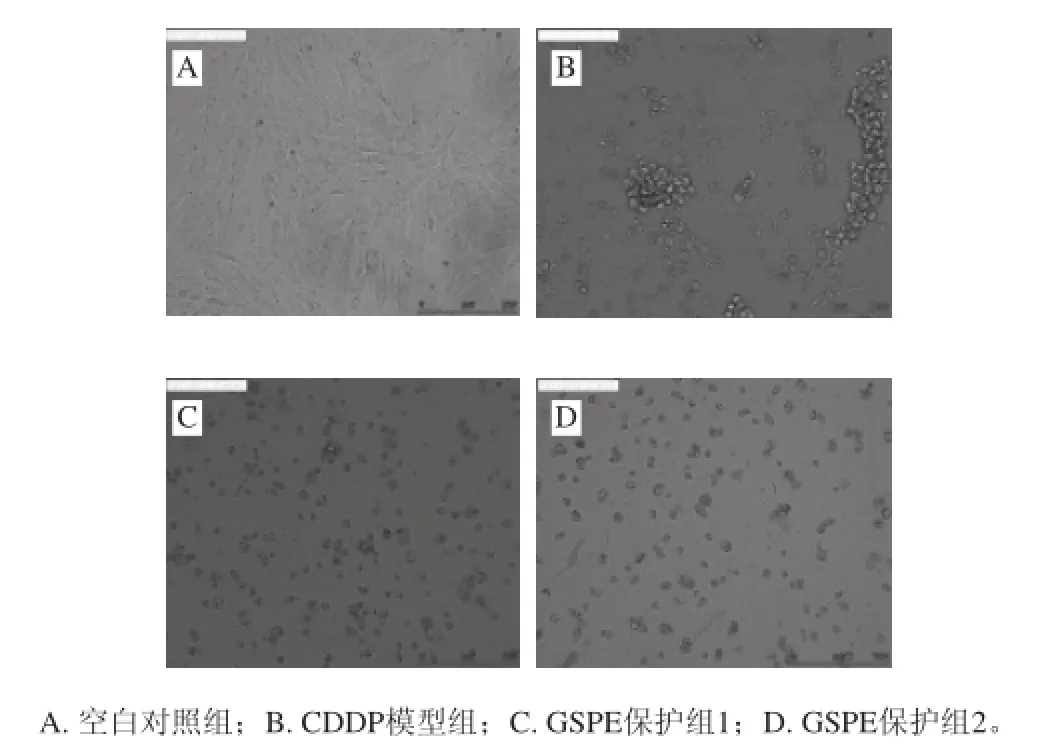
图4 GSPE对CDDP诱导细胞形态变化的影响(×20)Fig.4 Effect of GSPE on CDDP-induced morphologic change of H9c2 cells (×20)
由图4可知,CDDP可明显诱导细胞形态变化,导致细胞由正常梭形、贴壁、密集状态变为漂浮、聚团、稀疏甚至自溶状态,而GSPE保护组可以改善CDDP引起的漂浮、聚团、自溶情况。
2.5 GSPE对CDDP诱导的H9c2细胞MDA含量变化的影响
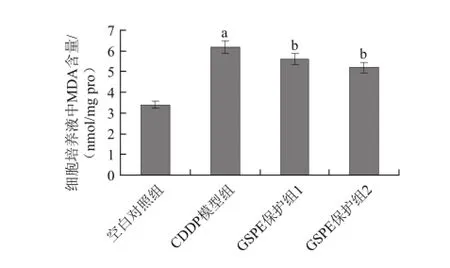
图5 GSPE对CDDP诱导的H9c2细胞培养液MDA含量变化的影响Fig.5 Effect of GSPE on CDDP-induced changes in MDA content of H9c2 cell culture medium
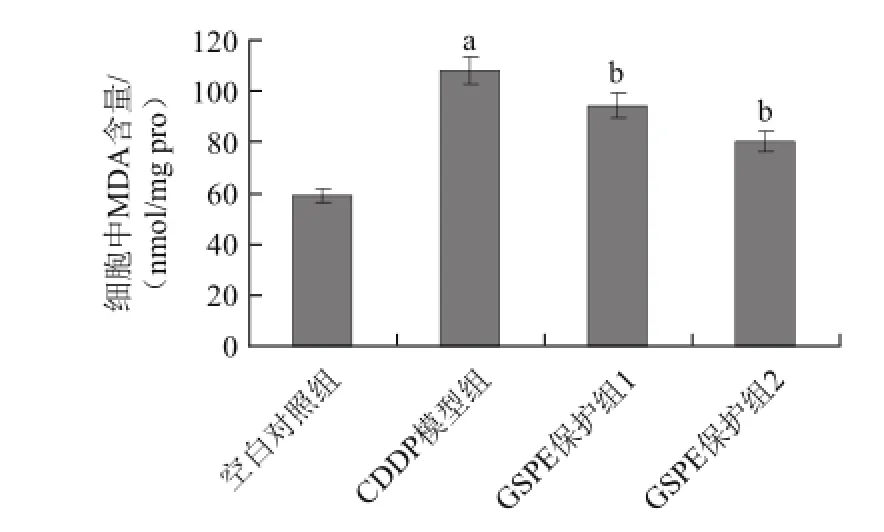
图6 GSPE对CDDP诱导的H9c2细胞中MDA含量变化的影响Fig.6 Effect of GSPE on CDDP-induced changes in MDA content of H9c2 cells
由图5、6可知,CDDP可引起细胞内MDA含量的升高,而GSPE可以对其产生拮抗即使得CDDP诱导的细胞MDA含量的升高下降,且这种拮抗作用效果明显(P<0.05),尤以80 μg/mL的GSPE效果较为明显。
2.6 GSPE对CDDP诱导的H9c2细胞SOD活性变化的影响
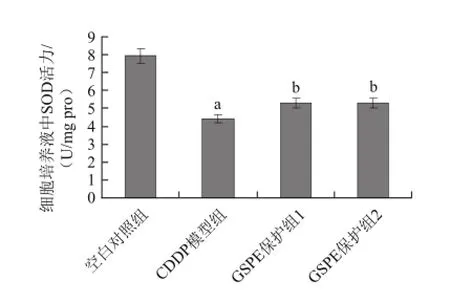
图7 GSPE对CDDP诱导的H9c2细胞培养液中SOD活性变化的影响Fig.7 Effect of GSPE on CDDP-induced changes in SOD activity of H9c2 cell culture medium

图8 GSPE对CDDP诱导的H9c2细胞中SOD活性变化的影响Fig.8 Effect of GSPE on CDDP-induced changes in SOD activity of H9c2 cells
由图7、8可知,CDDP模型组与空白对照组相比较,细胞、细胞培养液中SOD活性都明显下降,GSPE保护组能使CDDP诱导的SOD活性的下降明显提升(P<0.05),80 μg/mLGSPE的保护效果较为明显。
3 讨 论
CDDP自用于癌症治疗以来表现出广泛的抗癌活性[17-19]且疗效显著,然而同时伴随多种毒副效应[19-21],相关研究证实了氧化应激在CDDP所致毒负效应中的重要性,该药可以引起活性氧类物质的产生如超氧化物阴离子自由基、羟自由基等[22]。近年来各种方法用于减轻CDDP导致的毒负效应,其中抗氧化物质的效果良好,本实验就从抗氧化能力较强的葡萄籽原花青素着手研究了其在顺铂诱导心肌细胞损伤中的影响。
自由基是机体代谢的一种中间产物,有强氧化性且能产生连锁反应对机体造成损伤,同时使细胞代谢受到影响甚至导致细胞凋亡[23],在化疗药物导致的心脏继发性损害中它是一个重要成因,可以引起脂质过氧化反应导致心肌细胞膜的损伤、破坏其完整性[24]。MDA作为脂质过氧化反应的一种重要代谢产物,其含量增加量与膜损伤的严重程度有关,可用于间接判断氧自由基对细胞造成的损伤。本实验结果中CDDP模型组细胞中MDA含量明显增加,说明CDDP使心肌组织中的脂质过氧化反应加强导致了心脏毒性,细胞培养基中MDA含量也明显升高这提示CDDP诱发的自由基破坏了细胞膜的完整性使得MDA透过细胞膜发生了外渗;GSPE使MDA含量明显下降,说明GSPE可以通过抑制脂质过氧化反应的作用发挥心肌细胞的保护功能,这与使用噻唑蓝法“观察GSPE对CDDP诱导细胞损伤的影响”结果一致,即在CDDP模型组细胞存活率明显下降而GSPE保护组细胞存活率明显提升(P<0.05)。SOD是生物体内的一种天然抗氧化酶,可以清除自由基提高机体的抵抗能力,若机体活性氧增多,该物质会因消耗而使自身活性下降,进而降低机体的抗氧化能力[25]。实验中CDDP模型组细胞SOD活性明显下降,可能是CDDP进入机体后诱发产生自由基,脂质过氧化反应增强及自由基引发的连锁反应进一步产生了新的自由基,消耗大量SOD并使其活性下降,细胞膜的不完整性使得SOD破膜外渗,这一现象在细胞培养液也可以观察得到,机体的抗氧化能力下降,进一步引发CDDP对机体的损伤;使用GSPE后细胞SOD活性明显提升,表明GSPE一方面具有较强的抗氧化能力,一方面可与SOD协同提高了机体抗氧化体系的抗氧化能力,阻碍了CDDP诱发的自由基对机体的氧化侵袭。
本研究表明GSPE可以拮抗CDDP引发的氧化应激效应、减轻CDDP诱导的心肌细胞损伤,这与前人研究的氧化应激在CDDP毒副作用中的重要性结论一致。为GSPE应用于临床以提高CDDP的疗效、为肿瘤治疗患者提供潜在的医用铺助品或营养保健品提供了理论依据,同时有助于变废为宝、充分开发葡萄籽的实用价值,创造潜在的社会收益和经济收益。对于CDDP的心肌细胞毒性产生机制及GSPE产生的拮抗作用是否有其他机制参与,有待进一步研究。
[1] CHVETZOFF G, BONOTTE B, CHAUFFERT B. Anticancer chemotherapy. Prevention of toxicity[J]. Presse Méd, 1998, 27: 2106-21 12.
[2] 李贞, 高丽萍, 冷洪涛, 等. 葡萄籽原花青素对顺铂所致人胚肾细胞毒性的拮抗作用[J]. 食品科学, 2011, 32(7): 315-318.
[3] 冷洪涛, 高丽萍, 张海莲, 等. 枸杞多糖对顺铂所致人胚肾细胞毒性的拮抗作用[J]. 广东医学, 2011, 32(22): 2929-2931.
[4] 李贞, 郭 豫, 高丽萍, 等. 番茄红素对顺铂所致肾衰大鼠NO、NOS的影响[J]. 广东医学, 2010, 31(15): 1954-1955.
[5] 赵钰, 刘素雁, 李春媚, 等. 卡维地洛的抗氧化作用对顺铂肾损伤的影响[J]. 哈尔滨医科大学学报, 2008, 42(1): 63-66.
[6] 李春媚, 赵钰, 阮颖新, 等. 卡维地洛对顺铂致大鼠急性肾衰竭的预防作用[J]. 中国药理学与毒理学杂志, 2007, 21(5): 434- 437.
[7] 涂佳, 邓学良, 周文化, 等. 野生毛葡萄常规营养成分和原花青素含量分析[J]. 食品与机械, 2010, 26(2): 82 -85.
[8] MONAGAS M, QUINTANILLA-LOPEZ J E, GOMEZ-CORVESO C, et al. MALDITOF MS analysis of plant proanthocyanidins[J]. Pharm Biomed Anal, 2010(2): 358-372.
[9] 毕玲, 傅柏平. 葡萄籽原花青素提取物的研究进展[J]. 中国新药杂志, 2008, 17(17): 1478-1480.
[10] 孙传范. 原花青素的研究进展[J]. 食 品与机械, 2010, 26(4): 146-148; 152.
[11] 张妍, 吴秀春. 原花青素研究进展[J]. 中药药理与临床, 2011, 27(6): 112-116.
[12] 吴英俊, 梁忆非, 董嘉楠. 葡萄籽原花青素的研究进展[J]. 热带医学杂志, 2010, 10(8): 1025-1028.
[13] HSU C P, LIN Y H, CHOU C C, et al. Mechanisms of grape seed procyanidin-induced apoptosis in colorectal carcinoma cells[J]. Anticancer Res, 2009, 29(1): 283-289.
[14] LU Jianming, ZHANG Keqiang, CHEN Shiuan, et al. Grape seed extract inhibits VEGF expression via reducing HIF-1alpha protein expression[J]. Carcinogenesis, 2009, 30(4): 636-644.
[15] SHARMA S D, MEERAN S M, KATIYAR S K. Proanthocyanidins inhibit in vitro and in vivo growth of human non-small cell lung cancer cells by inhibiting the prostaglandin E(2)and prostaglandin E(2) receptors[J]. Mol Cancer Ther, 2010, 9(3): 569-580.
[16] SHARMA S D, KATIYAR S K. Dietary grape seed proanthocyanidins inhibit UVB-induced cyclooxygenase-2 expression and other inflammatory mediators in UVB-exposed skin and skin tumors of SKH-1 hairless mice[J]. Pharm Res, 2010, 27(6): 1092-1102.
[17] KART A, CIGREMI Y, KARAMAN M, et al. Caffeic acid phenethyl ester (CAPE) ameliorates cisplatin-induced hepatotoxicity in rabbit Exp[J]. Experimental and Toxicologic Pathology, 2010, 62(1): 45-52.
[18] YOUSEF M I, SAAD A A, EL-SHENNAWY L K. Protective effect of grape seed proanthocyanidin extract against oxidative stress induced by cisplatin in rats[J]. Food and Chemical Toxicology, 2009, 47: 1176-1183.
[19] KINTZEL P E. Anticancer drug induced kidney disorders[J]. Drug Safety, 2001, 24: 19-38.
[20] RABIK C A, DOLAN M E. Molecular mechanisms of resistance and toxicity associated with platinating agents[J]. Cancer Treatment Reviews, 2007, 33: 9-23.
[21] PAI V B, NAHATA M C. Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention[J]. Drug Saf, 2000, 22: 263-302.
[22] WOZNIAK K, CZECHOWSKA A, BLASIAK J. Cisplatin-evoked DNA fragmentation in normal and cancer cells and its modulation by free radical scavengers and the tyrosine kinase inhibitor STI571[J]. Chemico-Biological Interactions, 2004, 147: 309-318.
[23] 陈昕, 赵雷, 韩蕴琪, 等. 维生素E对心肌氧化损伤的保护作用研究[J].中国实验诊断学, 2012, 16(6): 975-977.
[24] 李晔. 抗恶性肿瘤药物的心脏毒性[J]. 中国实用儿科杂志, 2006, 21(2): 139-141.
[25] 柯荔宁, 王玮, 张更, 等. 不同缺氧时间对SD大鼠海马神经元形态学改变的影响[J]. 解剖学杂志, 2005, 28(5): 545-548.
Protective Effect of GSPE on Cisplatin-Induced Nephrotoxicity in H9c2 Cells
GUO Pei-pei, GUO Zhuo-yu, ZHAO Yan-meng, GAO Li-ping*
(Beijing Municipal Key Laboratory of Biological Active Substance and Functional Food, College of Arts and Sciences, Beijing Union University, Beijing 100083, China)
Aim: To explore the effect of grape seed proanthocyanidin extract (GSPE) on cis-diamminedichloroplatinum (CDDP)-induced damage in H9c2 cells and its mechanism. Methods: H9c2 cells were cultured in vitro. The effects of CDDP individually and in combination with GSPE on the growth of H9c2 cells were determined by MTT method. Meanwhile, the morp hologic change of the cells was observed. SOD activity and MDA content in both cells and medium were determined to explore its mechanism. Results: GSPE could improve CDDP-induced morphologic change and suppress the decrease in SOD activity as well as the increase in MDA content in H9c2 cells and culture solutions. Conclusion: GSPE can ameliorate CDDP-induced damage in H9c2 cells in vitro. Its mechanism may be correlated with increased antioxidant capacity in H9c2 cells.
GSPE; cis-diamminedichloroplatinum; H9c2 cells; antioxidant
R318.0
A
1002-6630(2014)03-0213-04
10.7506/spkx1002-6630-201403043
2013-02-23
北京联合大学人才强校计划人才资助项目(20111101)
郭培培(1987—),女,硕士研究生,研究方向为功能性食品生化作用。E-mail:guopeipei29@126.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为功能性食品生化作用。E-mail:gaolip62@163.com
