辣椒素剂量对去势雌性大鼠血脂、肝脂及盲肠内环境的影响
2014-01-18陆红佳陈朝军郑龙辉苏昕峰
陆红佳,陈朝军,郑龙辉,苏昕峰,刘 雄*
(西南大学食品科学学院,重庆 400715)
辣椒素剂量对去势雌性大鼠血脂、肝脂及盲肠内环境的影响
陆红佳,陈朝军,郑龙辉,苏昕峰,刘 雄*
(西南大学食品科学学院,重庆 400715)
目的:探讨辣椒素剂量对去势雌性大鼠血脂、肝脂及盲肠内环境的影响。方法:选用30只雌性SD大鼠随机分组为5组,其中1组大鼠进行伪切除手术作对照(伪切除组),另外4组大鼠做双侧卵巢切除手术,基础饲料喂养恢复1周后,分为不灌胃辣椒素(空白组)和灌胃5.0、10.0、15.0 mg/(kg·d)辣椒素剂量组(低、中、高剂量组)。喂食相同基础 饲料28 d后解剖,测定大鼠血清和肝脏中胆固醇、甘油三酯含量及盲肠面积,盲肠内容物水分含量、pH值、短链脂肪酸 和微生物等指标。结果:空白组大鼠的体质量、采食量、血 脂、肝脏总脂肪、总胆固醇、甘油三酯总含量均显著高于伪切除组。辣椒素可降低双侧卵巢切除大鼠的体质量 增加量、血清和肝脏中胆固醇和甘油三酯含量,且具有明显的剂量关系;同时可以降低盲肠组织总质量、盲肠体质量比、盲肠内容物短链脂肪酸含量,显著降低盲肠内容物有益菌数量(P<0.05);辣椒素可以显著升高游离氨含量和pH值,增加有害菌数量(P<0.05),但辣椒素各剂量组之间没有显著性差异。结论:辣椒素对因雌激素缺乏引起高脂血症雌性大鼠具有较好的降血脂、降肝脂作用,但对盲肠内环境具有一定的损伤作用。
辣椒素;卵巢切除大鼠;血脂;肝脂;盲肠内环境
妇女进入更年期后,由于卵巢机能衰退,雌激素分泌量不足,导致内分泌失调,引起脂质代谢紊乱,从而诱发高脂血症[1-2]。临床发现,更年期综合征出现时,由于植物神经系统紊乱,容易出现肠易激 综合征、结肠炎等肠道疾病。有研究发现[3]雌激素与肠易激综合征呈正相关,雌激素可能是大鼠内脏高敏感性形成的重要激素之一。现在主要的治疗办法是服用激素类药物,效果明显但副作用大,容易引起子宫内膜癌[4-5]。大量科学研究证实,通过合理膳食能够显著降低血脂,预防由于雌激素缺乏导致的高脂血症疾病的发生[6-7]。
辣椒素作为辣椒的主要辛辣成分,是一种含香草酰胺的生物碱,作为食品辣味剂,同时也有作为药物使用的[8]。辣椒素因其独特的理化性质具备降血脂和降胆固醇的生理学功能[9-11]。有研究表明[12],辣椒素能明显降低血浆和肝脏中甘油三酯的浓度;也有研究表明[13],辣椒素对于大鼠血脂、肝脂具有明显的降低效果,但对肠道内环境有一定的损伤作用。卵巢切除大鼠因雌激素的缺乏会表现出血脂、肝脂的升高,容易形成高脂血症,同时出现肠易激综合症、结肠炎等肠道疾病,其肠道变得比较敏感[14]。本实验主要通过雌性大 鼠双侧卵巢切除手术,模拟建立更年期模型实验,研究辣椒素对卵巢切除大鼠血脂、肝脂和盲肠内环境的影响。以期为研究辣椒素对由于雌激素缺乏导致的高脂血症及肠易激症大鼠的作用效果提供参考。
1 材料与方法
1.1 材料、动物与试剂
天然辣椒素 (辣椒碱含量为95.7%),由河南倍特生物科技有限公司提供。
成年雌性SD大鼠(体质量约120~140 g,4周龄)、基础饲料,由重庆滕鑫比尔实验动物销售有限公司提供,动物许可证号:SCXK(渝)2007-0008。
大豆油 市售;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇( low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C) 上海北海生物技术工程有限公司;其他均为生化试剂或分析纯试剂。
1.2 方法
1.2.1 辣椒素溶液的配制
分别称取209.0、418.0、627.0 mg辣椒素(辣椒总碱含量95.7%)溶于400 mL食用大豆油中,100%功率超声波超声30 min使辣椒素溶解,配制成不同质量浓度的辣椒素溶液。按照1 mL/100 g大鼠体质量进行灌喂,伪切除组和卵巢切除空白组均灌胃食用大豆油。
1.2.2 动物饲养
体质量为120~140 g的4周龄SD雌性大鼠30只,每只单笼饲养在不锈钢大鼠笼中,室温(25±1)℃,12 h明暗轮换(8∶00—20∶00)。适应性喂养1周后,按大鼠体质量随机分为5组,腹部注射戊巴比妥钠(无菌生理盐水配制0.3%溶液,注射量1 mL/100 g,以大鼠体质量计)使其麻醉,任选一组进行伪切除手术(伪切除组,灌胃同等剂量的大豆油),其余4组进行双侧卵巢切除手术。手术后进行1周的恢复。将双侧卵巢切除大鼠按体质量随机分为4组,分别为空白组(灌胃同等剂量的大豆油)、灌胃5.0、10.0、15.0 mg/(kg·d)辣椒素(低、中、高)剂量组,所有实验大鼠自由饮水和采食,每3 d称量大鼠体质量以调整灌喂量,每天记录大鼠采食量,实验周期为6周。
1.2.3 样品收集
实验期最后1 d断粮12 h,19∶00—21∶00乙醚麻醉后。大鼠断头从颈部取血,血液收集在有抗凝剂的采血管中,在4 000 r/min、4 ℃条件下离心15 min[15],将分离出的血清液分装在1.5 mL离心管中并储存在-20 ℃冰箱里待分析。
收集完血液后,肝脏经冰冷的生理盐水灌流1 min后摘除,在冰冷的生理盐水中吸取表面的水后用吸湿纸除去表面水滴称总质量并记录数据;取1 g(精确到0.01 g)肝脏,用铝箔纸包好装入样品袋,放入-20 ℃冰箱保存待用。
取出盲肠组织,称质量。将盲肠组织纵向剪开,称取0.2 g左右盲肠内容物,加入10倍去离子水,旋涡混合仪上混匀,电子pH计测其pH值;称取0.5 g左右盲肠内容物放入超纯水处理过的10 mL离心管中,立即加入2 mL含有5 mmol/L巴豆酸的10 mmol/L氢氧化钠溶液,充分混匀后冷藏用于短链脂肪酸检测。称取0.3 g左右盲肠内容物放入预先恒质量的铝盒中,105 ℃条件下恒质量测其水分含量。称取0.3 g左右盲肠内容物,加入10倍无氨水,-20 ℃冷冻待测游离氨。剩余盲肠内容物收集于10 mL离心管中,-80 ℃冷冻保存用于微生物的检测。
1.3 指标检测
1.3.1 饲料效率测定
称量小鼠体质量和采食量后按以式(1)计算。

1.3.2 血脂检测
TC、TG、HDL-C和LDL-C用试剂盒检测,用全自动生化分析仪测定。
1.3.3 肝脂检测
肝脏中总脂质含量用Folch方法[16]抽提出脂肪后测质量比。同时用此抽提液测肝中TC和TG。首先准确称约 500 mg的肝组织放入组织捣碎机中,加入氯仿与甲醇体积比为2∶1的混合溶剂,在冰冷条件下高速搅碎,抽提液经滤纸过滤收集到25 mL刻度试管中,滤渣用同样的混合有机溶剂冲洗2~3次,然后将滤液加同样的混合有机溶剂定容到25 mL,充分混匀后,移出5 mL提取液到另一试管中用于TC和TG检测。在余下的20 mL中加入4 mL质量浓度为0.37 g/100 mL的KCl溶液,混匀后静置24 h以上让其分层。吸出上层液,用V(氯仿)∶V(甲醇)∶V(水)=3∶48∶37的混合溶剂洗下层液面2~3次,然后将下层提取液移入已干燥至恒质量的小烧杯中,加热除去有机溶剂后,在105℃条件下干燥至质量恒定,用质量量差法得出总脂含量。肝脏中TC和TG含量检测用酶法,用试剂盒检测。
1.3.4 盲肠壁表面积测定[17]
用生理盐水洗净盲肠,展开后固定在划有标准刻度线白色塑料板上,用数码相机拍摄展开的盲肠,将盲肠照片用打印纸打印,然后将纸上的盲肠轮廓图剪下,测出照片上的1 cm刻度线的长度(L,cm),用精度为0.000 1 g的电子精确称量轮廓图纸质量(m1,g)和1 cm2的纸质量(m2,g),然后按式(2)计算出盲肠表面积。
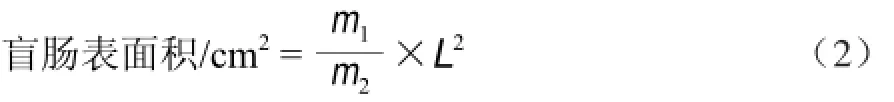
1.3.5 盲肠内容物含水量测定
称取一定质量的盲肠内容物,放入预恒质量铝盒中,105 ℃使质量恒定,测其含水量。

式中:m为盲肠内容物干质量/g;m1为盲肠内容物湿质量/g。
1.3.6 盲肠内容物pH值测定
称取一定质量的盲肠内容物于10 mL去离子水预处理离心管中,加入10倍(V/m)去离子水,旋涡混合仪上混匀后静置,测上清液pH值。
1.3.7 盲肠内容物游离氨测定
将预处理的盲肠内容物样品4 000 r/min 条件下离心5 min,吸取上清液1 mL,依次加入1 mL含有0.001 mol/L亚硝基铁氰化钠的0.5 mol/L苯酚溶液和1 mL含有0.03 mol/L次氯酸钠的0.625 mol/L氢氧化钠溶液,60 ℃保温5 min,625 nm波长处测吸光度[18]。
配制5 mmol/L氯化铵溶液,分别移取0、0.2、0.4、0.6、0.8、1.0 mL溶液于4 mL比色皿中,无氨水稀释至1.0 mL,按上述步骤测吸光度,绘制标准曲线得到回归方程y=0.108 7x+0.008 3(R2=0.999 1),式中:y表示吸光度;x表示氯化铵浓度/(μmol/mL)。
1.3.8 盲肠内容物短链脂肪酸(short chain fatty acid,SCFA)测定
将预处理的盲肠内容物样品在4 000 r/min转速下离心15 min,吸取上清液转移至预处理10 mL离心管中,10 000 r/min转速下继续离心15 min,1 mL一次性注射器吸取上清液1 mL,0.25 μm滤膜过滤至2 mL进样小瓶中待测[19]。
气相色谱条件:进样量1 øL;进样口温度220 ℃;柱流量0.95 mL/min,柱温90 ℃、平衡时间0.5 min,5 ℃/min升温至150 ℃,保留时间7 min;检测器温度230 ℃;氢气流量40 mL/min,空气流量400 mL/min,尾吹流量40 mL/min。
1.3.9 盲肠内容物微生物测定
取-80 ℃冷冻大鼠盲肠内容物0.1 g左右,加入9倍(V/m)无菌生理盐水,旋涡混合仪振荡混匀,制得10-1稀释度盲肠内容物。依次10倍稀释至10-12稀释度,选择10-7~10-12稀释度用于大肠杆菌、双歧杆菌和乳酸杆菌的培养计数,接种量为100 øL。大肠杆菌培养选用Eosin Methylene Blue(EMB)培养基,37℃条件下恒温培养箱中培养24~48 h计数。双歧杆菌和乳酸杆菌分别选用Bifidobacterium Selective Culture Medium(BS)培养基和Lactobacilli Select Agar(LBS)培养基,37℃条件下二氧化碳细胞培养箱中厌氧培养48~72 h计数。结果以l g(CFU/g)表示。
1.4 数据处理
实验数据经Excel初步统计后用SPSS 17.0进行显著性分析。实验结果以表示,各组间显著性差异采用SPSS分析,P<0.05被认为有显著差异。
2 结果与分析
2.1 辣椒素剂量对卵巢切除大鼠采食量和体质量的影响
表1 辣椒素剂量对卵巢切除大鼠体质量增加量、采食量和饲料效率的影响Table 1 Effect of capsaicin dose on body weight gain, food intake and food utilization efficiency in sham-operated and ovariectomi
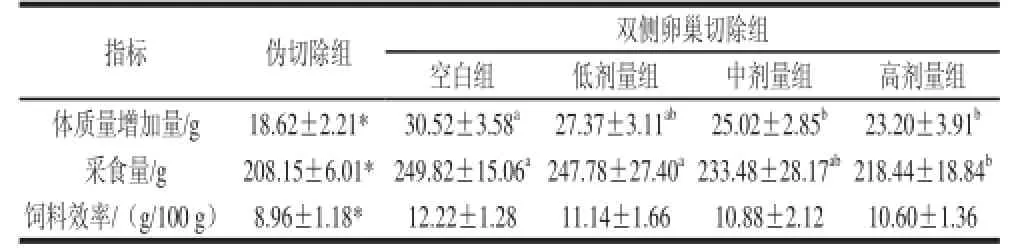
表1 辣椒素剂量对卵巢切除大鼠体质量增加量、采食量和饲料效率的影响Table 1 Effect of capsaicin dose on body weight gain, food intake and food utilization efficiency in sham-operated and ovariectomi
注:*.表示伪切除组和双侧卵巢切除空白组具有显著性差异(P<0.05);双侧卵巢切除组中字母不同,组间存在显著性差异(P<0.05)。下同。
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组体质量增加量/ g 18.62±2.21* 30.52±3.58a 27.37±3.11ab 25.02±2.85b 23.20±3.91b采食量/g 208.15±6.01*249.82±15.06a247.78±27.40a233.48±28.17ab218.44±18.84b饲料效率/(g/100 g) 8.96±1.18* 12.22±1.28 11.14±1.66 10.88± 2.12 10.60±1.36
从表1可见,与伪切除组相比,双侧卵巢切除组大鼠的体质量增加量、采食量和饲料效率都显著升高(P<0.05)。在双侧卵巢切除组中,与空白组相比,灌胃辣椒素组的大鼠体质量和采食量均有所降低,在中剂量和高剂量时达到显著水平(P<0.05),而饲料效率的变化没有显著性;在灌胃组之间,随着灌喂剂量的增大,大鼠体质量增加量呈逐渐下降趋势,由27.37 g下降到23.20 g,同时,中剂量和高剂量均达到显著水平(P<0.05);随着灌喂剂量增大,大鼠采食量也呈逐渐下降趋势,由247.78 g下降到218.44 g,高剂量达到显著水平(P<0.05);饲料效率逐渐降低,但均没有达到显著水平。说明随着辣椒素剂量的增加,体质量增加量逐渐下降,抑制体质量增加效果更加明显。
2.2 辣椒素剂量对卵巢切除大鼠血脂的影响由表2可见,双侧卵巢切除空白组大鼠血中TC、TG
表2 辣椒素剂量对卵巢切除大鼠血脂的影响Table 2 Effect of capsaicin dose on serum lipids in sham-operated and ovariectomized rattss
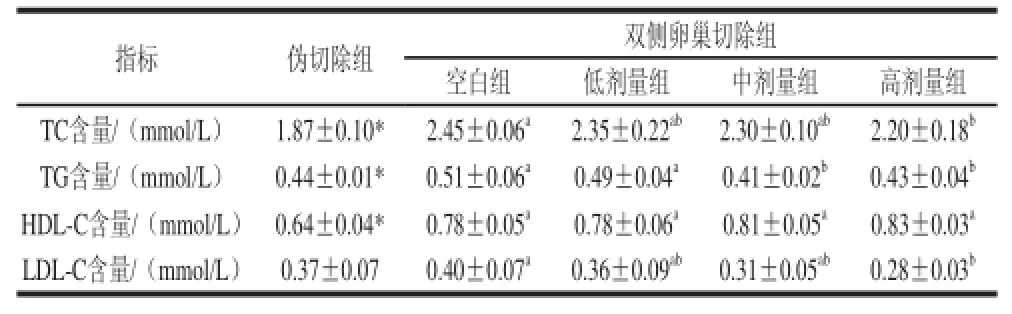
表2 辣椒素剂量对卵巢切除大鼠血脂的影响Table 2 Effect of capsaicin dose on serum lipids in sham-operated and ovariectomized rattss
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组TC含量/(mmol/L) 1.87±0.10* 2.45±0.06a 2.35±0.22ab 2.30±0.10ab 2.20±0.18bTG含量/(mmol/L) 0.44±0.01* 0.51±0.06a 0.49±0.04a 0.41±0.02b 0.43±0.04bHDL-C含量/(mmol/L) 0.64±0.04* 0.78±0.05a 0.78±0.06a 0.81±0.05a 0.83±0.03aLDL-C含量/(mmol/L) 0.37±0.07 0.40±0.07a 0.36±0.09ab 0.31±0.05ab 0.28±0.03b
和HDL-C含量均显著高于伪切除组(P<0.05),说明雌激素缺乏易诱导高脂血症。双侧卵巢切除组中,与空白组相比,大鼠血中的TC、TG和LDL-C含量都呈下降趋势,其中低剂量组都未达到显著水平,而高剂量组均达到显著水平;而对于HDL-C没有显著性影响,只有一种升高趋势,这种趋势与灌胃剂量呈正相关性。此实验结果表明,中、高剂量辣椒素对雌激素缺乏诱导的高脂血症有良好的预防效果。
2.3 辣椒素剂量对卵巢切除大鼠肝脂的影响
表3 辣椒素剂量对卵巢切除大鼠肝脂的影响Table 3 Effect of capsaicin dose on hepatic lipids in sham-operated and ovariectomized rats
注:*.以整个肝脏计。
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组肝脏质量/g 3.98±0.60 4.29±0.52 4.13±0.82 4.06±0.54 3.83±0.88肝脏质量/体质量 0.03±0.00 0.03±0.00 0.03±0.00 0.03±0.00 0.03±0.00肝脏脂肪含量/(g/g 肝脏) 0.16±0.033 0.18±0.024a 0.15±0.020a0.14±0.038a0.10±0.016b肝脏脂肪总含量/g* 0.61±0.13* 0.79±0.07a 0.63±0.20a 0.65±0.17a 0.37±0.13b肝脏TC含量/(ømol/g 肝脏) 28.45±1.96 27.97±1.45 27.76±1.70 28.93±1.37 28.39±0.95 TC总含量/ømol* 107.48±5.42*120.12±17.90a103.85±10.78b117.14±13.96a97.21±7.28b肝脏TG含量/(ømol/g 肝脏) 9.49±0.40 9.90±0.35 9.80±0.73 9.77±0.56 9.71±0.78 TG总含量/ømol* 35.49±4.35* 41.62±5.46a37.07±3.30ab36.76±6.43ab34.20±4.68b
由表3可见,与伪切除组相比,双侧卵巢切除空白组的肝脏质量增加了0.31 g,但未达到显著水平,而肝脏脂肪总含量、肝脏TC和TG分别升高了0.18 g、12.64 ømol和6.13 ømol,且具有显著性(P<0.05),说明雌激素缺乏可导致大鼠肝脏脂质升高。在双侧卵巢切除组中,与空白组相比,各剂量组的肝脏质量都降低了,且随着灌胃辣椒素剂量的加大,肝脏质量呈下降趋势,但未达到显著水平,可能是大鼠体质量降低,导致肝脏质量变小。各组间肝脏质量/大鼠体质量没有显著性差异,可见辣椒素剂量并不影响大鼠肝脏的正常发育。高剂量组每克肝脏中脂肪含量、肝脏脂肪总含量、肝脏TC和肝脏TG总含量均显著降低(P<0.05);剂量组之间,随着灌胃剂量的增加,大鼠的每克肝脏中脂肪含量、肝脏脂肪总含量、肝脏TC含量和肝脏TG总含量呈下降趋势,高剂量时各指标达到最低值,说明辣椒素对肝脂有降低作用,且随着剂量的增加其作用变得更加明显。
2.4 辣椒素剂量对卵巢切除大鼠盲肠组织的影响
表4 辣椒素剂量对卵巢切除大鼠盲肠组织的影响(x ±s,n==66)Table 4 Effect of capsaicin dose on cecum tissue in ovariectomized rats

表4 辣椒素剂量对卵巢切除大鼠盲肠组织的影响(x ±s,n==66)Table 4 Effect of capsaicin dose on cecum tissue in ovariectomized rats
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组盲肠壁湿质量/g 0.61±0.16 0.63±0.15 0.58±0.19 0.55±0.07 0.52±0.07盲肠质量/体质量/% 1.39±0.42* 1.59±0.51a 1.50±0.28ab 1.47±0.23b 1.49±0.36ab盲肠壁面积/cm2 20.72±1.94 21.98±1.83 19.60±2.67 20.37±2.08 20.22±2.38
由表4可见,与伪切除组相比,双侧卵巢切除空白组大鼠盲肠壁湿质量和面积分别增加了0.02 g和1.26 cm2,但没有达到显著水平;而盲肠质量与体质量比值增加了0.20%,且达到显著性(P<0.05)。与双侧卵巢切除空白组相比,双侧卵巢切除大鼠盲肠组织各个指标值均降低,其中只有中剂量组的盲肠质量/体质量的降低呈显著性(P<0.05);辣椒素剂量组间无线性相关,辣椒素对双侧卵巢切除大鼠盲肠组织的生长具有一定的抑制作用。
2.5 辣椒素剂量对卵巢切除大鼠盲肠内容物的影响
表5 辣椒素剂量对卵巢切除大鼠盲肠内容物的影响Table 5 Effect of capsaicin dose on cecum content in ovariectomized
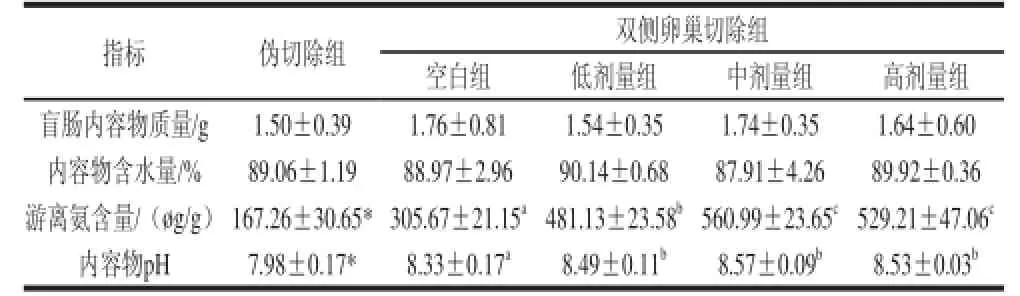
表5 辣椒素剂量对卵巢切除大鼠盲肠内容物的影响Table 5 Effect of capsaicin dose on cecum content in ovariectomized
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组盲肠内容物质量/g 1.50±0.39 1.76±0.81 1.54±0.35 1.74±0.35 1.64±0.60内容物含水量/% 89.06±1.19 88.97±2.96 90.14±0.68 87.91±4.26 89.92±0.36游离氨含量/(øg/g)167.26±30.65*305.67±21.15a481.13±23.58b560.99±23.65c529.21±47.06c内容物pH 7.98±0.17* 8.33±0.17a 8.49±0.11b 8.57±0.09b 8.53±0.03b
由表5可见,与伪切除组相比,双侧卵巢切除空白组大鼠盲肠内容物质量增加了0.26 g,而含水量下降了0.09%,且没有达到显著水平;而游离氨含量和pH值分别升高了138.41 øg/g和0.35,均达到显著水平(P<0.05)。在双侧卵巢切除组中,与空白组相比,辣椒素剂量组盲肠内容物有所下降,而内容物含水量有所上升,但无显著性变化;大鼠盲肠内容物pH值都有升高趋势,且达到显著水平(P<0.05),各剂量组之间变化无线性关系;各辣椒素剂量组大鼠盲肠内容物游离氨含量均显著升高(P<0.05),分别升高了175.46、255.32 øg/g和223.54 øg/g,说明辣椒素有增加游离氨含量的作用,但辣椒素剂量之间无相关性。
2.6 辣椒素剂量对卵巢切除大鼠盲肠内容物短链脂肪酸的影响
由表6可见,与双侧卵巢切除空白组相比,伪切除组大鼠盲肠内容物中乙酸含量升高了9.06 ømol/g,但没有达到显著水平;而丙酸、异丁酸、丁酸和总短链脂肪酸的含量分别升高了4.10、 2.21、2.65、18.02 ømol/g,且均具有显著性(P<0.05)。在双侧卵巢切除组中,与空白组相比,辣椒素剂量组的乙酸、丙酸和总短链脂肪酸的含量明显下降,其中中剂量和高剂量组达到显著水平(P<0.05),说明灌胃辣椒素使得大鼠盲肠内容物短链脂肪酸含量降低。
表6 辣椒素剂量对卵巢切除大鼠盲肠内容物短链脂肪酸的影响Table 6 Effect of capsaicin dose on SCFAs in cecum content from

表6 辣椒素剂量对卵巢切除大鼠盲肠内容物短链脂肪酸的影响Table 6 Effect of capsaicin dose on SCFAs in cecum content from
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组乙酸含量/(μmol/g) 38.67±13.11 29.61±6.74a20.42±4.68ab17.10±2.23b19.08±2.19ab丙酸含量/(μmol/g) 15.22±3.82*11.12±2.06a9.62±3.00ab 5.36±1.01b 6.83±1.95b异丁酸含量/(μmol/g) 3.93±1.52* 1.72±0.80 1.64±0.50 0.83±0.12 1.42±0.51丁酸含量/(μmol/g) 6.10±1.49* 3.45±1.17 4.51±1.92 2.06±0.75 2.09±0.80总短链脂肪酸含量/(μmol/g)63.92±19.31*45.90±9.19a36.19±9.54ab25.34±4.07b29.38±4.90b
2.7 辣椒素剂量对卵巢切除大鼠盲肠内容物微生物的影响
表7 辣椒素剂量对卵巢切除大鼠盲肠内容物微生物的影响Table 7 Effect of capsaicin dose on cecal microflora in ovariectomizedlg(CFU/g)

表7 辣椒素剂量对卵巢切除大鼠盲肠内容物微生物的影响Table 7 Effect of capsaicin dose on cecal microflora in ovariectomizedlg(CFU/g)
指标 伪切除组 双侧卵巢切除组空白组 低剂量组 中剂量组 高剂量组双歧杆菌 16.18±0.19 15.57±0.23a11.91±0.21b10.90±0.16b10.58±0.06b乳酸杆菌 16.45±0.20 15.99±0.38a12.97±0.05b11.82±0.31b11.87±0.20b大肠杆菌 11.07±0.28 11.53±0.22a12.36±0.40b12.50±0.27b12.70±0.32b
由表7可见,与伪切除组相比,双侧卵巢切除空白组大鼠盲肠内容物中双歧杆菌和乳酸杆菌数量均减少了0.61(lg(CFU/g))和0.46(lg(CFU/g)),而大肠杆菌的数量增加了0.46(lg(CFU/g)),但均没有达到显著性。与双侧卵巢切除空白组相比,各剂量双侧卵巢切除组大鼠盲肠内容物中双歧杆菌和乳酸杆菌数量显著减少(P<0.05),大肠杆菌数量显著增加(P<0.05),而各剂量组之间微生物(双歧杆菌、乳酸杆菌、大肠杆菌)数量的变化虽有下降或者上升的趋势,但均没有显著差异。说明辣椒素可以明显减少肠道中有益菌的数量,增加有害菌的数量。
3 讨 论
辣椒素能明显降低血浆和肝脏中TG的浓度,可能与增加体内脂肪氧化分解有关[20]。有研究表明其作用机理是通过激活辣椒素的特异性受体致Ca2+的浓度迅速升高,进而引起细胞内肥胖相关因子表达改变,抑制细胞分化和脂肪酸的合成,促进能量消耗,降低脂肪细胞数量和体积,防治肥胖[21]。本实验灌胃辣椒素对双侧卵巢切除大鼠的血脂和肝脂的结果表明,辣椒素可降低双侧卵巢切除组大鼠的体质量增加量、进食量、血浆和肝脏中TC和TG含量;其中随着辣椒素剂量的增加,其降血脂和肝脂的作用越明显,说明辣椒素同样对双侧卵巢切除大鼠具有较好的降血脂、肝脂作用。
辣椒素有降血脂和肝脂的作用,但同时其对肠道有一定的损伤作用,有研究表明[22],灌胃辣椒素会出现腹部痉挛现象。Johnson等[13]研究发现对大鼠连续30 d饲喂80 mg/(kg·d)的辣椒素后大鼠小肠、大肠内出现肿瘤。本实验灌胃辣椒素对双侧卵巢切除大鼠盲肠内环境的结果表明:辣椒素能降低盲肠内容物中短链脂肪酸含量和双歧杆菌、乳酸杆菌数量,同时升高游离氨含量和大肠杆菌数量;而低剂量辣椒素可以显著降低盲肠内容物中短链脂肪酸含量,升高游离氨含量,同时可以显著降低有双歧杆菌和乳酸杆菌数量,显著增加大肠杆菌数量,说明由于雌激素的缺乏,辣椒素对双侧卵巢切除大鼠的肠道损伤作用表现的更明显,而辣椒素剂量组之间没有显著差异,辣椒素对双侧卵巢切除大鼠盲肠内环境影响剂量效应不明显。
[1] GORODESKI G I. Update on cardiovascular disease in postmenopausal women[J]. Best Pract Res Clin Obstet Gynaecol, 2002, 16(3): 329-355.
[2] COTE I, YASARI S, PIGHON A, et al. Liver fat accumulation may be dissociated from adiposity gain in ovariectomized rats[J]. Informa Healthcare, 2012, 15(6): 594-601.
[3] MARTIN V T. Ovarian hormones and pain response: a review of clinical and basic science studies[J]. Gender Medicine, 2009, 6(2): 168-192.
[4] YUAN R, PENG Q, LIAO Q, et al. Efficacy of hormone replacement plus antidepressant for anxiety and depression in patient with menopause syndrome[J]. Chinese Journal of Clinical Rehabilitation, 2006, 10(2): 162-163.
[5] KAFKAS S, DOST T, OZKAYRAN H, et al. Effect of estrogen therapy on adipocytokines in ovariectomized-aged rats[J]. Journal of Obstetrics and Gynaecology Research, 2012, 38(1): 231-238.
[6] 刘雄, 张焕容, 杨发龙. 高直链玉米淀粉对卵巢切除大鼠体内胆固醇代谢影响的研究[J]. 营养学报, 2007, 29(5): 453-457.
[7] 冯媛媛. 薛荔籽果胶理化性质及其功能特性的研究[D]. 重庆: 西南大学, 2010: 12.
[8] 苏昕峰, 文红丽, 刘雄, 辣椒素对胃肠道健康的影响[J]. 食品工业科技, 2011, 32(6): 443-446.
[9] SNITKER S, FUJISHIMA Y, SHEN H, et al. Effects of novel capsinoid treatment on fatness and energy metabolism in humans: possible pharmacogenetic implications[J]. The American Journal of Clinical Nurition, 2009, 89(1): 45-50.
[10] MANJUNATHA H, SRINIVASAN K. Hypolipidemic and antioxidant effects of curcumin and capsaicin in high-fat-fed rats[J]. Canadian Journal of Physiology and Pharmacology, 2007, 85(6): 588-596.
[11] KEMPAIAH R K, SRINIVASAN K. Integrity of erythrocytes of hypercholesterolemic rats during spices treatment[J]. Molecular and Cellular Biochemistry, 2002, 236(1/2): 155-161.
[12] KEMPAIAH R K, SRINIVASAN K. Beneficial influence of dietary curcumin, capsaicin and garlic on erythrocyte integrity in high-fat fed rats[J]. Journal of Nutrition Biochemistry, 2006, 17(7): 471-478.
[13] JOHSON W. final report on the safety assessment of Capsicum annuum extract, Capsicum annuum fruit extract, Capsicum annuum resin, Capsicum annuum fruit powder, Capsicum frutescens fruit, Capsicum frutescens fruit extract, Capsicum frutescens resin, and capsaicin[J]. International Journal of Toxicology, 2007, 26: 103-106.
[14] MATRICON J, MELEINE M, GEL OT A, et al. Review article: associations between immune activation, intestinal permeability and the irritable bowel syndrome[J]. Alimentary Pharmacology & Therapeutics, 2012, 36(11/12): 100 9-1031.
[15] XIONG L, HIROSHI O, TARO K, et al. The effect of high-amylose cornstarch on lipid metabolism in OVX rats is affected by fructose feeding[J]. Journal of Nutritional Biochemistry, 2010, 21: 89-97.
[16] FOLCH J, LESS M, SLOANE-STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissue[J]. The Journal of Biologic al Chemistry, 1957, 226: 497-509.
[17] 刘雄, 张焕荣, 杨发龙. 高直链玉米淀粉对大鼠肠道发酵影响的研究[J]. 营养学报, 2007, 29(4): 372-375.
[18] KISHIDA T, NAKAI Y, EBIHARA K. Hydroxypropyl-distarch phosphate from tapioca starch reduces zinc and iron absorption, but not calcium and magnesium absorption, in rats[J]. The Journal of Nutrition, 2001, 131: 294-300.
[19] CHANEY A L, MARBACH E P. Modified reagents for determination of urea and ammonia[J]. Clinical Chemistry, 1962, 8: 130-132.
[20] ZHANG L L, YAN L D, MA L Q. Activation of transient receptor potential vanilloid type-1 channel prevents adipogenesis and obesity[J]. Circulation Research, 2007, 100(7): 934-936.
[21] LEJEUNE M P, KOVACS E M, WESTERTERP M S. Effect of capsaicin on substrate oxidation and weight maintenance after modest body-weight loss in human subj ects[J]. British Journal Nutrition, 2003, 90(3): 651-659.
[22] HAMMER J, HAMMER H F, EHERER A J, et al. Intraluminal capsaicin does not affect fluid and electrolyte absorption in the human jejunum but does cause pain[J]. Gut, 1998, 43: 252-255.
Effect of Capsaicinoid Dose on Serum Lipids, Hepatic Lipids and Cecum Environment in Ovariectomized Rats
LU Hong-jia, CHEN Zhao-jun, ZHENG Long-hui, SU Xin-feng, LIU Xiong*
(College of Food Science, Southwest University, Chongqing 400715, China)
Objective: To investigate the effect of capsaicinoids on serum lipids, hepatic lipids and cecum environment in ovariectomized rats. Methods: Thirty mature female Wistar rats were divided into five groups. One group was shamovariectomized as sham reference group. The other four groups were double ovariectomized and assigned as model group and capsaicin groups at lo w (5.0 mg/(kg·d)), medium (10.0 mg/(kg·d)) and high doses (15.0 mg/(kg·d)) one week later. All rats were sacrificed after 28 days of feeding and analyzed for triglyceride (TG) and cholesterol (TC) in serum and liver, the area of cecum, the content of water, pH and short-chain fatty acid content in cecum, and intestinal microflora. Results: The body weight, feed intake, serum lipids, liver fat, hepatic total cholesterol, hepatic triglyceride in the control group were significantly higher than those in the sham group. Feeding capsaicinoids could reduce the body weight, body-weight gaining, plasma cholesterol and fat, total cholesterol and triglyceride in liver in a dose-dependent manner. In addition, capsaicinoids could also decrease the concentration of short-chain fatty acids and the amount of beneficial bacteria significantly (P < 0.05), and improve the concentration of free ammonia and pH of cecum content as well as the amount of harmful bacteria, significantly (P < 0.05), but there was no significant difference among different dose groups. Conclusion: Capsa icin may significantly decrease estrogen deficiency-induced hypercholesterolemia in rats, and damage the cecum environment.
capsaicin; ovariectomized rat; serum lipids; hepatic lipids; cecum environment
TS201.4
A
1002-6630(2014)03-0203-06
10.7506/spkx1002-6630-201403041
2013-02-04
中央高校基本科研业务费专项(XDJK2009B004);国家自然科学基金项目(2011GA31071529)
陆红佳(1986—),女,博士研究生,研究方向为食品化学与营养学。E-mail:aaluhongjia@163.com
*通信作者:刘 雄(1970—),男,教授,博士,研究方向为碳水化合物功能与利用,食品营养学。E-mail: liuxiong848@hotmail.com
