壬基酚致NCTC1469细胞的损伤作用及活性氧水平、谷胱甘肽含量变化
2014-01-18陈泱杰刘晓珍黄丹菲谢明勇
陈泱杰,刘晓珍,黄丹菲,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
壬基酚致NCTC1469细胞的损伤作用及活性氧水平、谷胱甘肽含量变化
陈泱杰,刘晓珍,黄丹菲,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:探究壬基酚对NCTC1469细胞的损伤作用及细胞内活性氧类、还原型谷胱甘肽含量的影响。方法:通过体外细胞实验,用不同质量浓度壬基酚作用NCTC1469细胞24 h;CCK-8法检测细胞存活率;测定药物作用后培养液上清中乳酸脱氢酶(lactate dehydrogenase,LDH)、谷丙转氨酶(alanine aminotransferase,ALT)和谷草 转氨酶(aspartate transaminase,AST)活性及细胞内还原型谷胱甘肽含量;流式细胞仪检测细胞内活性氧类水平。结果:壬基酚可显著抑制NCTC1469细胞增殖及促进活性氧类生成(P<0.05),呈一定剂量依赖性;培养液上清液中LDH、ALT活性在壬基酚浓度大于0.1 μmol/L处理组中,与自然释放对照组相比显著升高(P<0.05);且壬基酚在高剂量(1、10、100 μmol/L)能明显增加培养液上清中AST活性(P<0.01);壬基酚呈剂量依赖性降低细胞内还原型谷胱甘肽含量,与空白对照组比较有显著差异(P<0.05)。结论:推测壬基酚可能通过上调细胞内活性氧类水平,下调胞内还原型谷胱甘肽含量,引起氧化应激反应,从而对NCTC1469细胞产生损伤作用。
壬基酚;NCTC1469细胞;氧化应激
壬基酚(nonylphenol,NP)是一种烷基酚类化合物,被广泛用作乳化剂、增塑剂、洗涤剂等,并大量用于生产食品包装材料、黏合剂等。由于NP在环境中状态较为稳定,难以降解,因此可通过食物链进入人体[1]。此外,Inoue等[2]发现NP在长期与食品接触以及微波加热食品的过程中,可由食品包装袋迁移至食品中,从而进入人体。Geuenther等[3]更证实了在大部分日常零售食品中可检测出较高含量的NP,并推测NP普遍存在于人们日常所食用的食物中。
研究表明,NP的化学结构与动物及人类的雌性激素酷似,进入生物体内可引起内分泌紊乱,属于内分泌干扰物[4]。不少学者认为,NP不仅具有内分泌干扰作用,而且在环境相关浓度下,对机体多种器官亦具有高度毒性作用,很可能是一种全身性多脏器的毒性物质[5-8]。目前,国内外关于NP对生物体生殖系统、内分泌系统、神经系统、免疫系统等的组织损伤作用已出现较多报道[9-10]。但在体外条件下,利用肝细胞模型研究NP对肝细胞的影响较少。因此,本实验旨在以NCTC1469小鼠肝细胞为毒理学模型,将其暴露于不同质量浓度的NP后,通过测定细胞存活率以及培养液上清中乳酸脱氢酶(lactate dehydrogenase,LDH)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)的活性,探究壬基酚对肝细胞的损伤程度。同时应用荧光探针探测壬基酚引起的肝细胞内活性氧类(reactive oxygen species,ROS)的生成并观察细胞内还原型谷胱甘肽(glutathione,GSH)含量的变化,初步探讨壬基酚对肝细胞的损伤机理,并为后续研究提供参考。
1 材料与方法
1.1 材料与试剂
NP(纯度99%以上:溶于乙醇,配制成母液) 美国Sigma公司;NCTC1469细胞 美国菌种保藏中心;无酚红DMEM培养基、活性炭/葡聚糖处理胎牛血清 美国Hyclone公司;0.25%胰酶 北京索莱宝公司;2’,7’-二氯乙酰乙酸盐荧光素 丹麦 DAKO 公司;CCK-8试剂盒日本同仁化学研究所;LDH、ALT、AST、GSH测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
流式细胞仪 美国BD公司;电子天平 梅特勒-托利多仪器有限公司;CO2培养箱 美国Thermo Electron公司;倒置相差显微镜 日本Olympus公司;超净工作台 上海一恒科技有限公司;冷冻高速离心机美国Sigma公司;多功能酶标仪 美国Thermo公司;超低温冰箱 青岛海尔电冰箱股份有限公司;Milli-Q50超纯水净化系统 美国Millipore公司;立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.3 方法
1.3.1 细胞培养
NCTC1469细胞用含10%胎牛血清的DMEM高糖培养基在37 ℃、5% CO2条件下培养。细胞贴壁生长,1~2 d换液,选用对数生长期良好的细胞进行传代或后续实验处理。传代时弃原培养液,磷酸盐缓冲液洗涤后用细胞刮将细胞刮下,1 000 r/min离心5 min后加入新培养液,重悬,接种于新培养瓶。
1.3.2 CCK-8法测定细胞存活率
NCTC1469细胞经胰酶消化,调整细胞密度为1×105cells/mL,按每孔100 øL接种于96孔板中,置于5% CO2、37 ℃培养箱中培养24 h,每孔分别加入10 øL终浓度分别为0.01、0.1、1、10、100 μmol/L 的NP溶液,同时设溶剂对照组(0.01%乙醇)和空白对照组(DMEM培养基不含细胞),每组设6个平行孔。培养24 h后每孔加入10 øL CCK-8试剂,置于摇床上摇匀,37 ℃继续孵育2 h,终止培养。选择450 nm波长,在多功能酶标仪上测定各孔OD值,记录结果。根据下式计算细胞存活率。

1.3.3 细胞培养上清液中LDH、ALT、AST活性测定
NCTC1469细胞经胰酶消化后,调整细胞密度为1×105cells/mL接种于96孔板中,待细胞进入对数生长期时,加入200 øL终浓度分别为0.01、0.1、1、10、100 μmol/L的NP溶液,同时设细胞自然释放对照组(DMEM培养基),每组各设6个复孔。置于5% CO2、37 ℃培养箱中孵育24 h,分别吸取各孔培养液上清100 øL,按照试剂盒说明书测定LDH、ALT、AST活性。
1.3.4 ROS水平检测
NCTC1469细胞经胰酶消化后,调整细胞密度为1×105cells/mL接种于6孔板中,每孔2 mL,待细胞进入对数生长期时,加入2 mL终浓度分别为0.01、0.1、1、10、100 μmol/L的NP溶液,同时设置空白对照组(DMEM培养基)。置于5% CO2、37 ℃培养箱中孵育24h,分别吸去培养液,每孔加入1mL终浓度为10μmol/L的2’,7’-二氯乙酰乙酸盐荧光素,37 ℃避光孵育30 min后收集细胞,磷酸缓冲液洗两次,立即用流式细胞仪进行检测,激发波长488 nm,发射波长525 nm,每次计数1×104个细胞,用 Cell Quest 软件进行分析。
1.3.5 细胞内GSH含量的测定
NCTC1469细胞经胰酶消化后,调整细胞密度为1×105cells/mL接种于6孔板中,每孔2 mL,待细胞进入对数生长期时,加入2 mL终浓度分别为0.01、0.1、1、10、100 μmol/L的NP溶液,同时设置空白对照组(DMEM培养基)。置于5% CO2、37 ℃培养箱中孵育24 h,PBS洗涤细胞1次,离心收集细胞,吸尽上清,加入细胞沉淀体积3倍量的偏磷酸缓冲液充分混悬,利用液氮和37 ℃水浴对样品进行3次快速的冻融,4 ℃、3 500 r/min离心10 min,吸取上清液,按照试剂盒说明书测定GSH含量。用Bradford法测定细胞蛋白水平校正细胞内GSH含量。
1.4 统计学分析
2 结果与分析
2.1 NP对NCTC1469细胞存活率的影响
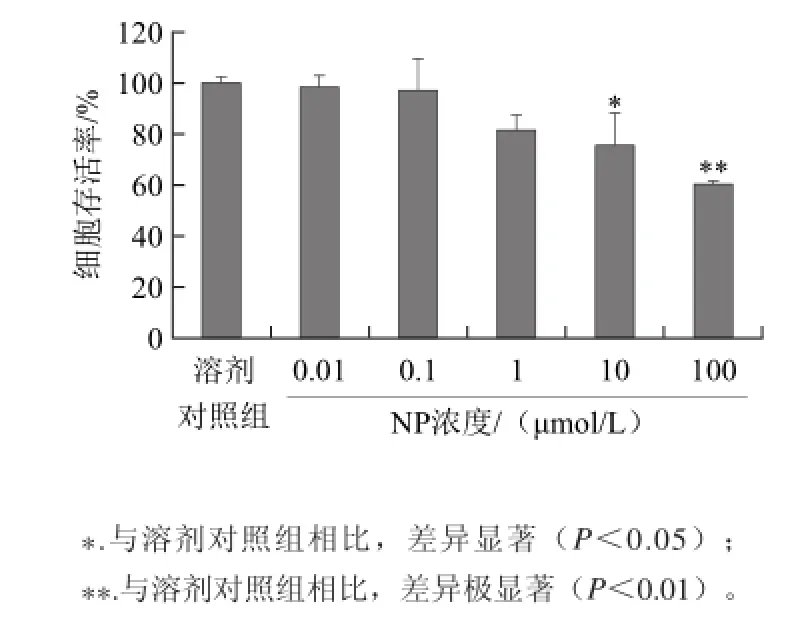
图1 NP对NCTC1469细胞存活率的影响Fig.1 Effect of NP on the survival rate of NCTC1469 cells
如图1所示,NP在终浓度为0.01、0.1、1、10、100 μmol/L时作用于NCTC1469细胞24 h后,可抑制细胞增殖,且呈一定的剂量相关性。结果表明,NP浓度在高于10 μmol/L时,对NCTC1469细胞具有显著生长抑制作用。
2.2 NP对NCTC1469细胞LDH、ALT、AST渗透量的影响
表1 各组培养上清液中LDH、AST、ALT的活性Table 1 Effect of NP on LDH, AST and ALT activities in culture supernatant of NCTC1469 cells (x ±s,n==66))

表1 各组培养上清液中LDH、AST、ALT的活性Table 1 Effect of NP on LDH, AST and ALT activities in culture supernatant of NCTC1469 cells (x ±s,n==66))
注:*.与自然释放对照组相比,差异显著(P<0.05);**.与自然释放对照组相比,差异极显著(P<0.01)。
组别 剂量/(μmol/L) LDH活力/(U/L) ALT活力/(U/L) AST活力/(U/L)自然释放对照组 478.46±1.15 15.83±2.34 27.13±1.43 0.01 499.82±1.36 20.59±1.64 27.56±1.07 0.1 651.70±2.63* 58.27±2.94** 44.66±3.59 NP浓度 1 867.77±1.14** 71.02±1.83** 91.77±8.2** 10 873.69±2.34** 91.38±1.42** 118.85±7.35** 100 1 024.06±2.05** 158.14±4.68** 226.72±6.62**
由表1可知,各给药组上清液中LDH、ALT、AST活性高于自然释放对照组,且当NP浓度高于0.1 μmol/L时,上清液中LDH、ALT活性与自然释放对照组相比具有显著性差异,当NP浓度高于1 μmol/L时,上清液中AST活性与自然释放对照组相比具有显著性差异。结果说明,NP可增加NCTC1469细胞LDH、ALT、AST的渗透量,且呈一定的剂量依赖性。
2.3 NP对NCTC1469细胞内ROS水平的影响
为了检测NP是否影响NCTC1469细胞内ROS水平,用不同浓度NP(0.01、0.1、1、10、100 μmol/L)作用NCTC1469细胞24 h后,利用DCFH-DA荧光探针标记,流式细胞仪测定细胞内ROS生成。如图2所示,经NP刺激后,NCTC1469细胞内ROS水平上升。由图3可知,药物作用组ROS水平与空白对照组相比具有显著差异性,并呈剂量依赖性。


图2 NP对NCTC1469细胞内ROS水平影响的流式细胞仪检测结果Fig.2 Flow cytometer analysis of the effect of NP on ROS level in NCTC1469 cells
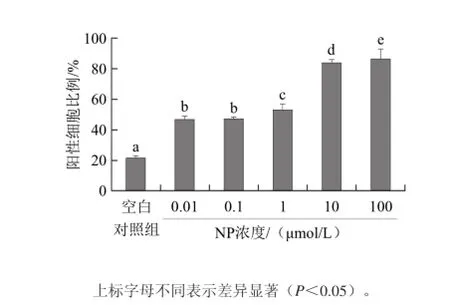
图3 NP对NCTC1469细胞内ROS水平的影响Fig. 3 Effect of NP on ROS level in NCTC1469 cells
2.4 NP对NCTC1469细胞内GSH含量的影响

图4 NP对NCTC1469细胞内GSH含量的影响Fig.4 Effect of NP on GSH level in NCTC1469 cells
收集NP作用后的NCTC1469细胞,测定胞内GSH含量,利用细胞蛋白含量校正。由图4可见,NP刺激NCTC1469细胞后,与空白对照组相比,各药物组胞内GSH含量显著降低,且呈一定的浓度剂量依赖性。
3 讨 论
目前,NP对人类健康的潜在危害已引起广大研究者关注。由于其是内分泌干扰物的典型代表,因此可对机体内分泌系统造成损害。然而在评估NP对机体的危害时,应综合考虑其对整体的损伤作用。研究表明,母体暴露NP可引起幼鼠肝组织病变[11],成年大鼠经消化道染毒的亚慢性实验结果也显示肝、肾可能是NP作用的主要靶器官[12]。郭彤等[13]以鲫肝细胞作为毒理学模型发现当鲫肝细胞暴露于一定浓度范围的壬基酚(>0.1 μmol/L)环境下,在24 h内能明显抑制肝细胞增殖,并随NP浓度的增加,抑制作用显著增强。本实验利用CCK-8法检测NP对NCTC1469细胞存活率的影响,CCK-8分析法的原理是基于WST-8可被线粒体中的脱氢酶还原成水溶性的橙黄色甲臜染料,且生成的甲臜量与活细胞数量成正比。由本实验结果可知,NP作用24 h后可抑制细胞增殖,并随着药物浓度增加,抑制效果愈加明显,当NP浓度大于10 μmol/L时,其对NCTC1469细胞的生长抑制作用具有显著性,推测肝细胞线粒体在高浓度NP作用下受到较大损伤。
体外肝细胞培养是一种简便快速的体外毒理学实验系统[14]。LDH是肝细胞内一种重要的酶,可催化乳酸和丙酮酸相互转化,调节机体正常生理活动,在正常情况下不会透过细胞膜,但当细胞受到损伤或毒害,细胞膜的通透性发生改变,LDH就会释放到介质中去[15]。ALT主要存在于肝细胞浆中,当肝细胞损伤使膜通透性改变,导致介质中ALT活力明显升高;AST主要分布在肝细胞的线粒体中,其余存在于胞浆,当肝细胞严重受损时,肝细胞线粒体进一步遭到破坏,大量AST释放,使介质中AST活力明显升高[16]。因此,肝细胞培养液上清中LDH、ALT、AST漏出量是评价肝细胞受损的敏感指标。本实验表明,各浓度NP作用NCTC1469细胞后,各给药组上清液中LDH、ALT、AST活性高于自然释放组,当NP浓度高于1 μmol/L时,上清液中LDH、ALT、AST活性与自然释放对照组相比具有显著性差异,且呈一定的剂量依赖性。其中,AST升高幅度高于ALT,提示肝细胞线粒体破坏,表明NP对NCTC1469细胞具有较强的损伤作用,破坏肝细胞生长微环境,引起膜通透性异常增大。
污染物在生物体内代谢过程中可进行氧化还原循环,产生大量的ROS,这些ROS可引发机体氧化应激,进而产生一系列的毒性效应[17-19]。相关研究表明,NP可使细胞内ROS增加,调节细胞周期,抑制细胞增殖,甚至导致细胞死亡[20]。氧化应激不仅可由细胞内ROS产生过多而造成,细胞内抗氧化物质减少同样可引起氧化应激。GSH是主要的细胞内抗氧化物质,在细胞内参与氨基酸转运,拮抗外源性毒物,修复氧自由基损伤,调节机体免疫功能以及维持细胞蛋白质结构和功能等方面发挥着重要作用[21]。本实验测定了NP作用后细胞内ROS和GSH水平,结果显示,NP刺激NCTC1469细胞后,细胞内ROS水平与空白对照组相比显著升高,并与NP作用浓度呈正相关。相反,NP作用后细胞内GSH含量与空白对照组相比显著降低,且呈一定剂量依赖性。提示NP可通过促进细胞内ROS生成,减少细胞内GSH含量,从而诱导NCTC1469细胞产生氧化应激。
总之,上述研究结果表明,小鼠肝细胞NCTC1469暴露于NP环境下时,使肝细胞增殖明显降低,细胞培养上清液中LDH、ALT、AST渗出量明显增加,表明一定浓度的NP对肝细胞具有损伤作用。同时,细胞内ROS水平明显升高,且胞内GSH含量显著降低,造成细胞内活性氧类产生过多超过抗氧化物的清除能力,氧化系统和抗氧化系统失衡而对细胞造成损害。由此可以推测NP引起NCTC1469细胞的氧化应激效应可能是导致其毒性作用的机制之一。但NP究竟是如何通过细胞内转导途径对细胞造成损伤还需要做进一步的研究,因此大量的研究工作有待于今后继续进行。
[1] 马强, 白桦, 王超, 等. 液相色谱-串联质谱法同时测定纺织品和食品包装材料中的壬基酚, 辛基酚和双酚 A[J]. 分析化学, 2010, 38(2): 197-201.
[2] INOUE K, KONDO S, YOSHIE Y, et al. Migration of 4-nonylphenol from polyvinyl chloride food packaging films into food simulants and foods[J]. Food Additives & Contaminants, 2001, 18(2): 157-164.
[3] GUENTHER K, HEINKE V, THIELE B, et al. Endocrine disrupting nonylphenols are ubiquitous in food[J]. Environmental Science & Technology, 2002, 36(8): 1676-1680.
[4] COX C. Nonyl phenol and related chemicals[J]. Journal of Pesticide Reform, 1996, 16: 15-20.
[5] MAO Zhen, ZHENG Yuanling, ZHANG Yanqiu. Behavioral impairment and oxidative damage induced by chronic application of nonylphenol[J]. International Journal of Molecular Sciences, 2010, 12(1): 114-127.
[6] SENTHIL KUMARAN S, KAVITHA C, RAMESH M, et al. Toxicity studies of nonylphenol and octylphenol: hormonal, hematological and biochemical effects in Clarias gariepinus[J]. Journal of Applied Toxicology, 2011, 31(8): 752-761.
[7] XU Jie, WANG Yang, YU Jie, et al. Immune effects of nonylphenol on offspring of rats exposed during pregnancy[J]. Human and Ecological Risk Assessment, 2010, 16(2): 444-452.
[8] XU Jie, WANG Yang, YU Jie, et al. Toxic effect of gestational exposure to nonylphenol on F1 male rats[J]. Birth Defects Research Part B: Developmen tal and Reproductive Toxicology, 2010, 89(5): 418-428.
[9] 张诺, 贾瑞宝, 孙韶华, 等. 壬基酚的检测及毒理学研究进展[J]. 环境与健康杂志, 2013, 30(4): 362-365.
[10] 俞捷, 吴芹, 张镖, 等. 壬基酚对机体的毒性影响及其机[J]. 环境卫生学杂志, 2013, 3(3): 268-272.
[11] COOPER S, LATENDRESSE J R, DOERGE D R, et al. Dietary modulation of p-nonylphenol-induced polycystic kidneys in male Sprague-Dawley rats[J]. Toxicological Sciences, 2006, 91(2): 631-642.
[12] 范奇元, 金泰廙, 丁训诚, 等. 消化道摄入壬基酚在大鼠体内的分布与清除[J]. 环境与职业医学, 2002, 19(8): 228-230.
[13] 郭彤, 张高峰, 朱宝长. 壬基酚或双酚 A 对原代培养鲫肝细胞毒性的影响[J]. 首都师范大学学报: 自然科学版, 2009, 30(2): 35-41.
[14] 郭宇航, 黄仁彬, 段小群, 等. 牛磺酸对原代培养大鼠肝细胞的毒性作用研究[J]. 中国现代医药杂志, 2007, 9(7): 72-74.
[15] SEDDON W L, LADD PROSSER C. Non-enzymatic isolation and culture of channel catfish hepatocytes[J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 1999, 123(1): 9-15.
[16] ZHOU Xin, TU Zhiguang. Clinical biochemistry and biological chemistry test[M]. Beijing: People’s Medical Publishing House, 2003: 166-167.
[17] DI GIULIO R T, WASHBURN P C, WENNING R J, et al. Biochemical responses in aquatic animals: a review of determinants of oxidative stress[J]. Environmental Toxicology and Chemistry, 1989, 8(12): 1103-1123.
[18] HUGGETT R J, KIMERLE R A, MEHRLE Jr P M, et al. Biomarkers: biochemical, physiological, and histological markers of anthropogenic stress[M]. Lewis publishers Boca Raton, FL, 1992: 76-83.
[19] FENG Tao, ZHENG Weiyun, HONG Wanshu, et al. Effect of benzo (α) pyrene on antioxidant enzyme activities in Boleophthalmus pectinirostris liver[J]. 应用生态学报, 2001,12(3): 422.
[20] GONG Yi, HAN Xiaodong. Nonylphenol-induced oxidative stress and cytotoxicity in testicular Sertoli cells[J]. Reproductive Toxicology, 2006, 22(4): 623-630.
[21] 王咏梅. 自由基与谷胱甘肽过氧化物酶[J]. 解放军药学学报, 2005, 21(5): 369-371.
Nonylphenol Induces Injury and Variations in ROS and GSH Content of NCTC1469 Cells
CHEN Yang-jie, LIU Xiao-zhen, HUANG Dan-fei, XIE Ming-yong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Objective:To explore the effect of nonylphenol (NP) on inducing injury and changing ROS and GSH contents in NCTC1469 cells. Methods: Cultured cells were treated with NP (0, 0. 01, 0.1, 1, 10 μmol/L and 100 μmol/L) for 24 h. Then, cell viability was assessed with a cell counting kit; the NP-induced injury was evaluated by detecting lactate dehydrogenase (LDH), alanine aminotransamine (ALT) and aspartate aminotransaminase (AST) activities in cell culture supernatant and the contents of intracellular glutathione (GSH) and reactive oxygen species (ROS) were assayed by flow cytometric method. Results: NP could inhibit NCTC1469 cell proliferation and promote ROS generation significantly in a dose-dependent manner. Compared with the control group, the LDH and ALT activities in cell culture supernatant from 0.1–100 μmol/L NP groups had a significant increase, while the AST activity increased dramatically only in 1–100 μmol/L NP groups. NP could decrease intracellular GSH content in a dose-dependent manner, and there was a significant difference when compared with the control group. Conclusion: NP can induce NCTC1469 cells injury by up-regulating the level of ROS and downregulating the content of GSH.
nonylphenol; NCTC1469 cells; oxidative stress
Q291
A
1002-6630(2014)03-0198-05
10.7506/spkx1002-6630-201403040
2013-10-10
国家“973”计划项目 (2012CB720805);科技部国际合作项目(2010DFA31780);国家基金委中德科学基金中心合作项目(GZ731)
陈泱杰(1990—),女,硕士研究生,研究方向为食品科学。E-mail:chenyangjie0914@126.com
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品化学、食品营养与安全。E-mail:myxie@ncu.edu.cn
