苦荞10 kD过敏原的重组表达及部分性质分析
2014-01-18邓丹丹李学俊
陈 鹏,封 雪,王 磊,邓丹丹,李学俊
(西北农林科技大学生命科学学院,陕西 杨凌 712100)
苦荞10 kD过敏原的重组表达及部分性质分析
陈 鹏,封 雪,王 磊,邓丹丹,李学俊
(西北农林科技大学生命科学学院,陕西 杨凌 712100)
以苦荞种子灌浆期cDNA文库中获得的苦荞10 kD过敏原基因序列TBAP10(tartary buckwheat 10 kD allergen protein,TBAP10;GenBank登录号JK729379.1)为基础,构建重组表达载体pET47b-TBAP10,重组蛋白在大肠杆菌BL21 Star(DE3)中以包涵体形式表达。经包涵体复性和钴离子螯合层析纯化目的蛋白,并对其过敏活性、热稳定性及在模拟胃肠环境中的稳定性进行了分析。Western blotting显示该蛋白与苦荞16 kD过敏蛋白Fag t2存在免疫交叉反应。竞争性ELISA证明重组蛋白TBAP10具有与荞麦过敏患者血清IgE特异的结合活性;TBAP10具有强的热稳定性,能耐受15 min的沸水浴;模拟胃肠环境的消化结果显示TBAP10对胃蛋白酶具有强的耐受性,但对胰蛋白酶无耐受性。
原核表达;过敏蛋白;免疫性质;模拟胃肠消化
过敏性疾病的发病率在全世界范围内呈上升趋势,在过去10年里食物过敏患者增长了近一倍。有资料显示,高达6%的儿童以及3%~4%的成年人对一种或多种食物过敏[1]。食物过敏最常见的临床症状表现为皮肤瘙痒、湿疹、荨麻疹、头晕、恶心、呕吐、腹泻,甚至少数人还会发生过敏性休克。因此,食品过敏已成为备受关注的食品安全问题。
荞麦由于其独特的营养价值和药用价值而日益获得人们的青睐,但对部分人来说,摄食荞麦会引起过敏。1909年,Smith[2]报道了被称为“荞麦中毒”的荞麦过敏症。1972年,Horesh[3]首次报道美国儿童对荞麦过敏的研究结果,证实其病理机制为IgE介导的I型速发过敏反应。Noma等[4]于2001年首次报道了荞麦过敏的致死病例。荞麦中引起过敏的主要组分是蛋白质。Yoshioka等[5]于2004年鉴定出甜荞22 kD过敏蛋白为IgE抗体的主要结合蛋白,并证明有6个氨基酸为IgE结合的关键位点;2006年,Morita等[6]证实了这一结果并鉴定出甜荞15 kD的过敏蛋白;Marija等[7]的研究结果显示荞麦过敏蛋白主要存在于种子贮藏蛋白的低分子质量区,并鉴定出分子质量为9、16、19、24 kD的过敏蛋白。随着全球范围内食用荞麦人数的激增,有关荞麦过敏的报道也在不断的增加。Sammut等[8]首次报道英国荞麦过敏的成人病例,利用皮肤点刺实验证实其为IgE介导的致敏反应,并在报道中指出随着荞麦消费量的增加,荞麦过敏现象在英国将越来越普遍。国内学者对苦荞22、24、56 kD过敏原进行了克隆和重组表达研究,并利用体外IgE结合实验进行了过敏活性的分析[9-12]。迄今为止对于苦荞低分子质量过敏蛋白的深入研究报道较少。Jeon等[13]首先鉴定出苦荞中存在有分子质量约为10 kD的过敏原,Chen Peng等[14]克隆了苦荞16 kD过敏蛋白基因(GenBank登录号:ADW27428.1),建立了该过敏蛋白基因的重组表达体系并对其分子特性进行了分析,在利用兔抗苦荞16 kD过敏原的多克隆抗体对苦荞种子清蛋白进行Western杂交分析时,检测到更低分子质量的杂交信号,推测其可能是与16 kD过敏原同源的苦荞10 kD过敏原。
为了进一步探究苦荞10 kD过敏原的性质和生物学功能,本研究以苦荞种子灌浆期cDNA文库中获得的10 kD过敏蛋白基因序列为基础构建其重组表达体系,并检测重组蛋白的过敏活性,为分析该蛋白的核心过敏表位、结构与功能的关系以及研制低敏脱敏治疗疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
原核表达载体pET47b、含有TBAP10基因的质粒pTriplEx2-TBAP10、大肠杆菌菌株BL21 Star(DE3)和TOP10 本实验室保存。
1.1.2 试剂
荞麦过敏患者血清(血清中总IgE为350.3 IU/mL,来自于陕西省宝鸡市一名对荞麦过敏的31岁女性患者,在接触荞麦皮枕头后出现咳嗽、流眼泪,哮喘等症状;食用含荞麦食品后即出现腹泻、呕吐、浑身起麻疹,呼吸困难等症状)、兔抗苦荞16 kD过敏原Fag t2多克隆抗体本实验室保存;辣根过氧化物标记的羊抗人IgE 美国Gaithersburg MD公司;辣根过氧化物标记的羊抗兔IgG博奥森公司;胃蛋白酶和胰蛋白酶 美国Amresco公司;限制性核酸内切酶SacⅡ和SmaⅠ、T4 DNA连接酶、蛋白分子质量Marker 加拿大Fermentas公司;IProof DNA聚合酶 美国Bio-Rad公司;DNA Marker 大连宝生物工程有限公司;质粒提取及PCR产物纯化试剂盒 安徽优晶生物工程有限公司;金属离子螯合层析介质Talon Resin 美国Clontech公司;引物合成及测序由北京奥科生物技术有限责任公司完成;重组蛋白的分子质量测定由BGI(华大基因)完成。
1.1.3 仪器与设备
Spectra Max M2酶标仪 Molecular Devices公司。
1.2 方法
1.2.1 苦荞10 kD过敏原基因的序列分析
应用BLAST(http://www.ncbi.nlm.nh.gov/BLAST)在线软件对文库中获得的基因序列(登录号为JK729379.1)进行同源性分析。利用SignalP 3.0 Server(http://www.Cbs.dtu.dk/services/SignalP/)对编码的氨基酸序列进行信号肽预测。利用ExPASy在线软件对其进行等电点及分子质量预测。蛋白质的同源性比较采用ClustalX2程序进行分析。
1.2.2 原核表达载体的构建
根据TBAP10的基因设计并合成引物,上游引物GM1-1:5’-GACTCCCCGCGGGGGACAGCCAAAT GAGGTCGAA-3’(下划线为SacⅡ酶切位点)和下游引物GM1-2:5’-GCGCGCCCCGGGTTACTCGTAA ACCCTAGTACCCATCC-3’(下划线为SmaⅠ酶切位点)。以质粒pTriplEx2-TBAP10为模板,PCR获得目标基因。PCR扩增体系为(25 øL):5×PCR Buffer 5 øL,dNTPs(10 mmol/L) 0.5 øL,上下游引物(10 ømol/L)各1 øL,pTriplEx2-TBAP10质粒45 ng,IProof DNA聚合酶0.5 U。PCR反应条件:96 ℃、2 min,95 ℃、15 s,59 ℃、25 s,72 ℃、30 s,共30个循环,最后72 ℃延伸3 min。PCR产物采用PCR产物回收试剂盒纯化后进行SacⅡ/SmaⅠ双酶切,质粒pET47b采用SacⅡ/SmaⅠ双酶切,胶回收大片段后进行连接,连接产物转化大肠杆菌TOP10。经菌落PCR及双酶切鉴定的阳性克隆送北京奥科生物技术公司测序,测序验证正确的重组质粒命名为pET47b-TBAP10。
1.2.3 重组蛋白的诱导表达以及可溶性分析
将重组质粒pET47b-TBAP10转入BL21 Star(DE3),挑取阳性克隆接种于5 mL(含50 μg/mL Kan)的LB液体培养基中,37 ℃过夜培养。次日,按1∶100的比例转接到新的5 mL LB培养基中(含50 μg/mL Kan),37 ℃培养至OD600nm值约为0.6时加入诱导剂IPTG至终浓度为1 mmol/L,诱导6 h,取1 mL菌液,离心收集菌体。同时,以BL21 Star(DE3)和转入pET47b空载体的BL21 Star(DE3)作为对照。收集的菌体中加入50 øL 2×Loading buffer和50 øL ddH2O,混匀,沸水浴中煮5~10 min,12 000 r/min离心2 min,取上清用质量浓度为12.5 g/100 mL的SDS-PAGE鉴定。目的蛋白的可溶性分析参照文献[15]进行。
1.2.4 重组蛋白的分离纯化及蛋白分子质量的测定
包涵体的纯化、复性和Talon Resin纯化参照文献[16]进行。将纯化的目的蛋白保存在20 mmol/L Tris-HCl、50 mmol/L NaCl溶液中(质量浓度为0.763 mg/mL),送往华大基因测定蛋白分子质量。
1.2.5 重组蛋白免疫活性的鉴定
1.2.5.1 Western blotting鉴定重组蛋白
质量浓度为15 g/100 mL的SDS-PAGE分离纯化的TBAP10,石墨电极半干电转移法转移至硝酸纤维素膜上。转膜条件为50 mA、50 min。以兔抗苦荞16 kD多克隆抗体为一抗,辣根过氧化物标记的羊抗兔IgG为二抗。Western blotting的具体操作过程参照文献[16]进行。
1.2.5.2 竞争性ELISA检测重组蛋白的IgE结合活性
荞麦过敏患者血清用血清稀释液(0.1 g/100 mL BSA-PBS,0.05%吐温-20,pH7.0)稀释20倍[17],TBAP10用血清稀释液稀释8倍(终质量浓度为0.1 øg/øL),苦荞蛋白粗提液用血清稀释液稀释83倍(终质量浓度为0.1 øg/øL)。
酶标板用1 μg/孔苦荞蛋白粗提液于4 ℃包被过夜,磷酸盐缓冲液(PBS)(8 mmol/L Na2HPO4•12H2O、1.4 mmol/L KH2PO4、2.7 mmol/L KCl、140 mmol/L NaCl)洗板5次,以100 øL PBS+1 g/100 mL BSA(含0.05%吐温-20,pH 7.4)缓冲液37 ℃封闭1h。PBS缓冲液洗板5次,在不同的微孔中分别加入100 øL稀释后的过敏患者血清,50 øL稀释后的TBAP10与50 øL稀释后的过敏患者血清混合液,同时以50 øL稀释后的苦荞蛋白粗提液与50 øL稀释后的过敏患者血清的混合液为对照,37 ℃孵育1 h。PBS缓冲液洗板5次,每孔加入HRP标记的羊抗人IgE抗体(用血清稀释液稀释2 000倍)100 øL,37 ℃孵育3 h。PBS缓冲液洗板5次,加入底物TMB溶液,37 ℃反应15 min,立即加入2 mol/L H2SO4终止显色反应。用酶标仪测定450 nm的光密度值(OD450nm)。整个实验重复3次。竞争抑制率的计算参照如下公式[18]。
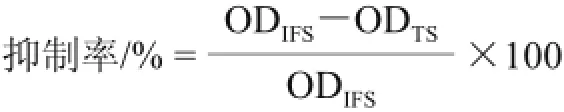
式中:ODIFS为无抑制剂样品的OD450nm值,即荞麦过敏患者血清的ODIFS;ODTS为待测样品的OD450nm值,即苦荞蛋白粗提液与荞麦过敏患者血清的ODTS1或TBAP10与荞麦过敏患者血清的ODTS2。
1.2.6 重组蛋白的热稳定性分析
取8个1.5 mL离心管,每管各加入500 øL纯化的TBAP10(蛋白质量浓度为0.763 mg/mL),沸水浴持续保温,分别在0、5、10、15、20、30、40、60 min时取样,12 000 r/min离心15 min,取上清,分别加入2×SDS-PAGE上样缓冲液,沸水煮5~10 min,12 000 r/min离心2 min,分别取等量上清进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE),分离胶质量浓度为12.5 g/100 mL。
1.2.7 重组蛋白在模拟胃肠环境中的稳定性
模拟胃液(3.2 mg/mL胃蛋白酶,34 mmol/L NaCl, 2 mol/L HCl调pH值为1.2)参照文献[19]配制。取9个1.5 mL离心管,每管加入100 øL模拟胃液,37 ℃保温10 min,然后各管中依次加入37 ℃预热的目的蛋白溶液100 øL(蛋白质量浓度为0.763 mg/mL),准确计时,反应时间为15、30s和2、8、15、30、60、90 min。反应结束时,立刻加入25 øL 0.168 mol/L Na2CO3终止反应。0 s中的样品是将100 øL模拟胃液先与25 øL Na2CO3中和终止反应,再加入100 øL的目的蛋白。反应结束时,每管取20 øL于干净的1.5 mL离心管中,分别加入5 øL 5×SDS-PAGE上样缓冲液,沸水煮5~10 min,12000 r/min离心2 min,取20 øL上清进行SDS-PAGE电泳,分离胶质量浓度为12.5 g/100 mL。
模拟肠液(10 mg/mL胰蛋白酶,50 mmol/L KH2PO4,0.2 mol/L NaOH调pH值为7.5±0.1)参照文献[19]配制。取8个1.5 mL离心管,每管加入100 øL模拟肠液,37 ℃保温10 min,然后各管中依次加入37 ℃预热的目的蛋白100 øL(蛋白质量浓度为0.763 mg/mL),准确计时,反应时间为5、10、15 s和1、2、4、8 min。反应结束时,立刻放入沸水中煮5 min终止反应。0 s中的样品是将100 øL模拟肠液先在沸水中煮5 min使酶失活,再加入100 øL的目的蛋白。反应结束时,每管取20 øL于干净的1.5 mL离心管中,分别加5 øL 5×SDS-PAGE上样缓冲液,沸水煮5~10 min,12 000 r/min离心2 min,取20 øL上清进行SDS-PAGE电泳,分离胶质量浓度为12.5 g/100 mL。
2 结果与分析
2.1 苦荞10 kD过敏原的序列分析

图1 苦荞10 kD过敏原和与其同源的16 kD过敏原的氨基酸序列比对Fig.1 Alignment of amino acid sequences between TBAP10 and BALP16
从cDNA文库中获得苦荞10 kD过敏原ORF为402 bp,编码133个氨基酸,在线软件预测其信号肽为N端的19个氨基酸残基,成熟蛋白包含114个氨基酸残基,理论分子质量为14.87 kD,等电点为5.75,其一级结构与甜荞8 kD过敏原(Fujino[20]认为其是10 kD)的相似度为96%,与苦荞16 kD过敏原的相似度为53%。应用ClustalX2软件对苦荞10 kD过敏原和16 kD过敏原(Fag t2)的氨基酸序列进行比对(图1),结果显示二者在一级结构上存在部分相同的肽段。
2.2 原核表达载体的构建

图 22 TBBAAPP1100基因的PPCCRR扩增Fig.2 PCR amplification of TBAP10 gene
由图2可知,琼脂糖凝胶电泳显示TBAP10的PCR扩增产物在约340 bp处为单一条带,与目的片段大小相符。构建的重组表达质粒pET47b-TBAP10经SacⅡ和SmaⅠ双酶切后,产生约340 bp的酶切片段(图3),与扩增的TBAP10基因片段大小相符。测序显示其与cDNA文库中获得的序列一致。

图3 重组质粒pET47b-TBAP10的双酶切鉴定Fig.3 Double digestion of pET47b-TBAP10 with SacⅡ and SmaⅠ
2.3 重组蛋白的诱导表达及可溶性分析
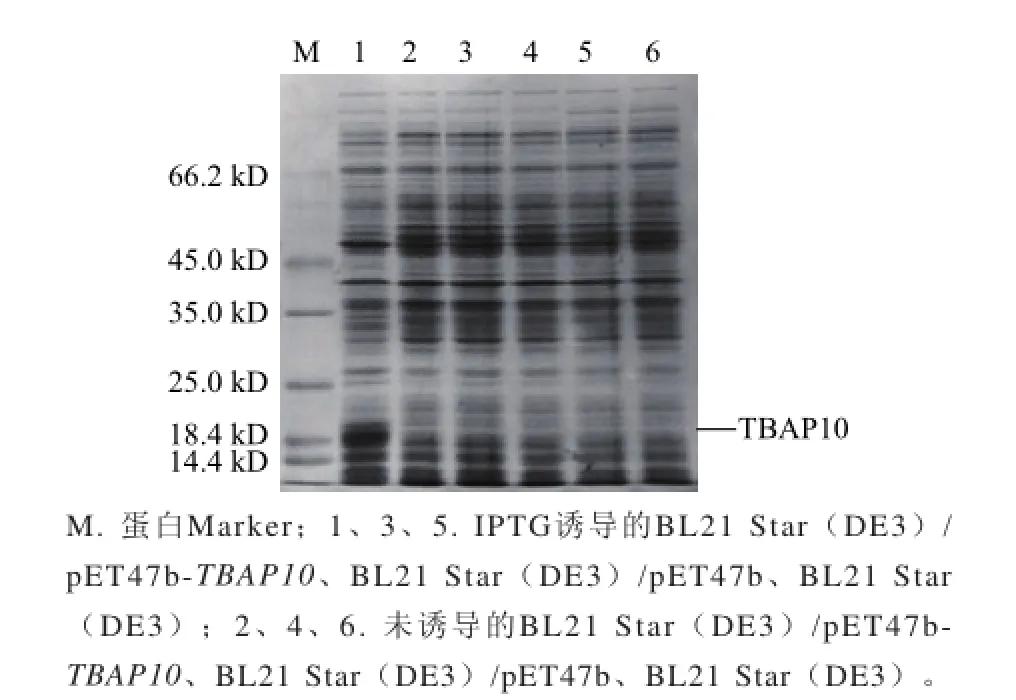
图4 TBAP10诱导表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis for the expression of TBAP10
由图4的SDS-PAGE结果显示,转化pET47b-TBAP10的BL21 Star(DE3)菌体样品在18 kD处多一条蛋白带。超声裂解后该蛋白带仅存在于菌体沉淀中(图5),说明目的蛋白在大肠杆菌中主要以包涵体形式表达。
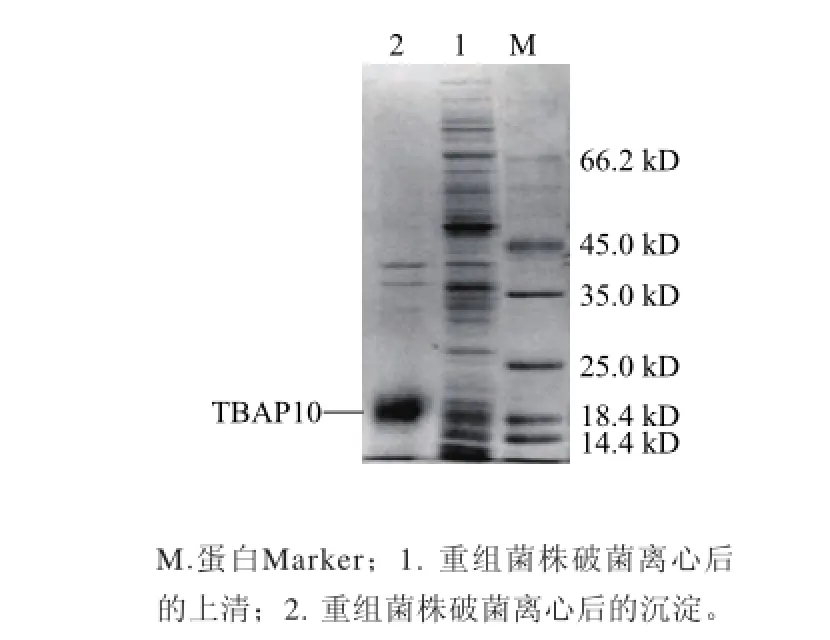
图5 SDS-PAGE分析目的蛋白的可溶性Fig.5 Solublity of target TBAP10 protein
2.4 重组蛋白的分离纯化及分子质量鉴定
2.4.1 重组蛋白的分离纯化
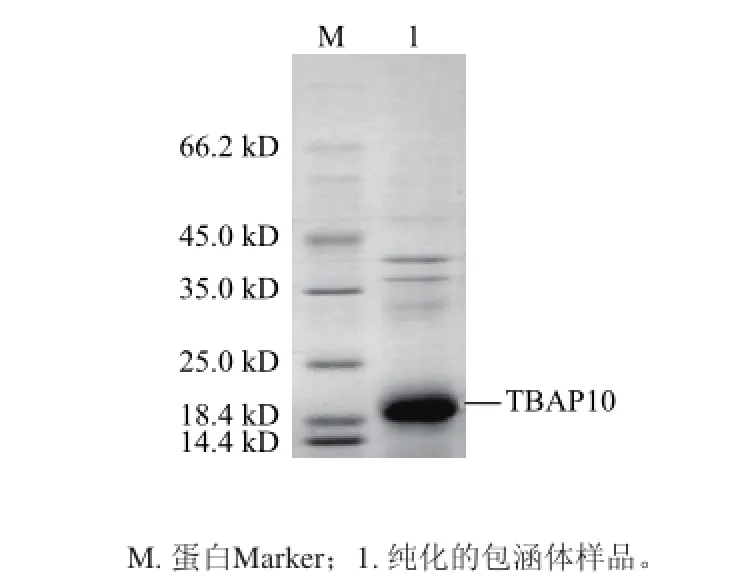
图6 包涵体蛋白的SDS-PAGE电泳分析Fig.6 SDS-PAGE analysis of purified protein from inclusion body
由图6可知,菌体经过多次超声波破碎和洗涤,可除去大量杂蛋白而获得较高纯度的包涵体。纯化的包涵体用含有8 mol/L尿素的溶解液溶解,梯度透析除去尿素,离心后的上清经钴离子螯合层析柱纯化获得了SDS-PAGE显示单一条带的高度可溶TBAP10(图7)。

图7 SDS-PAGE电泳分析钴柱纯化的TBAP10Fig.7 SDS-PAGE analysis of recombinant TBAP10 purified by Talon resin
2.4.2 TBAP10蛋白的分子质量鉴定
经质谱鉴定,重组蛋白TBAP10的分子质量为14.87 kD,与预测的蛋白分子质量大小一致。
2.5 重组蛋白免疫活性的鉴定
2.5.1 TBAP10的Western blotting鉴定
用苦荞16 kD重组过敏原所制备的多克隆抗体对TBAP10进行免疫印迹分析,结果显示有一条特异性条带(图8),说明重组表达的TBAP10与苦荞16 kD过敏原的抗体之间存在交叉反应,二者具有共同的表位。

图8 重组蛋白的Western blotting分析Fig.8 Western blotting assays of recombinant protein TBAP10
2.5.2 竞争性ELISA检测重组蛋白TBAP10的IgE结合活性

表1 竞争性酶联免疫反应检测重组蛋白的IgE活性Table 1 Competitive ELISA detection of the IgE binding activity of recombinant TBAP10 protein
表1的竞争性ELISA结果显示,重组蛋白与荞麦过敏患者血清的IgE具有特异结合的活性,TBAP10的竞争性抑制率约为苦荞蛋白粗提液的49.1%。
2.6 重组蛋白的热稳定性分析
沸水条件下重组TBAP10在15 min内保持可溶状态,随着加热时间的延长上清中目标蛋白含量逐渐减少,沸水浴60 min后,由图9可知,上清中仍可见目的蛋白的存在,表明重组TBAP10具有强的热稳定性。
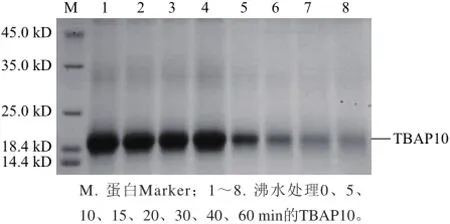
图9 TBAP10沸水浴不同时间时上清的SDS-PAGE电泳分析Fig.9 SDS-PAGE analysis of heat treated TBAP10 protein at different intervals
2.7 重组蛋白在模拟胃肠环境中的稳定性
TBAP10在模拟胃液和模拟肠液中处理不同时间的电泳结果(图10)显示,TBAP10在模拟胃液中较为稳定,处理90 min后主带依然清晰可见,而在模拟肠液中极不稳定,处理15 s之后几乎看不到目标蛋白条带(图11)。
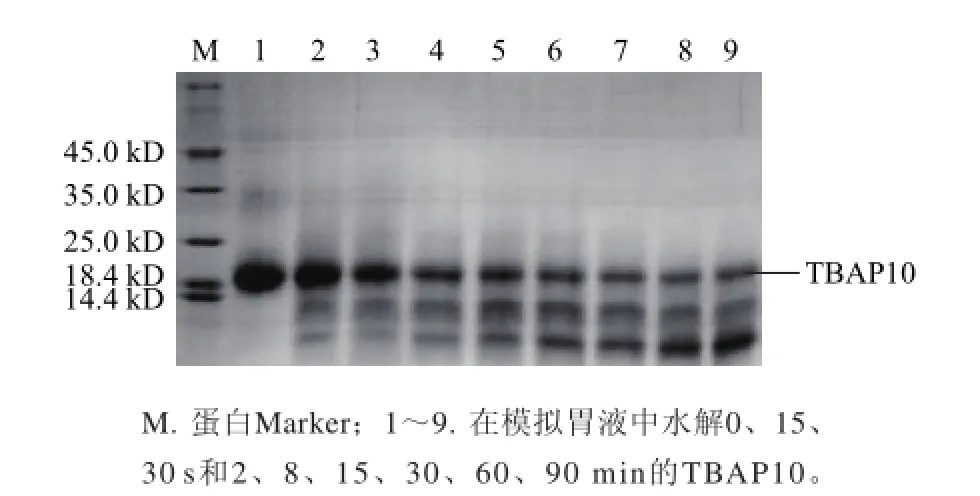
图10 SDS-PAGE分析TBAP10在模拟胃液中的稳定性Fig.10 SDS-PAGE analysis for TBAP10 stability in simulated gastric fluid
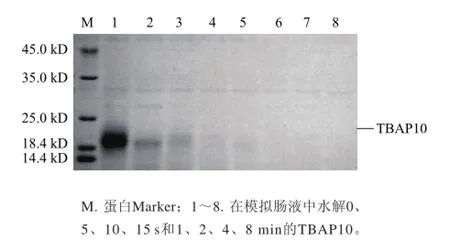
图11 SDS-PAGE分析TBAP10在模拟肠液中的稳定性Fig.11 SDS-PAGE analysis for TBAP10 stability in simulated intestinal fluid
3 讨 论
荞麦过敏是由IgE介导的Ⅰ型超敏反应,2S清蛋白在诱导IgE免疫应答过程中起着一定的作用。研究报道,甜荞10 kD过敏原属于2S清蛋白家族,能与IgE特异性的结合[20]。Jeon等[13]根据甜荞10 kD过敏蛋白的基因序列利用PCR技术克隆了疑似苦荞10 kD过敏原的基因,证实其属于2S清蛋白家族,但缺乏蛋白水平的实验验证。本研究以苦荞籽粒发育期cDNA文库筛选的苦荞10 kD过敏蛋白基因为基础,通过原核表达系统表达重组蛋白TBAP10,并对苦荞10 kD重组过敏原的过敏活性进行了鉴定。Western blotting结果显示,重组10 kD过敏蛋白能与苦荞16 kD过敏原的多克隆抗体发生交叉反应,原因是苦荞10 kD过敏原与16 kD过敏原在一级结构上具有53%的相似度,具有相同的表位;竞争性ELISA结果显示,重组10 kD过敏原能与IgE结合,其竞争抑制活性约为天然过敏原蛋白混合物的49.1%,原因可能是酶标板包被的蛋白为天然过敏原蛋白混合物,这些过敏蛋白均可与重组TBAP10竞争结合过敏患者血清中的IgE,苦荞10 kD过敏原可能为苦荞种子中主要的过敏蛋白之一。
大多数植物过敏蛋白具有高度的稳定性,包括热稳定性和抗蛋白酶水解稳定性。Tanaka等[21]证实甜荞16 kD过敏原具有抗胃蛋白酶消化的特性,Park等[22]证明了甜荞9 kD过敏原具有胰蛋白酶抑制剂活性,郭彦飞[16]证明天然苦荞16 kD过敏原和重组苦荞16 kD过敏原均具有强的热稳定性及抗胃蛋白酶消化的特性。苦荞重组10 kD过敏原的热稳定性及在模拟胃肠环境中的稳定性实验表明,重组10 kD过敏原具有强的热稳定性及抗胃蛋白酶水解特性。
本研究中,重组TBAP10用SDS-PAGE法检测的分子质量为18.4 kD,与理论分子质量14.87 kD(含N端的His-tag)存在差异,这与其N端融合的His标签有关。唐威华等[23]发现一些融合His-tag蛋白在SDS-PAGE中迁移速度变慢,从而造成分子质量测定值偏大的现象,融合His-tag造成局部高密度的正电荷是蛋白迁移速度变慢的主要原因之一。本研究利用质谱对纯化的重组蛋白进行了分子质量分析,证实其分子质量与理论分子质量相同,也进一步证实了上述解释。
本研究成功实现了苦荞10 kD过敏原基因在原核系统中的表达及包涵体的复性和纯化,为研究该过敏原的结构与功能、脱敏治疗疫苗以及培育低敏苦荞品种提供研究思路。
[1] SCOTTH H, SICHERER M D, HUGH A, et al. Food allergy[J]. Journal of Allergy and Clinical Immunology, 2006, 117(Suppl 2): 470-475.
[2] SMITH H L. Buckwheat-poisoning with report of a case in man[J]. Arch Intern Med, 1909, 3(4): 350-359.
[3] HORESH A J. Buckwheat sensitivity in children[J]. Ann Aliergy, 1972, 30(12): 685-689.
[4] NOMA T, YOSHIZAWA I, OGAWA N, et al. Fatal buckwheat dependent exercised-induced anaphylaxis[J]. Asian Pacific Journal of Allergy and Immunology, 2001, 19(4): 283-286.
[5] YOSHIOKA H, OHMOTO T, URISU A, et al. Expression and epitope analysis of the major allergenic protein Fag e 1 from buckwheat[J]. Journal of Plant Physiology, 2004, 161(7): 761-767.
[6] MORITA N, MAEDA T, SAI R, et al. Studies on distribution of protein and allergen in graded flours prepared from whole buckwheat grains[J]. Food Research International, 2006, 39(7): 782-790.
[7] MARIJA L, IVAN K. Buckwheat (Fagopyrum esculentum Moench) low molecular weight seed proteins are restricted to the embryo and are not detectable in the endosperm[J]. Plant Physiology and Biochemistry, 2005, 43(9): 862-865.
[8] SAMMUT D, DENNISON P, VENTER C, et al. Buckwheat allergy: a potential problem in 21stcentury Britain[J]. BMJ Case Rep, 2011. doi: 10. 1136/bcr. 09. 2011. 4882.
[9] 侯晓军, 畅文军, 陈立钊, 等. 一种苦荞主要过敏原基因cDNA的克隆及序列分析[J]. 中国生物化学与分子生物学报, 2003, 19(4): 436-440.
[10] 畅文军, 景巍, 侯晓军, 等. 苦荞过敏蛋白TB22的原核表达及纯化[J]. 中国生物工程杂志, 2003, 23(11): 76-79.
[11] ZHANG Xin, YUAN Jingming, CUI Xiaodong, et al, Molecular cloning, recombinant expression, and immunological characterization of a novel allergen from tartary buckwheat[J]. J Agric Food Chem, 2008, 56(22): 10947-10953.
[12] REN Xiaoxia, ZHANG Xin, LI Yuying, et al. Epitope mapping and immunological characterization of a major allergen TBa in tartary buckwheat[J]. Biotechnology Letters, 2010, 32(9): 1317-1324.
[13] JEON Y J, HONG K W. A duplex PCR assay for differentiating native common buckwheat and tartarian buckwheat, and its application for the rapid detection of buckwheat ingredients in food[J]. Food Science and Technology, 2008, 17(2): 357-361.
[14] CHEN Peng, GUO Yanfei, YAN Qian, et al. Molecular cloning and characterization of Fagt2: a 16-kDa major allergen from Tartary buckwheat seeds[J]. Allergy, 2011, 66(10): 1393-1395.
[15] 李学俊, 郭彦飞, 闫倩, 等. 苦荞类过敏原的原核表达及多克隆抗体制备[J]. 西北植物学报, 2011, 31(8): 1524-1530.
[16] 郭彦飞. 苦荞16kDa主要过敏原的原核表达纯化、免疫活性分析及转化拟南芥研究[D]. 杨凌: 西北农林科技大学, 2011.
[17] 张昕, 崔晓东, 王转花. 荞麦过敏原特异性抗体酶联免疫吸附法检测试剂制备[J]. 食品科学, 2011, 32(20): 327-330.
[18] de SILVA H D, SALEH S, KOVACEVIC S, et al. The antibody response to Plasmodium falciparum Merozoite surface protein 4: comparative assessment of specificity and growth inhibitory antibody activity to infection-acquired and immunization-induced epitopes[J]. Malaria Journal, 2011, 10: 266, doi:10.1186/1475-2875-10-266.
[19] US Food and Drug Administration. The national formulary: simulated gastric fluid and simulated intestinal fluid, TS[M]. 23thed. Washington: Rockrille, 1995: 2053.
[20] FUJINO K. Molecular characterization of a 10-kDa buckwheat molecule reactive to allergic patients’ IgE[J]. Allergy, 2004, 59(5): 533-538.
[21] TANAKA K, MATSUMOTO K, AKASAWA A, et al. Pepsinresistant 16kD buckwheat protein is associated with immediate hypersensitivity reaction in patients with buckwheat allergy[J]. Int Arch Allergy Immuno1, 2002, 129(1): 49-56.
[22] PARK S S, ABE K, KIMURA M, et a1. Primary structure and allergenic activity of trypsin inhibitors from the seeds of buckwheat (Fagopyrum esculentum Moench) [J]. FEBS Lett, 1997, 400(1): 103-107.
[23] 唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J]. 植物生理学报, 2000, 26(1): 64-68.
Overexpression and Characterization of 10 kD Allergenic Protein in Tartary Buckwheat
CHEN Peng, FENG Xue, WANG Lei, DENG Dan-dan, LI Xue-jun
(College of Life Science, Northwest A&F University, Yangling 712100, China)
The 10 kD allergen gene (TBAP10) of tartary buckwheat was obtained from the full-length cDNA library during the seed-filling period, and a prokaryotic recombinant expression vector pET47b inserted with TBAP10 gene (pET47b-TBAP10) was constructed. The target protein TBAP10 was expressed in E. coli BL21 Star (DE3) as an inclusion body form. After re-folding and purification by cobalt ion chelating affinity chromatography of the isolated inclusion body, allergenic activity, thermal stability and stability in simulated gastrointestinal environment of the purified TBAP10 protein were analyzed. Western blotting revealed the immunogenic cross-reactivity between 16 kD buckwheat allergic protein and Fag t2. Competitive ELISA demonstrated that the recombinant protein had a binding capability to IgE from buckwheat-allergic patients. TBAP10 had strong thermal stability and could withstand boiling water bath for 15 min. Simulated gastrointestinal digestion experiments indicated that the recombinant protein had strong tolerance to pepsin, while it could be totally degraded after trypsin digestion.
overexpression; allergenic protein; immunological properties; simulated gastrointestinal digestion
Q786
A
1002-6630(2014)03-0128-06
10.7506/spkx1002-6630-201403026
2012-12-19
国家自然科学基金项目(30400282;31171606);西北农林科技大学基本科研业务费专项(QN2009064)
陈鹏(1972—),男,教授,博士,研究方向为蛋白质与酶学。E-mail:pengchen@nwsuaf.edu.cn
